沉默法尼基转移酶对人涎腺腺样囊性癌细胞迁移、侵袭及上皮间充质转化的作用
2022-08-09李文健童磊王奇民韩红钰陈正岗
李文健 童磊 王奇民 韩红钰 陈正岗
1.青岛大学附属青岛市市立医院口腔医学中心,青岛 266071;2.大连医科大学口腔医学院,大连116044
涎腺腺样囊性癌(salivary adenoid cystic carci‐noma,SACC)是常见的上皮源性恶性肿瘤,约占涎腺恶性肿瘤的30%,具有早期血行播散,肺转移率高以及嗜神经生长等特点[1],5 年生存率为70%~90%,但在发生远处转移的病例中,5年生存率骤降至20%左右[2]。因此,阐明影响SACC 侵袭迁移的可能机制对其临床治疗有重要意义。
RAS 家族基因包括HRAS、KRAS、NRAS,其编码合成的RAS 蛋白作为三磷酸鸟苷(guano‐sine triphosphate,GTP)结合蛋白家族中的一员,能够调控细胞的生长发育,同时其异常激活可影响包括PI3K/蛋白激酶B(protein kinase B,AKT)在内的多种下游信号通路,促进人类恶性肿瘤的发生发展[3-4]。法尼基转移酶(farnesyltransferase,FTase)属于异戊二烯基转移酶家族,能够识别RAS 蛋白C 端CAAX 序列,使法尼基团转移到半胱氨酸的残基上,从而完成异戊二烯化修饰,此为RAS 蛋白与细胞膜稳定结合,参与调控恶性肿瘤细胞各种生物学行为的必要条件[5-7]。RAS 家族蛋白均能在稳定状态下进行异戊二烯化,其中KRAS、NRAS 都能被其他异戊二烯基转移酶识别,仅有HRAS 只能被FTase 识别修饰后发挥作用[8],因此在FTase 功能被抑制时,HRAS 蛋白的异戊二烯化就无法正常进行,导致其不能精准定位于细胞膜上,致癌能力减弱[9]。研究[10-12]证明,抑制FTase 活性可对多类HRAS 高表达的恶性肿瘤进展产生较大影响,但对SACC的影响及相关机制尚未明确。
侵袭与迁移一般出现于恶性肿瘤发展的中后期,是影响恶性肿瘤预后的关键生物学行为。研究证实上皮间充质转化(epithelial-mesenchymal transition,EMT)可以使肿瘤细胞获得部分间质细胞表型,从而增强其迁移侵袭能力,是调控包括SACC 在内的多种恶性肿瘤迁移侵袭的关键机制。本研究使用小干扰RNA(small interfering RNA,siRNA)干扰技术于体外沉默FTase,检测其对人SACC 细胞SACC-LM、SACC-83 侵袭迁移及EMT 的影响,探讨其作用机制,以期为临床靶向治疗药物发展提供参考。
1 材料和方法
1.1 主要材料和试剂
人SACC 细胞系SACC-LM 购自上海中乔新舟生物科技有限公司,SACC-83 由山东大学口腔医学院馈赠。根据人FTase基因设计合成的siRNA 购自广州锐博生物科技有限公司;RPMI-1640 培养基、0.25%胰蛋白酶(Gibco公司,美国),胎牛血清(BI 公司,以色列),Lipofectamine 2000(Invi‐trogen 公司,美国),TB Green Premix Ex TadTM试剂盒(TAKARA 公司,日本),实时荧光定量聚合酶链反应(quantitive real-time polymerase chain re‐action,qRT-PCR)引物FTase、HRAS、磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)合成(上海生工生物工程有限公司);兔抗人多克隆抗体FTase、HRAS、上皮钙依赖黏附蛋白(E-cadherin)、波形蛋白(Vimentin)、基质金属蛋白酶(matrix metalloproteinase,MMP)-9、AKT、磷酸化-AKT(phospho-AKT,p-AKT)、p65、磷酸化p65(phospho-p65,p-p65)、羊抗兔-辣根过氧化物酶二抗(Abcam 公司,英国),Tran‐swell小室(Corning公司,美国)。
1.2 细胞培养
人SACC 细胞SACC-LM 和SACC-83 于37 ℃、5%CO2、饱和湿度的环境下使用RPMI-1640 培养基(10%胎牛血清)进行培养,细胞密度达80%左右时,使用0.25%胰蛋白酶消化,终止消化后收集细胞悬液,加入培养基反复吹打,按1∶3 比例传代。
1.3 siRNA转染
根据人FTase 基因序列合成3 条siRNA(表1)和1 条阴性对照序列NC-siRNA,使用处于对数生长期的SACC-LM 和SACC-83 细胞,以2×105个/孔的密度接种于六孔板中,培养至细胞密度达30%~50%时进行转染操作。待转染24 h 后,检测基因的表达。后续实验分为三大组进行:实验组(FTase-siRNA-1 组、FTase-siRNA-2 组、FTase-siR‐NA-3 组),阴性对照组(NC-siRNA 转染组),空白对照组(仅加入转染试剂)。
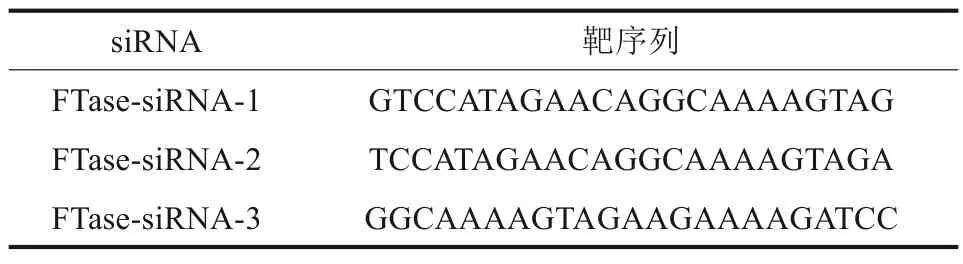
表1 3条FTase-siRNA序列Tab 1 Three FTase-siRNA sequences
1.4 qRT-PCR 检测各组细胞FTase 以及HRAS 的mRNA表达
siRNA 转染24 h 后,使用RNA 提取试剂盒于转染后的各组细胞中提取RNA,检测浓度纯度后进行逆转录反应,各组均取1 μL 互补DNA(com‐plementary DNA,cDNA)为模板进行聚合酶链反应(polymerase chain reaction,PCR)扩增反应,以GAPDH为内参,每组均设3个平行副孔。FTase引物序列:上游5’-GGTGGATGTGAGAAGCG‐CATA-3’,下游5’-GGCCAGGCCACAGAAGG‐TATA-3’;HRAS 引物序列:上游5’-GGCAG‐GAGACCCTGTAGGAG-3’,下游5’-GGTTCACCTGTACTGGTGGAT-3’;GAPDH 引物序列:上游5’-GCACCGTCAAGGCTGAGAAC-3’,下游5’-TGGTGAAGACGCCAGTGGA-3’。按照试剂盒说明配置PCR 反应体系。使用2−ΔΔCt公式量 化FTase 及HRAS mRNA 的相对表达水平。在经FTase-siRNA 处理的3 个实验组中,选取FTase mRNA 相对表达量最低,即FTase 沉默效率最高者进行后续实验。
1.5 蛋白质免疫印迹法(Western blot)检测目的蛋白的表达
siRNA 转染24 h 后,取出各组细胞,磷酸缓冲盐溶液(phosphate buffered saline,PBS)洗涤,加入RIPA 裂解液提取各组细胞总蛋白,使用BCA试剂盒测定蛋白质浓度。每泳道取50 μg 待测样本,在10%聚丙烯酰胺凝胶中电泳分离,湿转法将蛋白转移到聚偏二氟乙烯膜(polyvinylidene flu‐oride,PVDF)膜上。脱脂牛奶室温封闭1 h,分别加入FTase(1∶1 000)、HRAS(1∶1 000)、p65(1∶1 000)、p-p65(1∶500)、MMP-9(1∶500)、AKT(1∶1 000)、p-AKT(1∶1 000)、Vi‐mentin(1∶1 000)、E-cadherin(1∶1 000)等抗体,4 ℃过夜。洗膜3 次后,加入二抗(1∶10 000)室温下孵育1 h,TBST 缓冲液充分漂洗。应用化学发光系统显影,凝胶成像系统拍照,使用Image J 软件测定各组蛋白灰度值,以分析蛋白相对表达水平。
1.6 Transwell 细胞侵袭实验
siRNA 转染24 h 后,取出各组细胞进行消化、离心,PBS 缓冲液冲洗后加入无血清培养基调整密度至每毫升3×105个。取500 μL 细胞悬液接种于Transwell 小室的上室(实验前Matrigel 胶已解冻并分装,均匀铺于上室),取750 μL 含10%胎牛血清的RPMI-1640 完全培养基,培养箱中孵育48 h 后取出,去除孔中培养液,PBS 冲洗,使用棉签拭去上室内的未迁移细胞,4%多聚甲醛固定20 min,0.1%结晶紫染色15 min,PBS 再次冲洗后随机选取5 个区域观察拍照,计算穿膜细胞数量。
1.7 细胞划痕实验
siRNA 转染24 h 后,取出各组细胞,消化后重悬,以每孔5×105个的密度接种于六孔板上,加入3 mL 完全培养基后继续培养24 h,待细胞密度达90%左右时,使用200 μL 无菌移液枪头在孔中央垂直划过单层细胞,移液管吸取PBS 缓冲液轻吹3 次,继续培养,分别于0、24 h 时于显微镜下取样拍照,使用Image J 测量划痕距离,得出相对愈合面积。相对愈合面积=(0 h 划痕面积−24 h 划痕面积)/0 h划痕面积。
1.8 统计学分析
使用SPSS 18.0及GraphPad Prism 8.0分析各组结果,使用t检验进行组间两两比较,多组间比较使用单因素方差分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 FTase、HRAS的mRNA表达
qRT-PCR 结果显示,FTase-siRNA-1 组和FTase-siRNA-2 组的FTase mRNA 表达水平显著低于空白对照组及阴性对照组(P<0.05)(图1),其中FTase-siRNA-1 组FTase mRNA 表达水平最低,证明其siRNA 序列沉默效率最高,选为实验组进行后续研究。各组细胞HRAS 的mRNA 表达差异无统计学意义(P>0.05)。
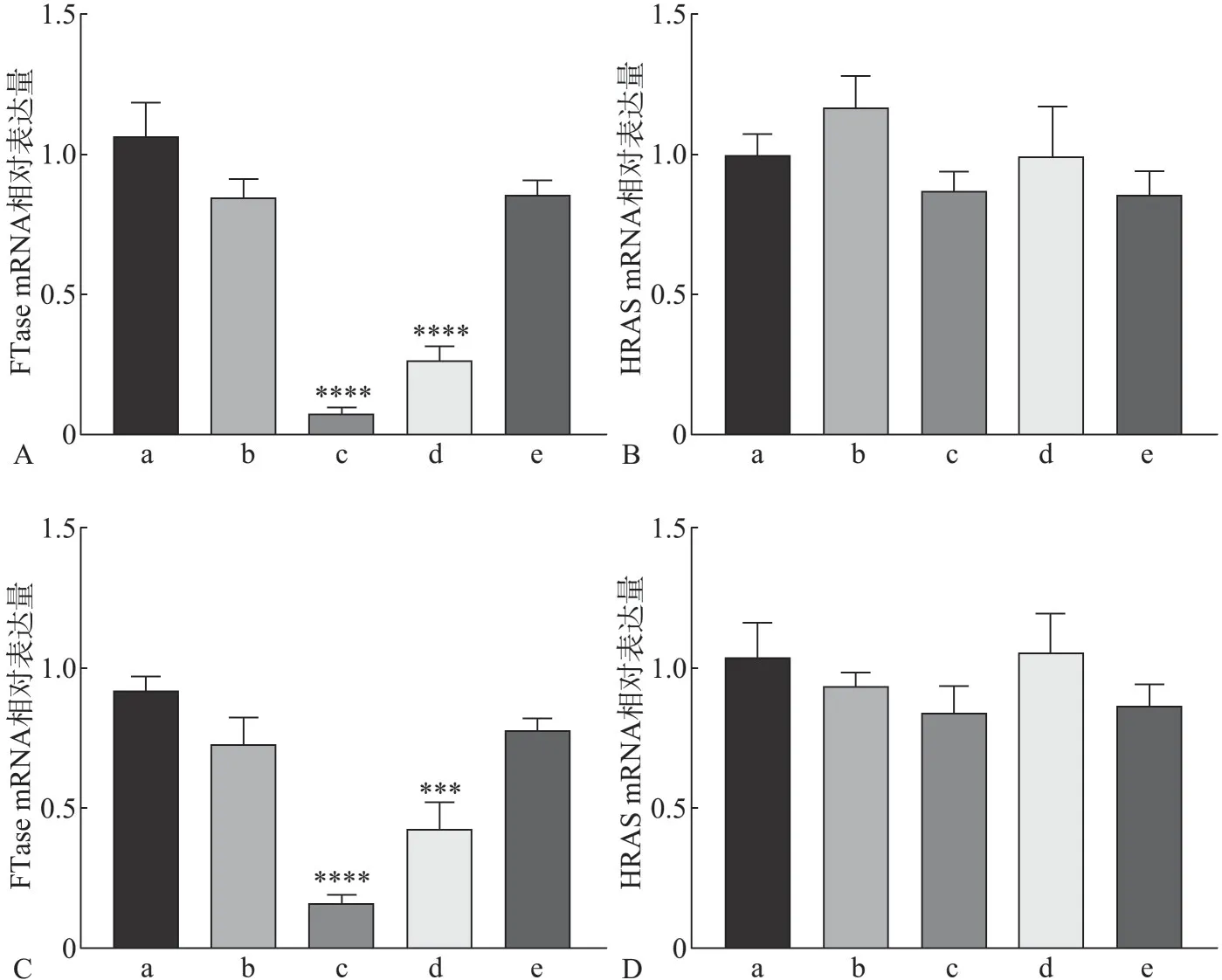
图1 转染后FTase、HRAS mRNA的表达Fig 1 Expression of FTase and HRAS mRNA after FTase-siRNA transfection
2.2 各组细胞FTase、HRAS的蛋白表达
Western blot 实验结果显示,FTase-siRNA-1 组FTase 蛋白表达水平显著低于空白对照组及阴性对照组(P<0.05)。各组细胞HRAS 总蛋白表达水平无明显差异(P>0.05),FTase-siRNA-1组HRAS膜蛋白表达水平较空白对照组及阴性对照组明显下降(P<0.05)(图2)。
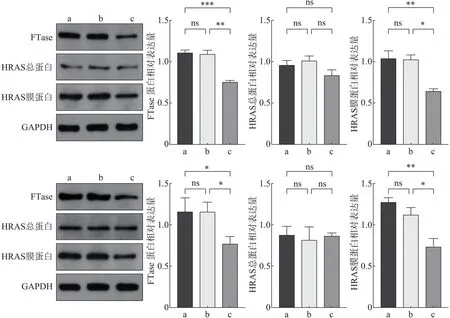
图2 转染后FTase、HRAS相关蛋白的表达Fig 2 Expression of FTase and HRAS protein in each group
2.3 各组细胞EMT和侵袭迁移相关蛋白的表达
Western blot 实验结果显示,FTase-siRNA-1 组较空白对照组及阴性对照组上皮性分子标志物Ecadherin 蛋白表达水平明显升高(P<0.05),间质性分子标志物Vimentin、MMP-9 蛋白表达水平明显下降(P<0.05)(图3)。
图3 转染后EMT和侵袭迁移相关蛋白的表达Fig 3 Expression of invasion and migration and EMT related proteins
2.4 RAS/PI3K/AKT/核因子-κB 信号通路的相关蛋白表达变化
Western blot 实验结果显示,FTase-siRNA-1 组AKT、p65蛋白表达水平较空白对照组、阴性对照组无明显变化(P>0.05)。但p-AKT、p-p65 蛋白表达水平明显下降(P<0.05)(图4)。
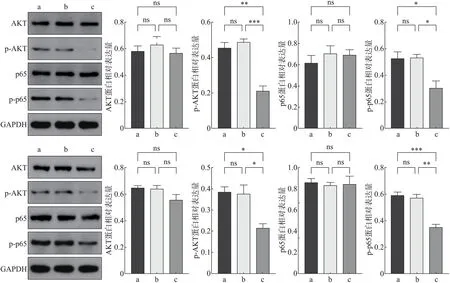
图4 转染后RAS/PI3K/AKT/核因子-κB信号通路的相关蛋白表达变化Fig 4 Expression of RAS/PI3K/AKT/nuclear factor-κB signaling pathway proteins
2.5 各组细胞的侵袭能力变化
Transwell 实验结果显示,与空白对照组以及阴性对照组相比,FTase-siRNA-1 组穿膜细胞数量显著减少,证明FTase-siRNA-1 组细胞侵袭能力降低(P<0.05)(图5)。
2.6 各组细胞的迁移能力变化
细胞划痕实验结果显示,24 h时FTase-siRNA-1组细胞划痕的愈合速度显著低于空白对照组及阴性对照组(P<0.05),证明其迁移能力明显降低(图6)。
3 讨论
SACC是一类发生于头颈部的高度恶性腺上皮来源肿瘤,其生长缓慢,发病较为隐匿,同时具有高血行转移率、嗜神经生长性及肺转移性的特点,导致术后复发率高,预后较差[13]。由于对其发病机制认识有限,目前常规的治疗手段仍为手术扩大切除联合术后放疗,而效果不佳[14]。因此,积极探讨影响SACC迁移侵袭的相关分子靶点及信号通路有望为其基因治疗提供新的思路。
RAS 家族基因是最常见的原癌基因之一,与人类恶性肿瘤的发生、发展密切相关,其点突变可降低p21 在内的GTP 酶活性,限制其表达产物RAS 蛋白与二磷酸鸟苷(guanosine diphosphate,GDP)的结合能力,造成调节失控,导致细胞增殖及恶变[15-16]。RAS的3种亚型HRAS、KRAS、NRAS的突变在各类癌症中显示出差异性,在唾液腺恶性肿瘤中,RAS 总突变率为26%,其中HRAS 占比高达15%[17]。HRAS 突变与SACC 较强的侵袭和转移能力密切相关[18],且参与其肺转移过程[19]。
目前,关于RAS 家族蛋白的研究已取得里程碑式进展,发现了RAS 蛋白c 端的翻译后修饰可将亲水蛋白靶向转移到细胞膜上,为相关酶的研究提供了理论基础[20-21],学者们[22]开始研究翻译后修饰酶抑制剂作为潜在的靶向治疗药物,用于治疗RAS驱动癌症的可能性。FTase作为修饰酶参与RAS 蛋白翻译后修饰的第一步即异戊二烯化,相当于信号传导的开关,是RAS 蛋白在细胞膜上精准定位进而发挥生物活性的必要条件[23-24]。FTase由α 与β 亚单位组成,其中α 亚单位与另一个参与异戊二烯化的修饰酶GGTase Ⅰ相同,而β 亚单位识别底物序列,决定了底物的特异性。在RAS 蛋白所有亚型的异戊二烯化修饰过程中,仅HRAS只能特异性的被FTase 修饰,因此抑制FTase 活性可使HRAS 蛋白的致癌能力大幅减弱。有临床研究提示,FTase 抑制剂类药物对乳腺癌、胃癌、肺癌和肝癌等多类恶性肿瘤都有较好的治疗效果,但FTase 对SACC 的影响及作用机制尚未有相关文献报道。本研究采用siRNA 转染人SACC 细胞SACC-LM 及SACC-83,抑制其FTase 表达,检测其对HRAS 的影响,结果显示HRAS mRNA 及总蛋白的表达水平无明显改变,HRAS膜蛋白的表达水平降低。由此推测在SACC 细胞中,FTase 可通过影响HRAS 的异戊二烯化修饰,干扰其与细胞膜的稳定结合,降低HRAS活性,而对HRAS本身表达并无明显影响。EMT 指上皮细胞失去细胞极性,获得部分间充质细胞的特征,表现为上皮标志物如E-cadherin 的丢失,间质性标志物如N-cad‐herin、Vimentin、MMP-9的增加,细胞的侵袭和迁移能力大大增强,目前EMT被认为是包括SACC在内的多种恶性肿瘤迁移侵袭的关键。MMP-9 又被称为明胶酶B,属MMP 家族,肿瘤发生发展过程中造成的缺氧缺血环境会使其表达水平上调,降解细胞外基质及基底膜上的胶原,造成肿瘤细胞向远处迁移,MMP-9 与SACC 的局部复发、远处转移有关,可作为评价患者预后的指标。本实验中,抑制FTase表达后,EMT相关的上皮性分子标志物E-cadherin 表达升高,间质性分子标志物Vi‐mentin 及MMP-9 表达降 低,Transwell 侵 袭实验 及划痕实验显示细胞迁移侵袭能力下降,推测沉默FTase 通过降低HRAS 蛋白活性影响了HRAS 蛋白对下游信号分子及通路的调控作用,抑制了SACC细胞的上皮间充质转化,从而影响了细胞的侵袭迁移能力。
PI3K是一种具有催化活性的细胞内信号蛋白,可调控下游AKT 磷酸化水平,二者构成PI3K/AKT信号通路。核因子-κB作为多种信号通路汇合的关键点,激活后可影响细胞的各类生物学行为,促进肿瘤的发生发展。核因子-κB 家族包括核因子-κB1(p50)、核因子-κB2(p52)、RelA(p65)、RelB 和c-Rel,通常所说的核因子-κB 蛋白是指p65/p50 亚单位形成的二聚体蛋白,其中p65 的磷酸化是核因子-κB 进行转录的必要条件。有研究显示,PI3K/AKT 通过靶向调控核因子-κB,在多种肿瘤细胞的侵袭迁移中起到重要作用。RAS 基因是PI3K-AKT 信号通路的上游调控基因,其中HRAS 相较于其他家族成员能够更加有效地激活PI3K 信号通路。为进一步探讨FTase对SACC 细胞侵袭转移影响的分子机制,本研究应用Western blot检测RAS/PI3K/AKT信号通路的关键分子AKT及其磷酸化水平,结果显示与两对照组相比,转染FTase siRNA 后,细胞AKT 蛋白表达无明显差异,AKT 蛋白的活性形式p-AKT 较对照组明显下降,p65 蛋白表达水平无明显差异,而p-p65 蛋白表达降低,表明抑制FTase 表达后,SACC 细胞内RAS/PI3K/AKT/核因子-κB 通路级联反应的作用明显减弱,使其侵袭迁移能力下降。
综上所述,本实验利用siRNA 技术抑制了人SACC 细胞SACC-LM 及SACC-83中FTase的表达,使细胞侵袭迁移能力显著下降,由此推测其作用可能是通过影响HRAS 蛋白的异戊二烯化修饰,干扰其靶向膜定位,使其无法有效激活下游RAS/PI3K/AKT/核因子-κB 信号通路,进而抑制细胞EMT进程而实现的,该研究为FTase作为SACC 基因治疗的有效靶点提供了一定依据,其具体机制仍待进一步研究。
利益冲突声明:作者声明本文无利益冲突。
