补阳还五汤对脊髓损伤大鼠磷脂酰肌醇3-激酶/蛋白激酶B/雷帕霉素靶蛋白通路及神经功能影响※
2022-08-08谭龙旺
李 江 潘 乐 雍 晨 刘 闯 谭龙旺
(陕西中医药大学附属医院脊柱病区,陕西 咸阳 712000)
应用中药治疗脊髓损伤(spinal cord injury,SCI)可以取得显著疗效,且不良反应少,越来越受到学者的关注,但其分子生物学机制尚未明确。目前大众最常研究的是SCI发生后某些信号转导通路被激活,使脊髓神经元具有一定有限的自我修复和再生功能,来促进神经功能的恢复。补阳还五汤作为益气活血通络名方,临床及文献报道治疗SCI有良好的疗效。本实验通过观察补阳还五汤对大鼠SCI后大鼠神经细胞巢蛋白(Nestin)及磷脂酰肌醇3-激酶/蛋白激酶B/雷帕霉素靶蛋白(PI3K/Akt/mTOR)信号通路活性的影响,以及在该信号通路被特异性阻断剂雷帕霉素抑制的情况下,补阳还五汤是否还可以发挥神经保护作用,以揭示补阳还五汤参与促进脊髓神经功能恢复的机制,为其应用于临床治疗提供实验依据。
1 材料与方法
1.1 实验动物 清洁级健康6个月龄雌性SD大鼠96只,体质量250~300 g,实验前大鼠适应性饲养7 d。实验动物生产许可证号:SCXK(陕)2018-0032,购自西安交通大学医学院实验动物中心。饲养湿度40%~70%,温度26 ℃,昼夜12 h间断照明。
1.2 实验药品及试剂 补阳还五汤浓缩液药物组成(由陕西中医药大学制剂室制备):黄芪120 g,当归6 g,川芎4.5 g,赤芍4.5 g,地龙3 g,红花3 g,桃仁3 g,加工成4 g/mL浓度药液,无菌封瓶,-20 ℃冰箱保存备用。雷帕霉素(美国Sigma公司)、注射用青霉素钠(成都倍特药业股份有限公司,国药准字H13021731)、10%水合氯醛(天津市大茂化学试剂厂)。
总RNA提取试剂盒、RNA RT-PCR试剂盒(一步法)(广州锐博生物技术有限公司);蛋白激酶B单克隆抗体(Akt)、抗mTOR小鼠单克隆抗体(美国Cell Signaling Technology 公司);兔抗-巢蛋白(Nestin)多克隆抗体(英国Abcam公司)、兔抗β-Actin多克隆抗体(北京中杉金桥生物技术公司);辣根过氧化物酶(HRP)标记亲和纯化山羊抗小鼠免疫球蛋白G(IgG)二抗;蛋白酶和磷酸酶抑制剂(北京诺为生物技术有限公司);聚偏二氟乙烯膜(PVDF)、RIPA裂解液(强)、BCA蛋白浓度测定试剂盒(增强型)(美国Millipore公司)等。
1.3 实验仪器 Centrifuge 5424R离心机(德国Eppendorf 公司);Mini-protean 3 cell电泳仪(美国BIO-RAD公司);Tanon-5200全自动化学发光图像分析系统(上海天能科技有限公司);Tanon-2500全自动数码凝胶成像分析系统(上海天能科技有限公司);BI-2000医学图像分析系统(成都泰盟软件有限公司)。
1.4 实验方法
1.4.1 分组及造模 96只大鼠采用随机数字表法分为正常组、模型组、补阳还五汤组、阻断组4组,每组24只。除正常组外,其余各组均采用改良Allen法建立SCI大鼠模型,用10%水合氯醛3 mL/kg腹腔注射麻醉,背部皮肤备皮,以胸椎(T)8~9棘突为中心,逐层切开,将T8~9部分棘突及椎板去除,显露硬膜,将10 g砝码从2.5 cm高处自由落下,击中硬膜和脊髓组织,造成局部SCI模型。建模成功标志为出现大鼠尾巴摆动痉挛、下肢麻痹。大鼠造模后分笼单笼饲养;术后保暖,人工按摩大鼠膀胱每日2次至能自主排尿;术后1周内前肢肌肉注射注射用青霉素钠8×104U,每日1次。
1.4.2 给药 补阳还五汤组于术后第2天用4 g/mL浓度的补阳还五汤浓缩液灌胃,每日2次,每次灌胃剂量按人60 kg体质量每日1剂换算,大鼠等效用药剂量约为0.217 g/kg(分2次灌胃),连续灌胃3周。阻断组在补阳还五汤给药基础上于术后第2天予雷帕霉素3 mg/kg,每日1次腹腔注射,连续3周。正常组、模型组术后予等容积0.9%氯化钠注射液灌胃,每日2次,连续灌胃3周。
1.5 观察指标 为排除实验结果的偶然性,增加实验结果的可靠程度,取材检测过程中每组随机抽取6只大鼠。术后3周各组分别随机选取6只大鼠,评定大鼠后肢运动功能后,处死大鼠,以损伤区为中心取2 cm脊髓组织,纵切等分后置于液氮中,用于检测各实验组大鼠神经细胞Nestin,以及通路中Akt、mTOR的蛋白和mRNA表达水平。
1.5.1 联合行为评分(CBS) 用于评定大鼠后肢运动功能的恢复情况,包括:开放空间运动、触地反应、脚趾伸展、回缩反应、斜板试验、端正体位和游泳等[1]。评分值:正常0分,全瘫100分。
1.5.2 蛋白免疫印迹法(Western blot)检测Nestin、Akt、mTOR蛋白表达 用RIPA裂解液,加入蛋白酶和磷酸酶抑制剂裂解脊髓组织。4 ℃ 12 000 r/min离心15 min,收集上清液并用BCA蛋白浓度测定试剂盒检测总蛋白浓度。每孔8 μg的总蛋白样品经浓度为5%~17% SDS-聚丙烯胺凝胶电泳后,转入PVDF膜(0.45 μmol/L),将膜用2%的封闭蛋白干粉室温封闭2 h后,分别加Nestin、p-Nestin、Akt、p-Akt、mTOR、p-mTOR(Ser2448)(1∶1000)、β-actin(1∶400)一抗4 ℃孵育过夜,经磷酸盐吐温缓冲液(PBST)洗3次后加HRP标记的二抗(1∶5000)37 ℃孵育2 h。经PBST充分漂洗后,目的蛋白信号由增强化学发光法检测并曝光于X线片上。采用Western blot半定量分析Nestin、p-Nestin、Akt、p-Akt、mTOR、p-mTOR(Ser2448),其中p-Akt、p-mTOR的相对光密度表达为各条带的累积光密度比相应的Akt、mTOR的累积光密度,其相对光密度表达为每条带的累积光密度比相应的β-actin。
1.5.3 逆转录聚合酶链式反应(RT-PCR)检测Nestin mRNA、Akt mRNA、mTOR mRNA表达 脊髓组织液氮中匀浆后,RNA 提取试剂盒提取总RNA,将提取的总RNA(8 μL)加入逆转录反应体系混合(共20 μL),合成cDNA。实验样品总RNA的提取及RT-PCR的操作步骤均按照试剂盒说明书进行。反应条件设定如下:①Nestin:40℃ 30 min、90℃ 5 min、5℃ 10 min,1个循环;95℃ 5 min;90 ℃变性30 s,50℃退火30 s,73℃延伸30 s,20个循环;70℃ 10 min。②Akt:40℃ 30 min、95℃ 5 min、5℃ 10 min,1个循环;96℃ 5 min;93℃变性35 s,55 ℃退火30 s,74℃延伸30 s,25个循环;75℃ 10 min。③mTOR:45℃ 30 min、95℃ 5 min、5℃ 10 min,1个循环;93 ℃ 5 min;94℃变性30 s、54℃退火30 s、72℃延伸 30 s,共25个循环;72℃ 10 min。反应完成后,采用Tanon-2500全自动数码凝胶图像分析系统将凝胶结果录入电脑,采用BI-2000医学图像分析系统分析实验结果,计算Nestin mRNA、Akt mRNA、mTOR mRNA与β-actin mRNA的比值,作为各目的基因的相对表达量。引物序列见表1。

表1 引物序列表

2 结果
2.1 各组大鼠CBS比较 补阳还五汤组CBS低于模型组、阻断组(P<0.05)。模型组、阻断组CBS组间比较差异无统计学意义(P>0.05)。见表2。

表2 各组大鼠CBS比较 分,
2.2 各组大鼠Nestin、Akt、mTOR蛋白相对表达量比较 Western blot检测结果显示,与正常组比较,模型组Akt、mTOR蛋白相对表达量均升高(P<0.05),Nestin表达增加但比较差异无统计学意义(P>0.05),补阳还五汤组、阻断组Nestin、Akt、mTOR蛋白相对表达量均升高(P<0.05);与模型组比较,补阳还五汤组Nestin、Akt、mTOR蛋白相对表达量均升高(P<0.05),阻断组Nestin、Akt、mTOR蛋白相对表达量无明显升高或降低(P>0.05);与补阳还五汤组比较,阻断组Nestin、Akt、mTOR蛋白相对表达量均降低(P<0.05)。见表3、图1。

表3 各组大鼠Nestin、Akt、mTOR蛋白相对表达量比较
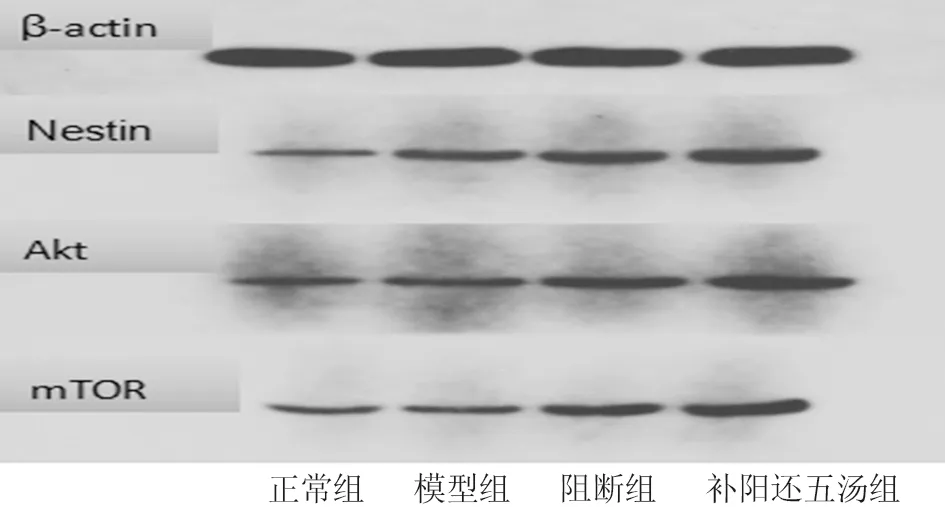
图1 各组大鼠Nestin、Akt、mTOR蛋白相对表达量比较
2.3 各组大鼠Nestin mRNA、Akt mRNA、mTOR mRNA相对含量比较 RT-PCR检测结果显示,与正常组比较,模型组Akt mRNA、mTOR mRNA相对含量均升高(P<0.05),Nestin mRNA相对含量增加,但比较差异无统计学意义(P>0.05),补阳还五汤组、阻断组Nestin mRNA、Akt mRNA、mTOR mRNA相对含量均升高(P<0.05);与模型组比较,补阳还五汤组Nestin mRNA、Akt mRNA、mTOR mRNA相对含量均升高(P<0.05),阻断组3种Nestin mRNA、Akt mRNA、mTOR mRNA相对含量无明显升高或降低(P>0.05);与补阳还五汤组比较,阻断组Nestin mRNA、Akt mRNA、mTOR mRNA相对含量均降低(P<0.05)。见表4。

表4 各组大鼠Nestin mRNA、Akt mRNA、mTOR mRNA相对含量比较
3 讨论
实验发现,SCI后,通过阻断或促进来干预神经再生的信号通路,可以抑制神经细胞凋亡、促进神经再生恢复[2]。在众多的信号通路中,最常见的调控通路是PI3K/Akt信号通路,通过适当调节上游相关因子(如生长因子、营养因子、压力刺激因子等)位点,将信号整合分析后,最终激活下游一系列效应因子的改变,从而调控神经元细胞分化、存活、凋亡[3]。
PI3K下游的直接靶点蛋白是Akt,Akt在调控各种不同细胞功能(包括代谢、生长、增殖、存活、转录以及蛋白质合成)方面发挥重要作用。PI3K被激活后,促使Akt从细胞质转移到细胞膜上进行磷酸化,使Akt完全被激活。Akt及胞外调节蛋白激酶(ERK)磷酸化水平的增加能够启动PI3K/Akt信号通路下游联合反应,进一步磷酸化下游的B淋巴细胞瘤-2基因相关启动子(Bad)、mTOR、半胱天冬酶3(caspase-3)等系列底物,从而发挥细胞调控作用,对抗神经元凋亡并促进神经元存活。因此,目前大部分通过Akt通路发挥促细胞存活、抗细胞凋亡的研究,主要是通过磷酸化Akt下游系列底物来实现的[4]。Akt下游明星分子mTOR则是调节生长与代谢的这样的一个枢纽分子,通过磷酸化下游mTOR可以起到调节自噬[5]、改善组织局部微环境的作用,同时,实验证实可以通过特异性阻断剂雷帕霉素来阻断该作用[6]。胡凌云等[7]也证实,通过ATP激活Akt/mTOR/p70S6K信号通路,SCI后Nestin及NeuN的阳性细胞表达明显增加,并且此通路可以被雷帕霉素阻断,从而降低阳性细胞的表达。
实验研究表明,PI3K/Akt/mTOR通路参与了SCI后神经修复的过程,如大鼠SCI早期神经功能的自我重建有关[8-9]。并且由此通路介导的某些miRNAs参与了SCI后的病理、生理过程,在SCI后可以出现异常的表达,可以通过调控miRNAs来促进脊髓功能恢复[10-13],使内源性神经干细胞重新获得向神经元细胞增殖和分化能力,从而促进神经功能恢复。沈黎明[14]研究证实,调控miR-181d-5p位点可以抑制PTEN基因的表达,激活PI3K/Akt通路,从而促进神经细胞轴突的伸长。此外,也有研究发现,体外细胞移植干预后也可以激活PI3K/Akt/mTOR通路,如肾下腹主动脉移植骨髓间充质干细胞(BMSCs)后,SCI病灶局部VEGF表达增加,进而介导其下游信号通路PI3K/Akt的激活,促进SCI大鼠神经功能恢复[15];移植神经调节蛋白1(NRG1)转染的雪旺细胞能够有效促进SCI大鼠神经功能的恢复,其机制可能也与激活mTOR信号通路有关[16]。
随着现代医学及分子生物学的发展,发现很多中药复方改善和保护神经的作用都是基于PI3K/Akt信号通路,因为其中药活性成分良好的安全性及耐药性,受到了越来越多的关注与研究。本研究所用补阳还五汤出自清·王清任《医林改错》,主治气虚血瘀证,具有补气、活血、通络的功效,本方既是益气活血法的代表方,又是治疗中风后遗症的常用方。现代临床常用于治疗脑血管意外后遗症及各种原因引起的偏瘫、截瘫、半身不遂、肢体痿软等属气虚血瘀者[17]。临床观察证实补阳还五汤对SCI的恢复具有促进作用[18]。
中医学认为,SCI所致的肢体萎软无力,甚至偏瘫、截瘫等证属督脉受损,瘀血阻络,伤后多久卧活动不便,久卧伤气,故气虚血瘀之证多见,患者常见苔白,脉缓,亦为气虚佐证,且亦属于“因虚致瘀”。脊髓解剖结构同古人所描述的督脉十分相似,现代中医认为SCI会导致督脉受损。SCI的病机属本虚标实, 本虚为肝肾、气血亏虚, 标实是指瘀血和痰浊阻滞经络。中医治疗SCI以补养气血、活血祛瘀、通督为原则,兼顾强筋骨、填精补髓。补阳还五汤方中生黄芪为君药,重用以大补脾胃之元气,使气旺血行,瘀去络通;臣以当归尾活血兼养血,有化瘀而不伤血之妙;佐以地龙通经活络,赤芍、川芎、桃仁、红花助当归活血祛瘀,具有活血通络、益气之功效。研究表明,补阳还五汤方中的生物碱、苷、多糖、苷元是其主要有效部位[19-20]。顾志荣等[21]对具有神经保护作用的中药进行总结分析,发现其主要分布在补益药的苷类及多糖类成分,清热药的生物碱类,还有部分活血药中。而补阳还五汤的配伍特点正是大量的补气药(黄芪)与适当的活血药(当归、赤芍、桃仁、红花)相配,使气旺血行,活血不伤正。这也从侧面印证了古代医家应用本方治疗神经损伤用药的合理性,与现代生物学的研究结果不谋而合。研究证实,补阳还五汤可以改善SCI大鼠的运动能力,其效果与糖皮质激素甲基强的松龙相当,可能与升高脊髓组织中再生基因蛋白2(Reg-2)和少突胶质细胞转录因子2(Olig-2)蛋白及抑制mTOR蛋白表达有关,促进神经胶质细胞分裂增殖活性,减轻炎性反应,进而发挥保护神经元的作用[22]。补阳还五汤还可以抑制过度的内质网应激反应,下调Caspase-3、Caspase-9及Caspase-12的表达[23],增加Ⅰ型胶原蛋白和Ⅳ型胶原蛋白表达,从而改善SCI后大鼠的肢体运动功能障碍[24]。
Nestin最早在胚胎大鼠的脊髓神经管神经前体细胞(NPCs)上发现表达,在胚胎期, Nestin表达强度随着神经细胞的不断成熟,逐渐减弱甚至消失, 当机体成年后,室管膜细胞即处于“静止”状态,当受到损伤后,又会应激而重新进入分化的活跃状态。Nestin阳性细胞为神经干细胞(NSCs)前体细胞,Nestin为NSCs的自我更新所需[25],实验中常用来表示神经细胞功能的改善指标。
本研究结果表明,补阳还五汤干预SCI大鼠后,PI3K/Akt/mTOR信号通路被激活,神经细胞Nestin表达及Akt、mTOR蛋白明显增多,CBS评分明显优于模型组(P<0.05);将PI3K/Akt/mTOR信号通路阻断后,功能改善情况不及未阻断的补阳还五汤组,且与模型组比较差异无统计学意义(P>0.05)。说明补阳还五汤是通过PI3K/Akt/mTOR信号通路来实现SCI神经功能的改善。补阳还五汤激活PI3K/Akt/mTOR信号通路的机制可能是促使发生PI3K磷酸化,进而促使Akt从细胞质转移到细胞膜上,在3-磷脂酰肌醇依赖性激酶1(PDK1)和PDK2的协同作用下促进Akt磷酸化,从而使Akt完全被激活[26]。
综上所述,补阳还五汤能够通过激活PI3K/Akt/mTOR通路,促进神经细胞Nestin表达,参与SCI神经功能的修复,并且可以被阻断剂阻断降低疗效,为以后临床中应用补阳还五汤治疗SCI提供了现代医学理论基础。
