1个脆性X综合征家系的FMR1基因CGG重复及甲基化状态分析*
2022-08-08钟青燕刘晓丽罗世强袁德健王敬仁王秋华b黄钧b严提珍柳州市妇幼保健院广西科技大学附属妇产医院儿童医院医学遗传科柳州市出生缺陷预防与控制重点实验室柳州市生殖与遗传研究所广西柳州545001
钟青燕,刘晓丽,罗世强,袁德健,王敬仁,王秋华b,黄钧b,严提珍(柳州市妇幼保健院 & 广西科技大学附属妇产医院、儿童医院 .医学遗传科,b.柳州市出生缺陷预防与控制重点实验室,c.柳州市生殖与遗传研究所,广西柳州 545001)
脆性 X 综合征(fragile X syndrome,FXS)作为最常见的X连锁的智力低下综合征,是发病率仅次于唐氏综合征的第二大智力低下疾病[1],同时也是孤独症谱系障碍常见的遗传因素。人群发病率男性约 1/4 000,女性约为 1/8 000[2-3]。约 99%的脆性X综合征患者发病的分子机制是由于FMR1 基因5′端非编码区的三核苷酸重复序列CGG过度扩增引起其上游约250 bp处CpG岛发生不同程度的异常甲基化,从而抑制FMR1 基因正常转录,造成FMR1不表达或低表达,进而引起一系列的临床症状。绝大部分男性全突变患者有典型脆性X 综合征的临床表现,也有30%~50%女性全突变携带者表现为轻重程度不等的智力低下,严重程度明显低于男性[4]。目前脆性X 综合征的相关研究更多的是关注患者的CGG 重复数或甲基化情况,对甲基化程度和表型关系研究的较少,本研究应用PCR微流控芯片毛细管电泳联合MS-MLPA技术对脆性X综合征家系进行CGG重复序列和甲基化状态分析,同时探讨甲基化程度和临床表型的关系。
1 对象与方法
1.1 研究对象 2017年8月于柳州市妇幼保健院医学遗传科遗传咨询的1 个脆性X 综合征家系,5代共22人(家系图谱见图1)。先证者(Ⅳ4)为男性,21岁,表现为特殊面容(长脸、大耳朵)、智力障碍、自闭症、社交障碍等临床表现,另外3 名男性患者(Ⅳ5、Ⅳ6 和Ⅳ9)和先证者有相似的临床症状,其余家系成员未发现有类似临床表现(表1)。本研究经柳州市妇幼保健院医学伦理审查委员会审批(批准文号:20160227042),所有研究对象或家属均知情同意。

图1 脆性X综合征家系图
1.2 样本采集与处理 采集先证者及家系成员外周血2~3 mL于EDTA-K2真空抗凝管中,颠倒混匀用于DNA提取及PCR扩增。
1.3 主要仪器及试剂 Chemagic360 全自动提取仪、LabChip FGX微流控毛细管电泳仪、FMR1 基因检测试剂盒(PCR 微流控芯片毛细管电泳法)、核酸提取试剂盒(苏州新波公司),3500Dx 遗传分析仪(美国ABI公司)。SALSA MLPA ME029 试剂盒(荷兰 MHC-Holland 公司),QIAampDSP 全血 DNA提取试剂盒(德国Qiagen公司)。
1.4 方法
1.4.1 DNA 样本准备 使用核酸提取试剂盒,在Chemagic360全自动提取仪上提取受试者外周血基因组DNA,提取的基因组DNA用于PCR反应。使用QIAampDSP 全血DNA 提取试剂盒提取基因组DNA用于Southern 印记杂交。所有实验步骤严格按照试剂盒说明书进行。
1.4.2 PCR 微流控芯片毛细管电泳技术 使用FMR1基因检测试剂盒(PCR微流控芯片毛细管电泳法)进行FMR1基因检测,对受试者基因组DNA进行 PCR 扩增,PCR 反应体系共 20 μL,包括 FX反应液 15 μL,FX 稀释液 3.8 μL,FX 聚合酶0.2 μL,DNA 模板 1 μL。反应条件:95 ℃ 预变性5 min,98 ℃变性 35 s,61 ℃ 退火 35 s,72 ℃ 延伸4 min,共 25 个循环,72 ℃终延伸 10 min。将 PCR产物进行核酸纯化,具体操作步骤参见试剂盒说明书。纯化后的PCR产物在LabChip FGX 微流控毛细管电泳仪上进行PCR产物片段大小分析。将所得的样本核酸片段大小等信息导入FMR1 基因检测报告软件,根据软件说明书对数据自动进行分析和拟合,计算出CGG 重复数。本研究同时采用已知重复数的参考样本(质控DNA,5 个不同CGG重复数的 DNA 片段,29/43/56/100/375 CGG 重复数)构建标准曲线,测定样本核酸片段大小通过标准曲线换算得到更高精度的CGG重复数。CGG重复数按照美国人类遗传学学会(American College of Medical Genetics,ACMG)指南[5]对基因型进行分型:正常型(CGG 重复次数<45);前突变型(CGG重复次数为55 ~200)以及全突变型(CGG 重复次数>200)。
1.4.3 MS-MLPA 检测 采用 SALSA MLPA ME029试剂盒检测样本FMR1 基因缺失和重复及FMR1基因上游CpG岛甲基化状态。具体步骤按照试剂盒说明书操作。参照文献[6],用3500Dx遗传分析仪进行产物分析,原始数据通过Coffalyzer.Net软件(荷兰MRC-Holland 公司)进行数据归一化分析。将FMR1基因7个甲基化特异性探针比值的平均值作为甲基化比值。男性甲基化比值为0,表明不存在甲基化,甲基化比值>0.64表明存在异常甲基化。
1.4.4 Southern 印记检测 所有全突变阳性样本均送到中南大学生命科学院遗传研究中心进行Southern 印记杂交验证[7]。
1.5 统计学分析 采用SPSS 24.0 统计学软件进行数据统计分析。组间比较采用t 检验,检验水准α =0.05,以 P<0.05 为差异有统计学意义。
2 结果
2.1 PCR微流控芯片毛细管电泳结果 22个家系成员中检出正常型9例(1男,8女),检出女性前突变携带者8例,其FMR1 基因CGG 重复数在100 ~128 之间,其中 1 例 (12.5%)卵巢早衰,5 例(62.5%)女性前突变携带者出现月经紊乱,明显高于正常型(25%);检出脆性X 综合征男性患者4例,全突变女性携带者1 例,均由前突变携带者母亲动态突变传递而来。22个家系成员的CGG重复数见表1、部分家系成员PCR微流控芯片毛细管电泳图谱见图2。

图2 PCR微流控芯片毛细管电泳检测FMR1基因电泳图
2.2 MS-MLPA检测结果 22例家系成员MS-MLPA分析,均未发现FMR1基因缺失和重复。男性正常型甲基化比值为0,女性正常型和前突变携带者甲基化比值范围分别为 0.25 ~0.48(中位数 0.33)和0.33~0.46(中位数 0.38),两组差异无统计学意义(t= 0.095,P>0.05);1 例女性全突变携带者(Ⅳ:16)甲基化比值为0.52,高于正常型和前突变携带者中位数(0.33,0.38);4 例男性全突变患者(Ⅳ:4、Ⅳ:5、Ⅳ:6、Ⅳ:9)CpG 岛为异常甲基化状态,甲基化比值均>0.64(表1)。部分图谱见图3。

图3 MS-MLPA检测FMR1基因缺失、重复和甲基化状态的图谱

表1 22个家系成员的CGG重复数,MS-MLPA结果及临床表现
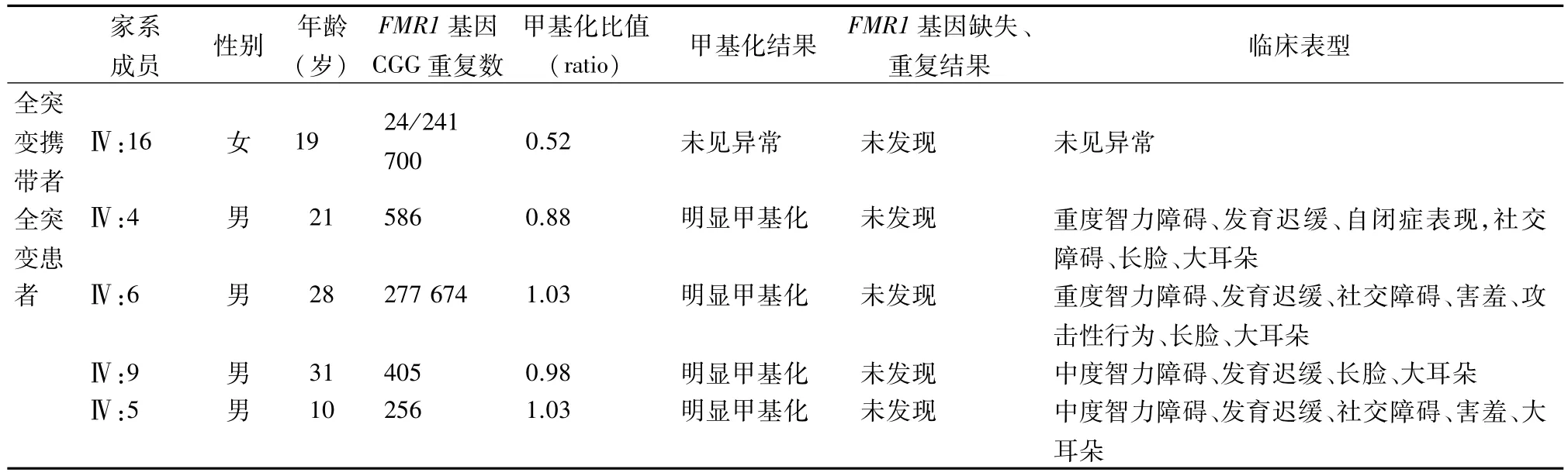
续表1
2.3 Southern印迹杂交结果 4例男性脆性X综合征患者均出现>5.8 Kb条带(男性全突变型),1例女性全突变携带者出现 2.8 Kb、5.2 Kb 和>5.8 Kb 条带(女性全突变型)。
3 讨论
FMR1基因CGG 重复数的动态突变递增仅遵循母源传递,父源传递时一般不发生大范围递增反而缩减,Mulley等[8]报道1例中度智力低下的脆性X综合征(FXS)男性患者生育的女儿表现为前突变型,Kambouris 等[9]发现 1 例前突变和全突变嵌合男性生育的女儿也表现为前突变型,其CGG 重复数跟父亲一样,Willems 等[10]发现 1 例表型正常的全突变甲基化嵌合男性其精子CGG重复数与女儿相同,段然慧等[11]通过对 2 例 FXS 男性胎儿(1例全突变、1 例全突变和前突变嵌合)睾丸组织进行CGG重复数及甲基化水平检测,进一步证实父源CGG重复数在子代传递呈现缩减渐进过程。本研究的家系中Ⅲ代的女性成员均为前突变携带者,CGG重复数在100~128 之间,其母亲(Ⅱ:2 和Ⅱ:4)为正常型,因父亲已故,根据咨询者反馈其父亲临床表现无特殊,推测前突变携带者的父亲可能表现为前突变,父亲CGG 重复传给其女儿时发生了较小的递增或保持一致。
前突变CpG岛一般不发生甲基化,FMR1 基因可以正常地转录,具有相对正常的蛋白质水平,不表现出脆性X综合征临床症状,但是可能会与老年性震颤、共济失调和卵巢早衰、卵巢功能不全等发生相关。脆性X相关震颤/共济失调综合征(fragile X-associated tremor/ataxia syndrome,FXTAS)可能是由于过多的RNA结合蛋白的毒性作用引起的一组以神经退行性病变为主的疾病[12-13]。约40%或以上前突变携带者在60岁之后罹患迟发型进行性神经系统疾病——FXTAS,此病好发于男性,年纪越大发病率越高[14]。本研究中的 1 例女性(Ⅱ:2,CGG重复数为29/38)在66 岁开始出现老年性震颤、共济失调,排除了脆性X综合征基因变异,其临床症状的出现可能是其他神经系统病变引发。前突变携带者中有20%罹患卵巢早衰的风险,卵巢早衰的发生可能是由于前突变mRNA 对卵巢组织的毒性积累导致卵泡闭锁或凋亡增加[15]。女性前突变携带者CGG 重复数在55 ~80 之间时,重复数越大,发生卵巢早衰的年龄越小,CGG 重复数大于80时发生卵巢早衰的风险明显增高;然而CGG 重复数大于或等于100 时几乎不再增加卵巢早衰的风险,反而还会下降[15]。本研究中8 例女性前突变携带者的CGG重复数均大于或等于100,只有1例(Ⅲ:9)出现卵巢早衰,在 40 岁绝经,发生率为12.5%,这可能与其CGG重复数不属于卵巢早衰的高发区间有关;另外有5例(62.5%)女性前突变携带者出现月经紊乱,高于正常型女性,可能跟前突变mRNA毒性作用有关系,其机制有待进一步研究。
本研究采用MS-MLPA 技术进行甲基化分析,女性正常型和前突变携带者甲基化比值范围为0.25~0.48 和 0.33 ~ 0.46,两组差异无统计学意义(t=0.095,P>0.05),1 例女性全突变携带者甲基化比值为 0.52,高于女性正常型和前突变型均值(0.33,0.38),其未出现脆性 X 综合征相关的临床症状。由于存在无活性、甲基化的X 染色体,在正常型和全突变型之间产生重叠的峰值比率,女性样本MS-MLPA分析时得不到可靠的结果,因此,女性阳性样本需采用Southern 印迹杂交法结合PCR 微流控芯片毛细管电泳进行综合分析。4 例男性全突变患者甲基化比值均>0.64,为高度异常甲基化状态,其中2例表现为中度智力障碍,2例为重度智力障碍,两组患者的甲基化比值差异无统计学意义(t=0.58,P>0.05),提示男性患者的临床表型和甲基化程度有关,但非正相关。Nobile 等[16]发现DNA甲基化不是调节FMR1表达的唯一因素,胞嘧啶甲基化、组蛋白修饰、染色质重组、RNA转录的作用也可影响FMR1基因转录调控。
通过CGG 重复数检测和甲基化分析,为脆性X综合征家系成员提供准确全面的分子诊断,男性患者临床表型和甲基化程度相关。前突变和全突变女性的FMR1基因CGG 重复数会发生动态突变递增传给子代,有生育脆性X 综合征患儿的风险。因此,在婚前、孕前进行遗传咨询和基因检测,若是女性携带者,可通过产前诊断或胚胎植入前遗传学检测技术避免患儿的出生。此外,女性携带者有卵巢早衰的风险,应提供风险评估,必要时提前完成生育计划。
