利用人多能干细胞来源的神经管模型探究丙戊酸钠的致畸机制*
2022-08-08张小佐霍海芹王艳冯浩洋林颖许争峰南京医科大学附属妇产医院南京市妇幼保健院产前诊断中心南京210001
张小佐,霍海芹,王艳,冯浩洋,林颖,许争峰(南京医科大学附属妇产医院&南京市妇幼保健院产前诊断中心,南京 210001)
神经管畸形,又称神经管缺陷(neural tube de-fects,NTDs),是最常见的先天性畸形之一,主要表现类型有脊柱裂和无脑畸形等[1]。研究表明,NTDs是环境因素和遗传因素交互作用所致,其中与NTDs发生相关的环境因素主要包括服药史、糖尿病、感染和放射线等[2]。丙戊酸钠(valproic acid,VPA)是一线抗癫痫药物,然而一项人群数据研究提示,孕期服用VPA可增加胎儿患NTDs的风险[3],这使得VPA 在妊娠期的使用陷入两难的境地[4]。目前关于NTDs 的研究主要以动物模型为主[5-6],且在上述动物研究中已证实VPA 具有神经致畸性[7],但该研究存在一定的局限性,因为模式动物与人类的大脑发育存在遗传学背景差异。
人多能干细胞(human pluripotent stem cells,hPSCs)是一类具有自我更新能力的多潜能细胞[8]。本研究通过悬浮培养hPSCs并提供3D培养环境以改善体外神经诱导的条件,分化获得具有单个lumen的玫瑰花环样组织,与体内神经管相似。在该模型的基础上,笔者在体外分化培养体系中加入VPA,通过比较VPA加药组与对照组之间的差异,以期进一步探讨VPA导致NTDs的可能发生机制。
1 材料与方法
1.1 细胞系、主要试剂与仪器 人多能干细胞系RC01001-B(安徽中盛溯源公司)。hPSCs 培养基(北京赛贝公司),Matrigel 基底膜基质(美国康宁公司),DMEM/F12 培养基、非必需氨基酸 NEAA、N2、B27、TrypLE、F-actin 染料、山羊抗小鼠 488 荧光二抗、山羊抗兔546 荧光二抗(美国 Thermo 公司),ROCK 抑制剂 Y-27632632(美国 Stem cell 公司),丙戊酸钠(美国 Sigma 公司),驴血清(美国Millipore 公司),兔抗人 OCT4 单克隆抗体(英国Abcam公司),小鼠抗人OCT4 单克隆抗体(美国Santa Cruz公司),兔抗人PAX6 多克隆抗体、小鼠抗人NCAD 单克隆抗体(美国Biolegend 公司),兔抗人ECAD单克隆抗体(美国Cell Signaling公司),小鼠抗人PKCλ单克隆抗体(美国BD公司),cDNA逆转录试剂盒、qPCR 试剂盒(南京诺唯赞公司)。荧光倒置显微镜(德国Leica公司),NanoDrop 紫外分光光度计(美国Thermo公司)。
1.2 hPSCs的培养与传代 取上述培养的hPSCs,待细胞融合度达90%时,使用1 mL TrypLE(1×)进行消化,终止消化后加入hPSCs 培养基,接种于Matrigel铺底的6 孔细胞培养板中,置于37 ℃、5%CO2、饱和湿度培养箱中常规培养,每日换液。传代至20代后用于神经诱导分化。
1.3 神经诱导分化 取上述经消化培养的hPSCs,加入 NIM 培养基[N2(1 ∶100 稀释)+NEAA(1 ∶100稀释)+DMEM/F12]重悬细胞,转移至培养瓶。每日换液,培养瓶倾斜静置,待细胞团沉降后,弃去上层培养基,加入 NIM 培养基重悬细胞团,置于37 ℃、5%CO2、饱和湿度培养箱中。通过免疫荧光染色试验检测hPSCs向神经方向分化的指标,包括多能性标志物 Oct-4,神经特性标志物 PAX6,ECAD,NCAD,F-actin和 PKCλ等的表达,以验证体外神经管模型。在此基础上,从分化第0 天起在培养体系中加入不同浓度 VPA:0(对照组)、0.1、1 和10 μmol/L进行后续试验,每组重复3次。
1.4 免疫荧光染色试验 取上述细胞,用PBS 洗涤1次,4%多聚甲醛固定4 h 后蔗糖脱水,包被后进行冰冻切片。PBS 洗涤3 次,10%驴血清+0.2%Triton室温封闭1 h。分别加入兔抗人OCT4 单克隆抗体,兔抗人PAX6 多克隆抗体,兔抗人ECAD单克隆抗体,小鼠抗人OCT4 单克隆抗体,小鼠抗人NCAD单克隆抗体,小鼠抗人PKCλ单克隆抗体(均为 1 ∶500 稀释)4 ℃ 过夜。PBS 洗涤 4 次,加入相应的山羊抗兔546荧光二抗,山羊抗小鼠488 荧光二抗和细胞骨架染料 F-actin(1 ∶1 000 稀释),室温避光静置1 h。PBS 洗涤4 次,抗荧光淬灭封片剂封片,于荧光显微镜下观察并拍照。
1.5 逆转录 PCR(RT-PCR) 用 Trizol 法提取分化第4天细胞(约1×106个)的RNA样本。采用Nano-Drop紫外分光光度计检测RNA 浓度,选择RNA 浓度大于 100 ng/μL,吸光度(A260nm/A280nm)值>2.0 的RNA样本,按照cDNA逆转录试剂盒说明书操作将1 μg RNA逆转录为cDNA,样本置于-80 ℃保存。
1.6 引物设计及实时荧光定量PCR(qRT-PCR)引物由南京诺唯赞生物科技公司设计并合成。GAPDH(GenBank 序列号:NM_001256799)上游引物序列:5′-GGAGCGAGATCCCTCCAAAAT-3′,下游引物序 列:5′-GGCTGTTGTCATACTTCTCATGG-3′,退火温度61 ℃,产物片段大小为197 bp。OCT4(GenBank 序列号:Z11898)上游引物序列:5′-CTGG GTTGATCCTCGGACCT-3′,下游引物序列:5′-CCAT CGGAGTTGCTCTCCA-3′,退火温度 61 ℃,产物片段大小为243 bp。PAX6(GenBank序列号NM_001604)上游引物序列:5′-TGGGCAGGTATTACGAGACTG-3′,下游引物序列:5′-ACTCCCGCTTATACTGGGCTA-3′,退火温度62 ℃,产物片段大小为111 bp。以GAPDH作为内参。荧光定量 PCR 反应体系为20 μL,包括:ChamQ SYBR qPCR Master Mixure 10 μL,10 μmol/L上、下游引物各 0.4 μL,RNase-free H2O 8.2 μL,cDNA 样本 1 μL。采用 Step one plus 实时荧光定量PCR仪检测,PCR循环参数:95 ℃预变性30 s;95 ℃ 10 s,60 ℃ 30 s,共 40 个循环。使用7500荧光定量PCR系统分析软件采集荧光信号并进行熔解曲线分析,各基因的相对表达水平以2-ΔΔCt法计算,公式:ΔΔCt=[(实验组Ct目的基因-实验组Ct内参基因)-(对照组Ct目的基因-对照组Ct内参基因)]。每组设2个复孔,实验重复3次。
1.7 统计学分析 采用GraphPad Prism7 软件进行绘图和统计分析。对数据进行正态性和方差齐性分析,符合正态分布的数据以表示,两组间比较采用独立样本t检验,多组间比较采用方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 体外神经管模型的验证
2.1.1 体外神经管模型的建立 镜下可见hPSCs呈贴壁生长,细胞克隆边界清晰;分化第0天hPSCs呈单细胞悬浮状态;分化第2天悬浮培养的hPSCs形成细胞聚集体(拟胚体);拟胚体在第4天发育为含有中央空腔的三维结构体,即玫瑰花环样组织(图1A)。
2.1.2 多能性向神经特性的细胞命运特化 免疫荧光染色结果显示,拟胚体中绝大部分细胞OCT4表达呈阳性;玫瑰花环样组织中OCT4+细胞明显减少;分化第6天几乎没有细胞表达OCT4(图1B)。qRT-PCR 结果显示,OCT4 在分化第 2、4、6 天的相对表达量分别为 0.89±0.07、0.75±0.08 和 0.38±0.13,且分化第2天与第6 天相对表达量的差异具有统计学意义(P<0.05),证实分化过程中 OCT4 表达逐渐减少(图1C)。拟胚体PAX6 表达呈阴性;玫瑰花环样组织中大部分细胞PAX6 表达呈阳性;分化第6 天PAX6 表达阳性的细胞增多(图1D)。qRT-PCR结果显示,分化过程中PAX6表达逐渐增加(图1E)。
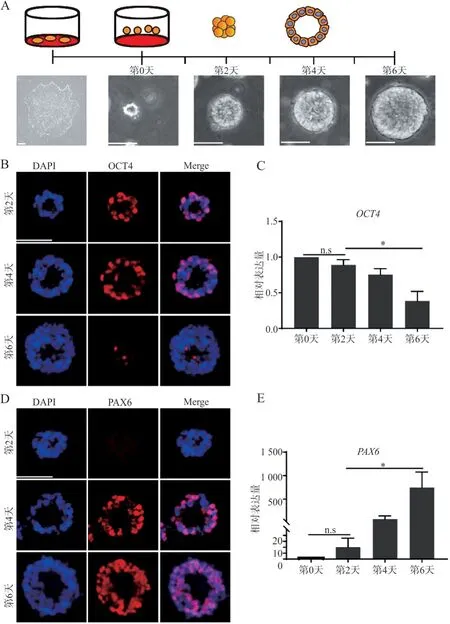
图1 多能性向神经特性的细胞命运特化
2.1.3 细胞命运特化中钙黏蛋白的转变 免疫荧光染色结果发现,拟胚体中ECAD主要表达于细胞表面;玫瑰花环样组织中ECAD表达阳性区域减少(图2A)。拟胚体中NCAD 表达呈阴性;玫瑰花环样组织中NCAD集中表达于细胞的顶部区域,在组织中央形成闭合的环状结构(图2B)。OCT4 与ECAD共同染色结果发现,拟胚体中 ECAD 与OCT4表达均呈阳性(图2C),玫瑰花环样组织中NCAD与PAX6均呈阳性表达(图2D)。
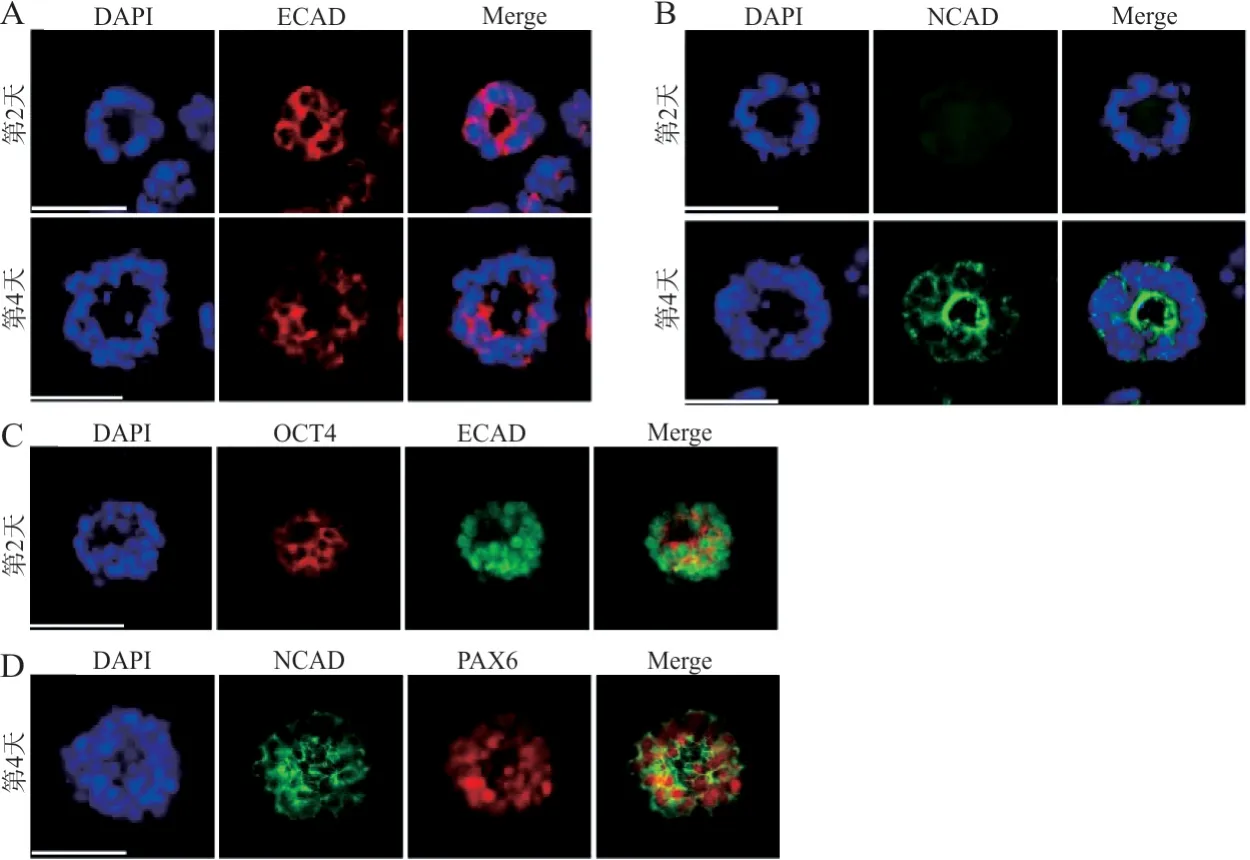
图2 分化过程中钙黏蛋白的转变
2.1.4 lumen 的形成结果 免疫荧光染色结果显示,玫瑰花环样组织中F-actin 主要表达于细胞的顶部区域,在组织中央形成神经管样的空腔结构(图3A)。F-actin荧光强度曲线图呈双峰状,双峰间的低信号区域即为lumen(图3B)。玫瑰花环样组织中PKCλ主要分布在组织的顶部,形成神经管样的极化环(图3C)。
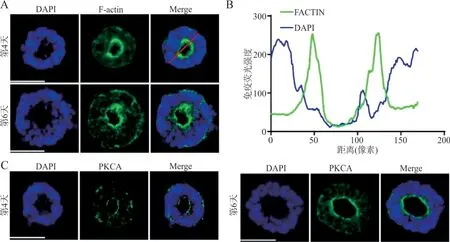
图3 lumen的形成示意图
2.2 VPA对体外神经管的致畸性
2.2.1 VPA的浓度筛选 体外神经管的直径统计结果显示,对照组、VPA 0.1 μmol/L、VPA 1 μmol/L和 VPA 10 μmol/L 组的 直 径 分 别 为 (90.81 ±0.88)μm、(87.14±1.35)μm、(77.19±1.34)μm 和(75.63±0.86)μm(图 4A)。VPA 10 μmol/L 组以及VPA 1 μmol/L组与对照组比较,差异均有统计学意义(P 均<0.05);而 VPA 0.1 μmol/L 组与对照组比较差异无统计学意义(P =0.050)。
2.2.2 VPA 对 lumen 形成的影响 VPA 浓度筛选结果显示,VPA 1 μmol/L为最低的致畸浓度,故而选择此浓度进行后续试验。免疫荧光染色结果显示,VPA 1 μmol/L 组中 F-actin 表达呈杂乱分布的状态,未能在神经管内的顶部区域聚集形成lumen(图 4B)。VPA 1 μmol/L 组中 F-actin 的荧光强度曲线与对照组的双峰形状不同(图4C),无明显低谷样的低信号区域(图4D)。对照组中PKCλ集中分布于神经管的中央部位形成极化环,与对照组相比,VPA 1 μmol/L 组中 PKCλ 呈现散乱分布的状态,其中央的空腔结构失去顶部极性(图4E)。

图4 VPA对体外神经管的影响
3 讨论
近年来,随着hPSCs被广泛应用于人类胚胎发育学的研究[9-10],有学者已成功诱导获得具有lumen的玫瑰花环样组织,也称类神经管结构[11],表现为多个玫瑰花环样组织的聚集状态。本研究通过改变体外神经诱导的条件,发现多能性标志物OCT4表达减少与神经特性标志物PAX6 表达增加,表明hPSCs在体外分化过程中逐渐丧失多能性,特化为具有神经特性的玫瑰花环样组织。ECAD与NCAD在分化不同阶段表达模式的改变说明细胞命运特化的过程中存在钙黏蛋白表达的时空转变。细胞骨架标志物F-actin 与极性标志物PKCλ 在组织顶部区域的聚集表达标志着重要结构lumen 的形成。因此,笔者利用hPSCs分化获得的具有单个lumen的体外神经管模型不仅在细胞命运和形态结构等方面可模拟体内的神经管发育过程,同时避免了传统类神经管结构中多个玫瑰花环样组织聚集状态带来的局限性,与人类中枢神经系统由体内单个神经管发育而来的过程更为相似。另外,改善后的体外神经诱导的方法与过程更为简易,是探索VPA导致NTDs的疾病发生机制的有效实验平台。
本研究证实,随着分化体系中VPA 浓度的增加,体外神经管的直径逐渐减小,表明VPA 对体外神经管具有生长抑制作用,且呈剂量依赖性。另外,VPA 1 μmol/L 组中 F-actin 以及 PKCλ 的表达均呈现杂乱分布,未聚集在细胞的顶部区域,导致无法形成具有顶部极性的lumen,这说明VPA通过影响分化过程中关键的细胞骨架功能和改变细胞的极化过程,诱发体外神经管分化失败。已有研究表明,神经管畸形的重要发生机制之一为平面细胞极性信号通路(planner cell polarity pathway,PCP),该信号通路可控制细胞的极性运动,并且与细胞骨架功能紧密相关[12-13]。因此,笔者推测 VPA 通过影响PCP 通路,改变细胞极性从而导致细胞骨架重组,这是VPA导致NTDs的潜在疾病发生机制。
综上所述,本研究利用hPSCs成功建立了体外神经管模型,该模型可在细胞命运和形态结构等方面模拟体内的神经管发育过程,但在完整重现神经管发育方面仍有许多局限性,本研究中的模型培养
周期较短,无法体现体内神经管继续发育的过程。笔者发现VPA通过影响分化过程中的细胞骨架功能与细胞极性破坏体外神经管中lumen 的形成,并推测PCP 信号通路可能是VPA增加神经管畸形发生风险的潜在致畸机制,为进一步探索VPA 导致NTDs的发生机制提供了思路,但其具体分子机制仍需进一步的深入研究。
