光动力抗菌高分子材料研究进展
2022-08-06孙玉洁高敏政朱艺文俞丙然徐福建
孙玉洁,高敏政,朱艺文,郑 良,俞丙然,徐福建
(北京化工大学材料科学与工程学院,北京 100029)
1 前 言
细菌感染是世界上威胁人类生命健康最为严重的问题之一,每年会导致数以百万计的感染患者出现[1]。1928年英国微生物学家革命性地发现了世界上的第一种抗生素——青霉素,开启了人类抗击细菌感染的新纪元[2],自此以后,抗生素的广泛使用和开发解救了无数感染性疾病患者。然而,一方面,耐药微生物越来越多地出现在临床感染中,被世界卫生组织(WHO)列为2019年全球十大健康威胁之一[3]。另一方面,相较于浮游状态存在的细菌,生物膜的形式为细菌提供了坚固的保护屏障[4, 5]。细菌可以定植在众多的组织或器官表面形成生物膜,造成眼部感染、牙周炎、尿路感染和呼吸道感染等疾病[6, 7],也可以附着在非生物材料表面,例如医用导管、人工器官、骨植入材料等[8, 9]。据统计,人类慢性微生物感染疾病的80%由生物膜造成,这导致了高的医疗保健成本以及高的发病率和死亡率[10, 11],也为临床使用的医疗器械消毒灭菌提出了更高的要求。生物膜的存在增加了临床治疗感染疾病的障碍,因为与浮游细胞相比,生物膜基质中的细菌细胞的抗生素耐药性高了1000倍[12]。生物膜和耐药菌问题成为了全球治疗细菌感染疾病中的两大难题。
光动力抗菌疗法(photodynamic antibacterial therapy, PDAT)是一种利用光敏剂(photosensitizers,PSs)在适当的激发光源照射下产生短寿命但高毒性的活性氧物质(reactive oxygen species, ROS),对周围的生物分子(如脂质、蛋白质和核酸等)造成氧化损伤,从而杀死病原微生物的方法。如图1所示[2],其作用主要由两种分子水平的机制介导:I型和II型。光激活后,光敏剂分子从基态跃迁到短暂的单激发态,然后通过系间窜越到达三重激发态。三重激发态的光敏剂分子通过电子转移直接与周围的底物反应产生自由基或自由基离子,如·OH和O2-(I型机制)。在PDAT中,I型反应主要发生在细菌细胞膜上,磷脂分子与氧反应形成脂质过氧化物,细菌结构完整性被破坏且细胞膜的离子渗透性增加。另一方面,三重激发的光敏剂分子还可以与氧传递能量以形成1O2。1O2作为最具威胁性的一类ROS,可直接对生物分子如不饱和脂质、DNA、酶等细胞成分造成氧化损伤,从而有效杀灭细菌(II型机制)[13, 14]。光动力治疗效果的影响因素主要包括以下几点:① 光敏剂的影响和选择:光敏剂是光动力治疗的核心物质,光敏剂能否选择性地在病变组织部位聚集、能否快速地从正常组织中清除、对正常组织有无毒副作用、单线态氧量子产率等等,将直接影响光动力治疗的实施和效果。② 激发光源的选择:在PDAT的研究和临床应用中,主要采用激光作为激发光源。实验表明,波长越长的激发光源对组织的穿透越深,越有利于光动力治疗。同时,激发光源的功率密度和能量密度既不能不足,又不得超过一定的范围,不足会影响治疗效果,过量会造成正常组织的损伤。③ 组织氧浓度的影响:氧是细胞赖以生存的物质之一,组织中的氧浓度直接影响到PDAT的效果,在I型反应中,光敏剂的三重态与底物发生电子转移作用产生的自由基可进一步与周围的氧反应生成氧化物;在II型反应中,激发态的光敏剂分子在与基态氧分子碰撞的过程中发生能量的转移,产生单线态氧,光敏剂本身回到基态。所以,ROS的产生除与光敏剂和激发光有关外,还与组织中氧的浓度有关[15]。
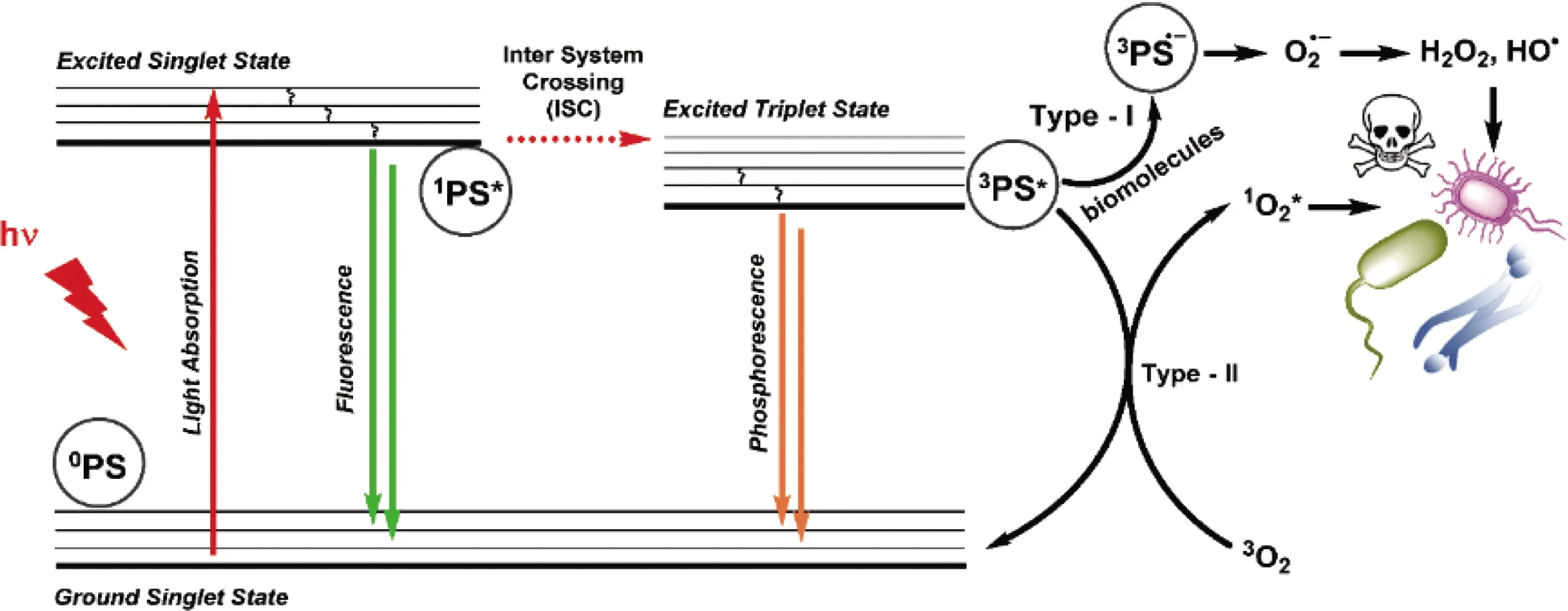
图1 光敏剂在光激发下产生活性氧物质示意图[2]
PDAT具有非侵入性、抗菌谱广、在不易引发耐药性的情况下可进行重复治疗、局部治疗以保护重要器官等众多优势[16]。在常规抗生素无法对抗耐药细菌和生物膜感染的情况下,研究人员将视线集中在了PDAT上,它在对抗细菌感染中有望成为抗生素疗法的替代方案[17, 18]。其中,光敏剂的开发是研究的重点。为实现高效的PDAT治疗效果,光敏剂应该满足以下几个要求:① 合成工艺简单,成本低;② 水溶性好;③ 优异的光稳定性;④ 照射下产生大量ROS;⑤ 生理条件稳定且对人体正常组织和器官无毒性[19]。除此以外,近年来,两个关于光敏剂设计的主要问题逐渐为研究人员所关注:① 细菌靶向性,为了实现低毒且高效的治疗效果,光敏剂被要求具有与细菌的强相互作用,而与细胞的亲和力忽略不计;② 革兰氏阴性细菌致密的外膜结构成为阻碍光敏剂渗透的屏障[2, 20],这使得PDAT对革兰氏阳性细菌表现出有效的杀菌作用,而对革兰氏阴性细菌的作用并不令人满意。为了解决上述问题,研究者们开发了众多细菌感染微环境响应性或细菌靶向性光敏剂。本文聚焦于聚合物基光敏剂的设计与构建,用于广谱性、细菌靶向性和微环境响应性PADT,实现对细菌感染类疾病的高效治疗。
2 广谱性光动力抗菌高分子材料
PDAT最突出的特点表现在其抗菌谱广,因为ROS不需要特定的细菌靶标便可发挥作用。然而,一方面,ROS的产量和作用距离有限,单一的光动力作用往往难以实现令人满意的抗菌作用;另一方面,传统光敏剂的疏水性通常会导致其在水性介质中发生聚集而荧光淬灭,进一步限制了ROS的产量,从而削弱其抗菌能力。为了解决这些问题,研究者们想到将传统的光敏剂进行化学改性以提高其水溶性,或将PDAT与其他方法结合,增强治疗效果。
作者课题组[21]设计了一种新型阳离子PDAT聚合物,用于PDAT与季铵盐(quaternary ammonium, QA)协同抗感染治疗。如图2a所示,利用开环反应,基于光敏剂酸性红87(EY)构建的多功能抗菌聚阳离子(EY-QEGED-R,R=—C6H13或—CH3)具有包括QA、光敏剂、伯胺和羟基物质在内的多个功能成分。EY-QEGED-R在受贻贝启发的聚多巴胺(polydopamine,PDA)粘合剂层的帮助下,可以被轻松地涂覆在不同的基材上。在体外生物学实验中(图2b和2c),加光条件下,EY-QEGED-R对金黄色葡萄球菌(革兰氏阳性细菌)和大肠杆菌(革兰氏阴性细菌)都表现出浓度依赖的抗菌活性,而在生物安全性的测试中,即使是在光照条件下,该阳离子聚合物的溶血性和细胞毒性都可忽略不计。体内实验中,对于大鼠表皮感染的治疗效果也证明了EY-QEGED-R具有良好的抗感染能力(图2d)。受到近些年新兴的抗微生物水凝胶的启发,Yuan等[22]构建了一种基于水溶性聚噻吩(PMNT)和螺旋的仿生纤维聚异氰化物(PIC)的混合水凝胶,得到了增强的光动力抗菌治疗效果。如图3a所示,PIC与PMNT之间的相互作用和PIC的半柔性性质使得PMNT的构象发生变化,最大吸收峰从410红移至600 nm。在红光照射下,此水凝胶产生大量ROS,对大肠杆菌、枯草芽孢杆菌(革兰氏阳性细菌)和白色念珠菌(真菌)都表现出优异的抗菌效果。另外,此水凝胶还表现出热可逆性和生物相容性,为体内应用提供保障。类似地,Wang等[23]制备了酸性红94/聚吡咯杂化聚乙烯醇水凝胶(RB/PPy PVA HD),并在550 nm可见光和808 nm近红外光的共同照射下,实现了光热和PDAT的协同作用,可用作治疗细菌感染的伤口敷料。除此之外,光动力抗菌高分子在医疗器械的表面修饰方面也得到了广泛研究,如金属-有机骨架(MOF)-聚合物混合基质膜[24]、光敏剂与聚偏氟乙烯(PVDF)纳米级纤维及微米级聚四氟乙烯(PTFE)颗粒组成的复合膜[25]、由柠檬酸-羟丙基-βCD聚合物(PP-CD)包裹卟啉类光敏剂TPPS修饰的聚丙烯(PP)织物形成的具有光动力抗菌作用的洗脱支架[26]等。Tong等[27]通过开环反应连接了锌(II)单氨基酞菁(ZnMAPc)与聚甲基丙烯酸缩水甘油酯(PGMA),利用乙二胺(ED)清除多余的环氧基团,并将此聚合物通过席夫碱键修饰到载玻片上。这一方法可以灭活革兰氏阴性细菌和革兰氏阳性细菌,这主要归因于光照条件下大量产生的ROS,例如·O2-和H2O2,从而引起的细菌膜的破坏、酶的失活和DNA的降解。上述几篇报道都将光动力作用与生物材料表面相结合,为生物医用材料提供抗菌性能,提高其使用安全性,降低二次感染的风险,使之具有用作抗感染伤口敷料或自消毒医疗器械的潜力。
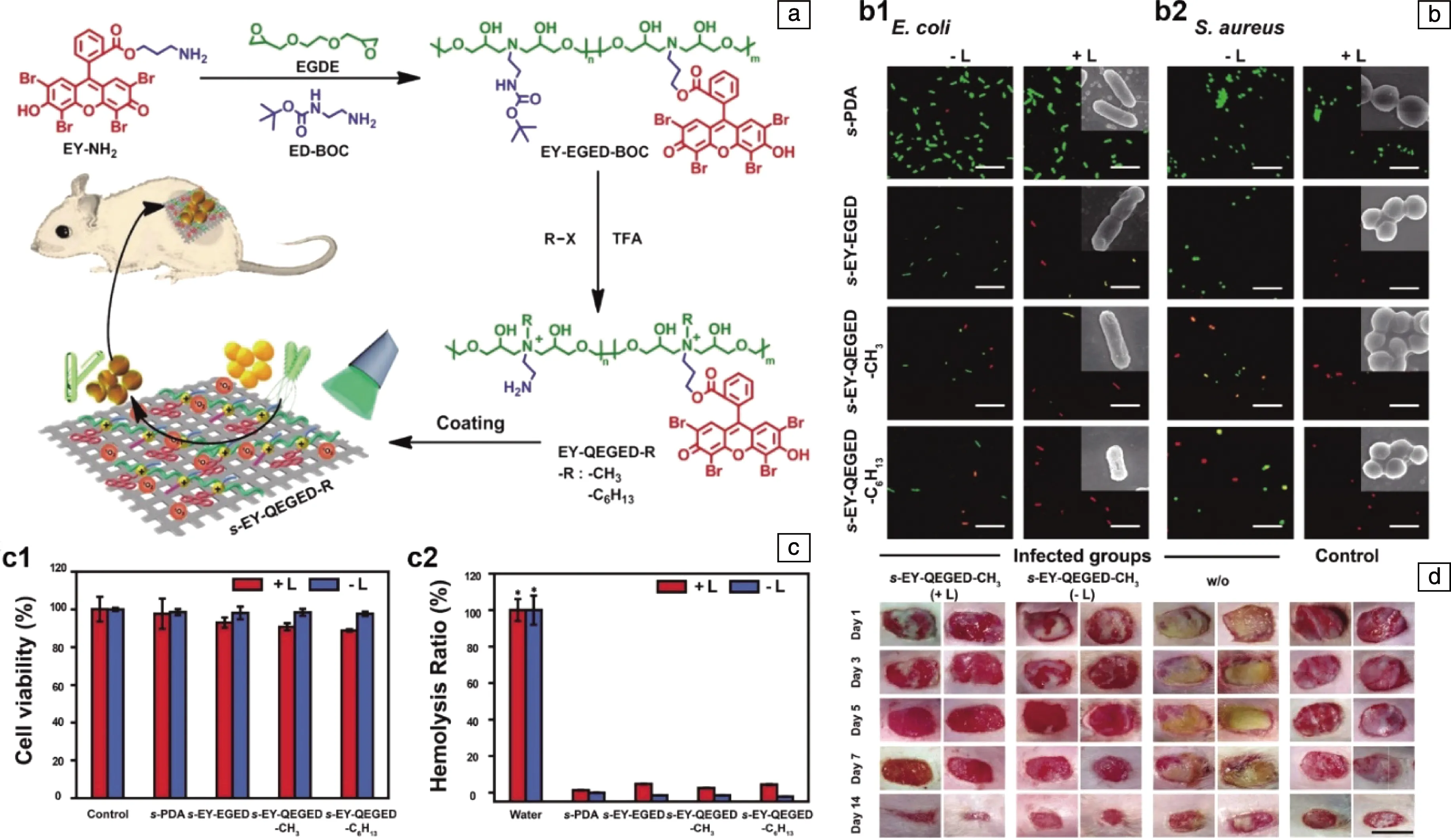
图2 PDAT与季铵盐的协同抗菌作用[21]:(a)多功能阳离子聚合物的合成路线示意图,(b)EY-QEGED-R对大肠杆菌(b1)和金黄色葡萄球菌(b2)的杀菌性能(比例尺:5 μm),(c)EY-QEGED-R处理后的小鼠成纤细胞(L929)的细胞存活率(c1)和溶血率(c2),(d)对大鼠表皮感染模型的治疗效果(比例尺:1 cm)
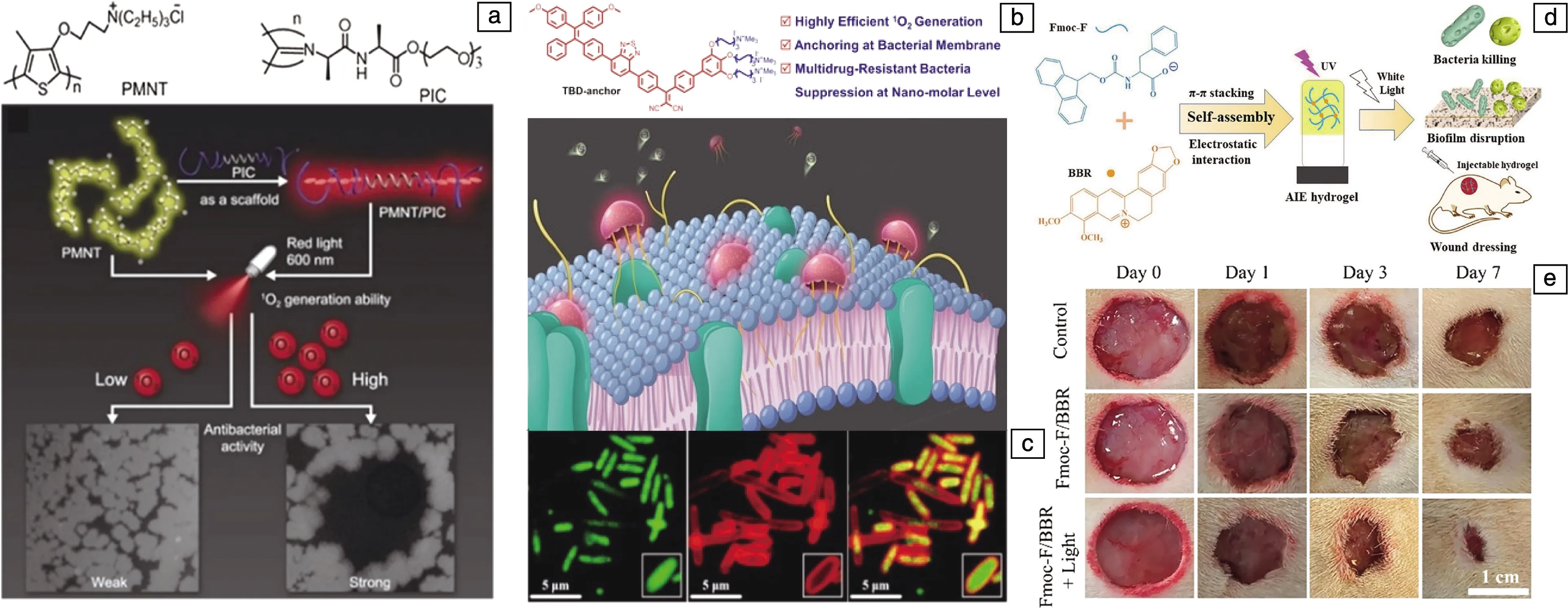
图3 PMNT与PIC构建的混合水凝胶示意图(a)[22];具有聚集诱导发光性质的TBD-anchor的结构式和作用示意图(b),TBD-anchor与大肠杆菌的作用(c)[29];具有聚集诱导发光性质的光动力抗菌水凝胶的构建及应用示意图(d),Fmoc-F/BBR水凝胶对全层皮肤感染模型的治疗(e)[30]
与传统的光敏剂在聚集态时发生荧光淬灭和ROS产量下降相反,具有聚集诱导发光(aggregation induced emission,AIE)性质的光敏剂表现出增强的荧光和持续产生ROS的能力[28],逐渐吸引了研究者们的注意。例如,如图3b所示,Chen等[29]设计的具有AIE性质的膜锚定光敏剂(TBD-anchor)是一种具有多条季铵盐链的共轭结构物质。图3c表明,TBD-anchor通过静电和疏水相互作用与细菌膜发生结合而不进入细菌内部。在白光照射下,随着TBD-anchor浓度的增加,细菌的存活率显著降低,5 μmol/L的TBD-anchor可杀死大约96%的大肠杆菌,2 μmol/L的TBD-anchor可杀死99.5%的金黄色葡萄球菌。相反,在黑暗环境中,高达40 μmol/L的TBD-anchor对大肠杆菌和金黄色葡萄球菌的毒性作用可忽略不计。对于耐甲氧西林的金黄色葡萄球菌(MRSA),TBD-anchor的光动力抗菌作用也超过了商业PS甲苯胺蓝O。类似地,如图3d所示,Xie等[30]将具有AIE性质的光敏剂小檗碱氯化物(BBR)与一种商业氨基酸(Fmoc-F)结合,构建光动力抗菌水凝胶。两种物质通过分子间静电相互作用和π-π堆积进行组装,在白光照射下显示出广谱抗菌作用和抗生物膜活性。在小鼠背部的全层皮肤感染模型中,尽管Fmoc-F/BBR水凝胶能够在黑暗条件下消除细菌感染,但其效率远低于光照治疗组(图3e)。Hao等[31]设计了麦芽七糖修饰的BODIPY(BODIPY-Mal-I)以提高光敏剂的水溶性,BODIPY核心的2,6位被碘取代后,单线态氧产生效率明显提高。光照条件下,BODIPY-Mal-I可以有效杀死浮游形式和生物膜形成的革兰氏阳性细菌,而在黑暗条件下,其对斑马鱼胚胎表现出低细胞毒性。类似地,Hao等[32]替换光敏剂BODIPY为具有AIE性质的四苯基乙烯,再与亲水的麦芽七糖结合,可以得到具有热响应特性的两亲性分子。其在水性介质中发生聚集,产生强烈的蓝色荧光,该研究为构建基于两亲性AIEgens的荧光温度计提供了新的视角。
针对耐药菌带来的日益严重的公共卫生问题,Jiang等[33]的研究展示了一些可以充当光敏剂的现有的抗生素,其在光照射下直接产生ROS以实现抗菌作用。他们找到了4种在光照条件下可以产生ROS的抗生素,并且利用耐卡那霉素的大肠杆菌和金黄色葡萄球菌,验证了它们的抗菌活性可以通过光激活得到明显增强。虽然细菌对非致死剂量的抗生素会通过产生耐药性进行抵抗,但这种基于抗生素的PDAT可以扩大现有抗生素的应用范围,降低其治疗剂量,从而减缓耐药性的出现。
综上,临床的细菌感染通常是由多种革兰氏阴性和革兰氏阳性病原菌,甚至是耐药性细菌引起[34],PDAT的广谱性可以满足这一需求,同时避免引起新的耐药性[35]。将PDAT与QA、水凝胶等结合,可以有效改善光敏剂的水溶性,提高利用效率;具有AIE性质的光敏剂也巧妙地克服了传统光敏剂聚集诱导淬灭的问题。这些研究为高分子材料用于光动力抗菌治疗提出了新思路。
3 细菌靶向性光动力抗菌高分子材料
一些新型细菌靶向性光动力抗菌材料是通过增强材料对细菌的特异性识别作用进而提高药物的靶组织浓度,增强其在病灶部位的渗透率,从而提升药物的生物利用度[36],在实现高效抗菌的同时也减轻对正常组织的毒副作用,这些材料的设计为未来光动力抗菌材料的发展提供了新的思路。
在众多的靶向分子中,天然糖类分子由于其良好的生物相容性和水溶性而常被用作构建新型的靶向光动力抗菌材料。作者课题组[37]利用可逆加成-断裂链转移(RAFT)聚合制备了一系列具有可控结构和理想分子量的二嵌段共聚物PαGal50-b-PGRBn。如图4a所示,其中的光敏剂酸性红94(RB)链段在光照下可以产生ROS,进而启动抗菌活性,同时,α-D-半乳糖链段部分可以特异性结合铜绿假单胞菌(P.aeruginosa)分泌的凝集素A(Lec A),进而达到靶向杀伤的作用。由于在P.aeruginosa的感染过程中,生物膜的形成部分由Lec A介导,因此在体外生物学实验中,PαGal50-b-PGRBn不仅体现了良好的抗菌性能,还能够有效分散生物膜(图4b~4d)。在评估PαGal50-b-PGRBn对正常小鼠成纤细胞(L929)的细胞毒性后发现,虽然在施加光照后细胞活力随着PαGal50-b-PGRBn浓度的增加而降低,但仍显示出相对良好的细胞活力。同时,在建立的多药耐药性P.aeruginosa生物膜感染性角膜炎模型中,PαGal50-b-PGRBn也表现出了良好的治疗效果。
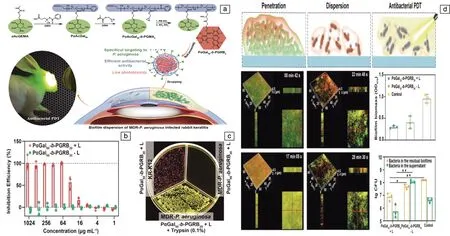
图4 耐多药细菌靶向纳米系统及其在耐多药铜绿假单胞菌生物膜感染兔角膜炎模型中的应用[37]:(a)纳米系统的构建及其抗菌抗生物膜作用示意图,(b)不同条件下纳米系统对耐多药铜绿假单胞菌的抗菌性能,(c)不同条件下纳米系统的选择性杀伤实验,(d)不同条件下纳米系统对铜绿假单胞菌生物膜作用
Zhao等[38]构建了一种基于硼二吡咯烯(BODIPY)的糖基化光敏剂。他们首先构建了BODIPY基的RAFT试剂,然后通过RAFT聚合引入半乳糖链段,以此来构建具有良好水溶性的糖基化光敏剂材料pGEMA-I。同样利用其中半乳糖链段与P.aeruginosa分泌的Lec A特异性结合作用,该糖基化光敏剂材料能够选择性地附着在P.aeruginosa感染部位,在有效进行光动力杀菌的同时减少了对正常组织的毒副作用。Im等[39]利用3′-唾液酸乳糖(3SL)对幽门螺杆菌的靶向作用,同时选用了脱镁叶绿酸A(PPa)作为光敏剂,制备了3SL-聚赖氨酸基光动力抗菌材料(p3SLP),该材料中的3SL结构可以选择性识别幽门螺杆菌膜中的唾液酸结合黏附素(SabA)成分并与其特异性结合,在激光照射下,光敏剂PPa释放出ROS,从而达到了靶向光动力杀伤的效果。同时,在幽门螺杆菌感染的小鼠模型中,所构建的p3SLP显示出显著的抗菌光动力效果,对正常组织和肠道菌群没有不良副作用,为临床中基于内窥镜的PDAT治疗提供了一个可行的策略(图5a和5b)。
细菌靶向肽是一种分布于动物和植物中的多肽类物质,也是一种可变长度和氨基酸序列的短阳离子两亲性肽(一般含有10~50种氨基酸)。它通过静电相互作用靶向并分解细菌细胞膜,诱导孔隙形成,从而导致细菌死亡。而因其能够特异性结合保持高电位梯度以及缺乏胆固醇的细菌膜而几乎不影响正常细胞,近些年来也常被用于构建靶向光动力抗菌材料[40-43]。例如,如图5c所示,Gao等[44]构建了亲水聚乙二醇(PEG)和多肽Magainin-I的共价结合物,将其与光敏剂二氢卟吩e6(Ce6)和α-环糊精共聚物(α-CD-Ce6)进行自组装,进而构建了细菌膜靶向的超分子光敏剂载体。与不加多肽Magainin-I的α-CD-Ce6相比,通过激光共聚焦观察到添加细菌靶向肽的组别对P.aeruginosa和MRSA都具有更好的生物膜消散能力(图5d),细胞毒性测试也进一步证实了添加细菌靶向肽的组别具有更低的细胞毒性。蛋白质是由多肽与其他物质结合而成的一种大分子物质,一些蛋白质可以与细菌上特定的分子结合。革兰氏阴性细菌的细胞外膜上含有丰富的脂多糖(LPS),LPS的表面多糖碳水化合物约占细菌表面积的75%,可被凝集素识别。刀豆蛋白A(ConA)是从菜豆中提取的一种应用最为广泛的凝集素,它可以与多糖的甘露糖基和葡糖基残基特异结合,从而与细菌表面的LPS结合,目前已经被用于对大肠杆菌的特异性识别当中[45-47]。Cantelli等[48]利用ConA的这一特性,将其与光敏剂RB结合,制备了ConA-RB共聚物。由于RB对革兰氏阳性细菌具有高活性,而对革兰氏阴性细菌的活性较低,因此,该共聚物增加了RB在革兰氏阴性细菌表面的局部浓度,显著提高了它对革兰氏阴性细菌的杀灭效率,体外抗菌实验也进一步验证了该共聚物对于大肠杆菌具有良好的抗菌效果(图6a和6b)。

图5 3′-唾液酸乳糖共轭聚赖氨酸基光敏剂(p3SLP)抗幽门螺杆菌靶向光动力治疗作用示意图(a),使用激光共聚焦观察p3SLP的抗幽门螺杆菌靶向光动力治疗性能(b)[39];α-CD-Ce6/PEG-AMP超分子胶束示意图示意图(c),α-CD-Ce6/PEG-AMP超分子胶束对P.aeruginosa、MRSA两种细菌生物膜的消除作用(d)[44]
除了利用天然糖类分子以及多肽物质与细菌的特异性结合作用来构建靶向光动力抗菌材料外,近些年来,利用革兰氏阴性细菌和革兰氏阳性细菌自身结构的不同,也有新型的靶向光动力材料被构建出来[49]。例如Lee等[35]利用革兰氏阴性细菌和革兰氏阳性细菌细菌膜结构上的不同,构建了具有AIE特性的近红外光敏剂(TTVP)。如图6c和6d,革兰氏阴性细菌的外层由外膜、交联肽聚糖网络和细胞质膜组成,比只有肽聚糖网络和细胞质膜的革兰氏阳性细菌的外层要复杂得多,因此革兰氏阳性细菌缺乏有效的屏障来阻止TTVP分子的插入,从而使得TTVP分子只能够与革兰氏阳性细菌的细菌膜特异性结合,从而实现了对阳性菌的靶向识别。TTVP分子在培养基中具有良好的单分散性、与革兰氏阳性细菌的强静电相互作用以及优异的AIE特性,也具有较高的ROS产率,在体内和体外抗菌实验中都取得了良好的抗菌效果,为临床应用中设计细菌鉴别剂提供了有效的策略。
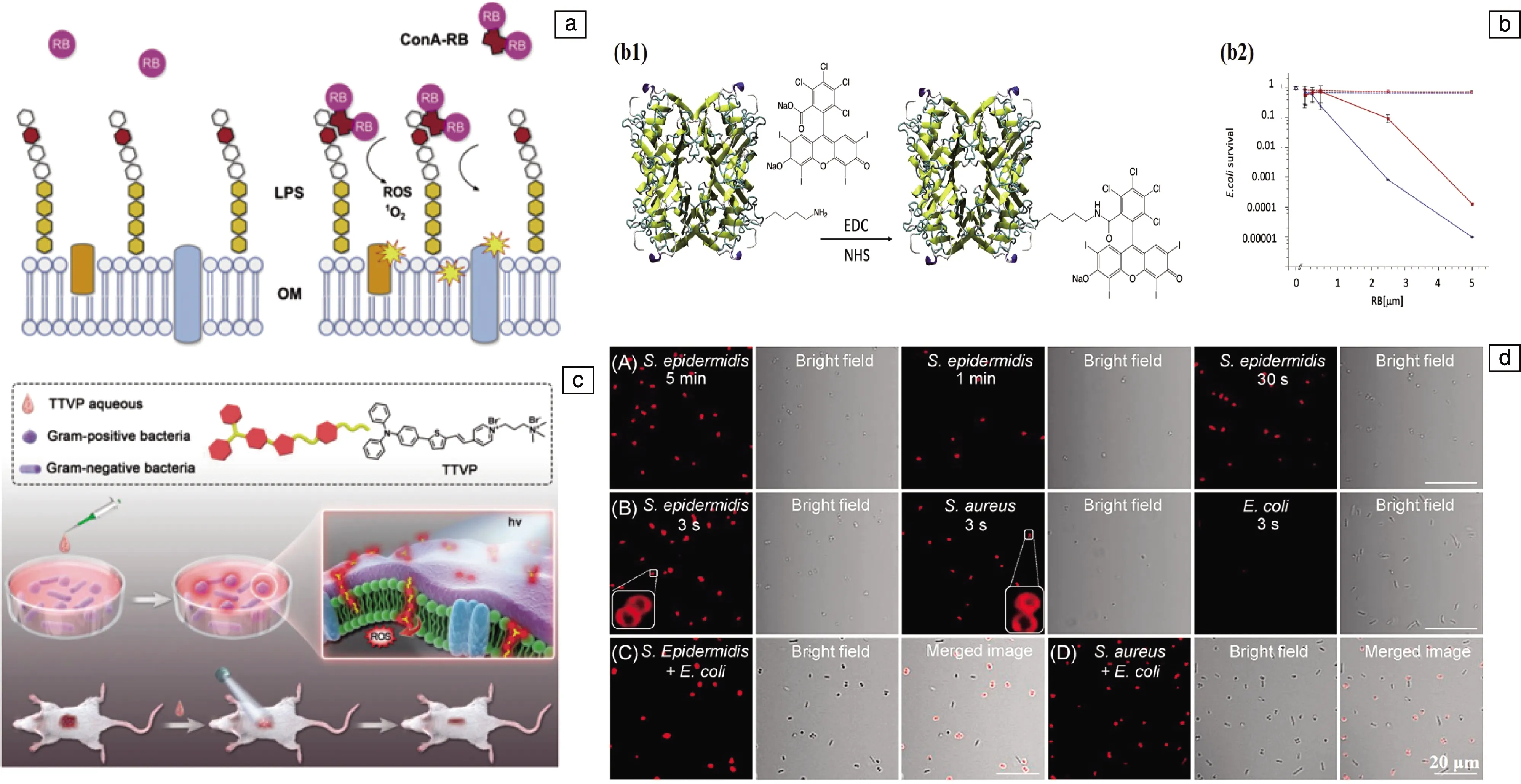
图6 抗革兰氏阴性细菌的ConA-RB光动力抗菌原理示意图(a),ConA-RB分子的合成示意图(b1)和对E.coli的光动力抗菌效果(b2)(b)[48];使用AIE分子TTVP进行革兰氏阳性细菌超快鉴别和高效光动力抗菌治疗的示意图(c),激光共聚焦观察TTVP分子与阳性菌的特异性结合(d)[35]
综上所述,新型靶向光动力材料在实现了细菌靶向性的同时增加了材料在细菌感染部位的富集,与传统光动力抗菌材料相比,靶向光动力抗菌材料提升了材料的利用率和光动力抗菌治疗的效果,同时也减少了对正常组织细胞的毒副作用,是未来新型光动力抗菌材料一个可行的发展方向。
4 微环境响应性光动力抗菌高分子材料
细菌或生物膜感染独特的微环境(如pH、毒素、酶等)启发了科研人员对响应性抗菌材料的设计。为了使抗菌剂具有更强的靶向细菌或渗透生物膜的能力,大量感染微环境响应的清除细菌或生物膜的系统已经被开发[50-52]。其中,细菌感染部位的pH值降低主要是由细菌的代谢产物造成的,其产物是包括乳酸和乙酸在内的有机酸[53-55],该现象已被广泛用作细菌感染的标志。已经有众多针对细菌微酸性环境设计聚合物基抗菌材料的报道,例如,Hu等[56]设计了一种席夫碱键连接的聚酰胺-胺型树枝状高分子(PAMAM)水凝胶,在酸性环境下,奥硝唑和妥布霉素实现了有效释放;Yan等[57]构建了一个pH响应性分层聚合物刷,在正常生理条件下,聚甲基丙烯酸(PMAA)外层的存在显著抑制了细菌的黏附,当局部环境变为酸性时,PMAA链断裂,暴露出内部的阳离子抗菌肽,激活杀菌功能;Qian等[58]开发的乙二醇-壳聚糖共轭羧基石墨烯(GCS-CG)对脓肿的酸性微环境表现出独特的自适应性,表面电荷由负转变为正,对细菌产生强的黏附性,再由近红外光(NIR)辐射下产生的升温作用消灭细菌。而在聚合物基PDAT领域,研究人员也充分利用细菌感染微环境的特征,构建了响应性的光敏剂,其在正常生理环境下几乎不产生毒性作用,而在细菌感染部位,受到光的激发后,会产生杀伤性的ROS,发挥预期的光动力抗菌作用。
Liu等[59]通过RAFT聚合和后修饰合成了可自组装成核壳结构的聚(聚乙二醇甲醚甲基丙烯酸酯)-b-聚(2-(二异丙基氨基)乙基甲基丙烯酸酯-2-羟乙基甲基丙烯酸酯)-二氢卟酚(PPEGMA-b-P(DPA-co-HEMA)-Ce6),当其被静脉注射到血液中时,在循环过程中对正常组织表现出的相互作用和毒性可忽略不计。而在酸性条件下,由于DPA的质子化,P(DPA-co-HEMA)-Ce6链段有效促进了细菌的靶向作用和阳离子治疗,光敏剂Ce6在光照作用下也可以用于成像,并产生具有抗菌作用的ROS。革兰氏阴性细菌的致密外膜阻碍了其与光敏剂的有效结合,使得PDAT的杀菌效率有限。如图7a所示,作者课题组[60]的研究中,光敏剂RB与PDA共价结合形成纳米颗粒核心,随后,外层修饰多粘菌素B(PMB)提高了纳米颗粒对革兰氏阴性细菌的杀菌作用,最后,通过静电作用在纳米颗粒最外层修饰负电性的葡萄糖酸(GA)得到纳米复合物RB@PMB@GA。此复合物在生理条件下表现出负电性,对正常细胞的毒性较小,在酸性相关感染部位切换为带正电荷,能够有效结合到带负电荷的细菌表面,从而增强了对革兰氏阴性细菌的光动力抗菌作用。如图7b和7c所示,在酸性条件下RB@PMB@GA对革兰氏阴性细菌和革兰氏阳性细菌都具有优异的杀菌作用,且具有比对照组更强的生物膜渗透能力。在体内导管植入构建的脓肿模型中,纳米复合物同样表现出优异的抗感染效果(图7d),为临床手术中医疗器械表面生物膜的消除提供了可行的方案。

图7 用于PDAT的pH响应性纳米系统[60]:(a)纳米颗粒的构建及抗菌作用示意图,(b)不同治疗条件下纳米颗粒对表达红色蛋白的大肠杆菌和金黄色葡萄球菌的抗菌性能,(c)不同pH下纳米颗粒对铜绿假单胞菌生物膜作用的CLSM照片,(d)不同治疗条件下大鼠的切口区域和植入导管图片(d1)以及菌落情况(d2)
除了pH值变化外,高水平的过氧化氢(H2O2)是感染病理微环境的另一个显著特征,常被用来触发药物的响应性释放。受这一特性的启发,Zhao等[61]构建了一个pH/H2O2双触发的光动力抗菌系统。如图8a所示,在这个系统中,5,10,15,20-四-{4-[3-(N,N-二甲基-氨基)丙氧基]苯基}卟啉(TAPP)充当pH敏感的光敏剂,由H2O2响应性的嵌段共聚物POEGMA-b-PBMA进行封装,其上的苯硼酸酯部分在中性和弱酸条件下稳定,但对H2O2敏感。在细菌引起的脓肿病灶部位(图8b),pH值降低且H2O2过量,光敏剂TAPP被释放,其上的叔胺基团可以在酸性条件下发生质子化作用,提高亲水性和与细菌的相互作用,大大提高了PDAT的治疗效果。与之相似,Hu等[62]的设计充分利用了生物膜感染微环境的酸性和过表达谷胱甘肽(GSH)的特点。如图8c所示,他们利用主客体组装作用将前药α-CD-NO和α-CD-Ce6与pH敏感的共聚物PEG-(KLAKLAK)2-DA进行组装,此纳米组装体在生理pH环境下具有带负电荷的表面,有利于在血液中长期循环,而在酸性生物膜pH下,α-CD-Ce6-NO-DA纳米药物表现出正电,促进生物膜内部的有效渗透并黏附到带负电的细菌表面(图8d)。随后,受到GSH的触发,α-CD-Ce6-NO-DA释放出NO,一方面降低了生物膜中GSH的浓度;另一方面,NO与光辐射下产生的ROS反应生成活性氮物质(reactive nitrogen species,RNS),表现出对细菌更强的损伤作用(图8e)。他们构建的表面电荷可切换的α-CD-Ce6-NO-DA纳米颗粒对MRSA生物膜感染表现出NO协同的光动力抗菌作用。类似地,对P.aeruginosa引起的角膜炎,Han等[63]发现基质金属蛋白酶(MMP),例如MMP-9,在细菌生物膜中过度表达,并在角膜融化中发挥关键作用。利用这一特性,他们将Ce6偶联的β-环糊精前药(β-CD-Ce6)和金刚烷缀合的MMP-9敏感肽(Ad-MMP-S PEPs)进行主客体组装,得到具有亲水外壳和疏水内核的组装体(MMP-S)(图9a)。正常生理环境下,多肽外壳表面带负电,可以减小对正常组织的损伤。到达角膜感染部位后,生物膜中过度表达的MMP-9切断肽链,去除负电保护层,暴露出阳离子多肽,有助于纳米颗粒渗透进入生物膜内部(图9b),并与P.aeruginosa结合,最终提高PDT的抗菌功效。在P.aeruginosa感染的角膜炎模型中,MMP-S+L组的抗菌效果最好(图9c),与抗生素左氧氟沙星效果相当,但后者有引起细菌耐药性的风险。加光条件下,此纳米组装体在体内也表现出优异的抗菌性能,这是系统内光敏剂和响应性阳离子肽共同作用的结果。由此制成的局部滴眼制剂可以很大程度上抑制细菌对角膜组织的进一步损害,降低角膜炎症反应。
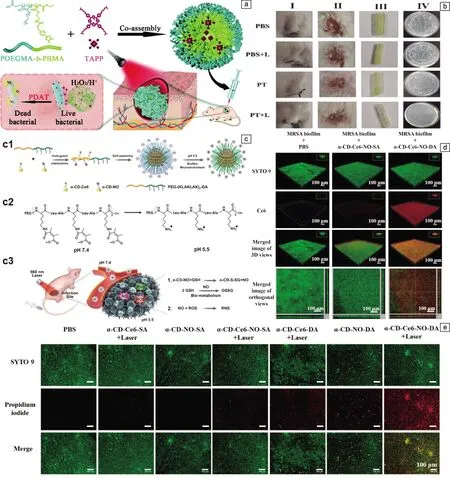
图8 pH/H2O2双触发的光动力抗菌系统示意图(a),体内导管植入模型中聚合物的抗生物膜活性(b)[61];α-CD-Ce6-NO-DA纳米颗粒的构建(c1)、酸触发的电荷反转(c2)和pH和GSH双响应的纳米组装体消除生物膜感染(c3)示意图(c),纳米组装体对MRSA生物膜的渗透能力(d),纳米组装体对MRSA生物膜的杀伤作用(e)[62]
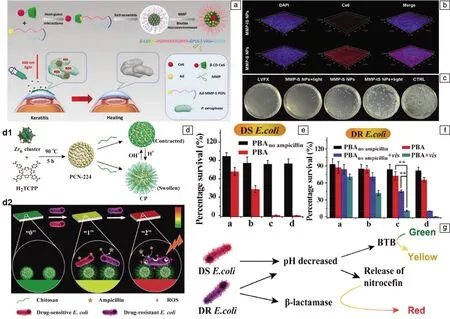
图9 MMP-9响应性组装体的构建和消除角膜感染示意图(a),MMP-S对P.aeruginosa生物膜的渗透能力(b),角膜组织处细菌菌落照片(c)[63];pH和耐药性响应的组装体的合成路线(d1)和可变色创可贴对pH和耐药性的响应作用(d2)示意图(d),可变色创可贴对药物敏感性细菌(e)和耐药性大肠肝菌(f)的抗菌作用,pH和β-内酰胺酶响应的可变色创可贴的作用机制示意图(g)[64]
PDAT作为一种广谱性杀伤细菌的新型抗菌方法,在对抗耐药菌感染中具有天然优势。除却普通细菌感染微环境的众多特性外,对β-内酰胺类抗生素不敏感的细菌产生的β-内酰胺酶也被视为耐药菌特定的识别信号。Sun等[64]设计了一种对细菌微酸性环境和耐药性响应性的纤维素基可变色创可贴。当此创可贴与敏感性细菌共同培养时,降低的pH使显色层溴百里酚蓝的颜色从绿色变为黄色,同时,被壳聚糖包裹的抗生素氨苄青霉素被释放,产生杀菌作用。另一方面,当其暴露在耐药性细菌环境中时,头孢硝噻吩作为β-内酰胺酶的底物,产生从黄色到红色的颜色变化。此时,基于光敏剂四(4-羧基苯基)-卟啉(TCPP)形成的MOF纳米粒子在光照条件下产生ROS,实现对耐药菌有效的光动力杀伤(图9d)。此可视化创可贴实现了在感测细菌耐药性后选择性地实施抗菌策略,即面对敏感性细菌时,采取基于抗生素的化学疗法,而对于耐药细菌诱导的感染,利用光动力作用进行补充(图9e~9g)。
与普通PDAT相比,基于高分子材料的微环境响应性光敏剂可以实现在感染部位的按需释放或激活,增强对细菌的靶向性和对生物膜的渗透作用,提高了材料的生物利用度,同时降低了抗菌药物或ROS对正常组织的毒副作用。
5 结 语
综上所述,针对细菌感染性疾病构建多功能高分子光敏剂的策略已经被众多研究者关注,具有良好的发展前景。常规的光动力抗菌疗法(photodynamic antibacterial therapy, PDAT)由于其广谱杀菌行为有望符合临床需求而被大量研究,细菌靶向性或微环境响应性的高分子光敏剂实现了材料的高效利用和更好的生物安全性。这些可行方案都为细菌感染性疾病的治疗提供了新思路。
然而,虽然研究人员已经对高分子材料的PDAT进行了大量研究,但仍存在一些障碍限制着这些材料的临床转化,如光敏剂(PSs)的跨膜能力和在细菌内的有效积累量直接影响PDAT作用效果、活性氧物质(ROS)的短寿命对它们的ROS产率提出更高要求等。另外,现有的PDAT研究主要集中在皮肤、角膜感染等表层感染疾病,受到光照穿透深度的限制,PDAT难以用于肺炎、肝炎等深层次疾病。并且,病灶部位低于正常部位的氧气浓度也是限制PDAT效果的因素之一。这些问题还需要寻找更多的方案来解决。此外,要推动高分子光敏剂的临床转化,需要对其体内毒性、生物分布、体内清除等进行系统评估,这些也有待进一步研究。总体而言,高分子材料在光动力抗菌领域的研究已经取得了初步成果,相信面临的大部分问题都可以通过后续的探索来解决,高分子抗菌材料将在临床光动力抗菌治疗中发挥越来越重要的作用。
