微/纳米结构含锌硅酸钙基涂层成骨性能研究
2022-08-06张昕玮胡丹丹李恺谢有桃黄利平郑学斌
张昕玮,胡丹丹,李恺,谢有桃,黄利平,郑学斌
(中国科学院上海硅酸盐研究所,上海,201899)
0 引言
为赋予金属骨植入物更良好的生物学性能,增强其与骨组织间的结合,需要在其表面制备生物涂层。利用等离子喷涂技术在钛合金等表面制备的硅酸钙(calcium silicate, CS)陶瓷涂层兼具良好生物活性和优良力学性能(特别是结合强度),有望弥补目前生物医用羟基磷灰石(hydroxyapatite, HA)涂层和钛(Ti)涂层的性能不足[1]。进一步的研究表明,在CS 涂层结构中引入一系列生物活性元素(例如镁、锌、锶、硼和铈等),通过改变其生物降解行为和生物活性,可以获得更优的成骨性能。镁黄长石(Ca2MgSi2O7)陶瓷涂层表面骨髓间充质干细胞(BMSCs)黏附和铺展良好,细胞增殖和成骨分化速率明显高于HA 涂层[2]。Zhang 等人[3]提出Sr-CaSiO3涂层的离子产物,尤其是Sr2+,能够促进BMSCs 的碱性磷酸酶(ALP)表达并提高体外矿化能力。Yu 等人[4]对等离子喷涂方法制备锌黄长石(Ca2ZnSi2O7)涂层的生物性能研究发现,与CaSiO3涂层相比,Ca2ZnSi2O7涂层更有利于前成骨细胞MC3T3-E1 增殖和ALP 表达。作者所在课题组在前期研究中发现,相比于Mg2+和Sr2+掺杂,CS 涂层中Zn2+的引入能显著上调其表面成骨细胞内I 型胶原(COL-I)和ALP蛋白与基因表达,可促进细胞早期分化[5]。此外,锌作为重要的无机抗菌剂,相比于抗生素,其具有持久抗菌性和不易产生耐药性等优点,因此,CS 涂层中引入Zn2+还能够赋予涂层抗菌性能,降低骨科植入手术早期细菌感染的风险[6]。综上所述,含锌的硅酸钙基涂层具有良好的成骨性能,有望用作骨科植入物用涂层。
除了对硅酸钙基涂层的化学组成进行优化,涂层表面形貌调控也是改善骨科植入物生物学特性的一种有效方法[7]。等离子喷涂技术是目前制造骨科植入物用HA 和Ti 涂层的常用方法,所制备的涂层表面具有微米级粗糙结构[8]。对等离子喷涂涂层进行表面纳米化改性以形成微/纳多级结构,可促进细胞快速响应,获得更佳的成骨性能。Wang 等人[9]通过等离子喷涂和水热处理制备了具有微/纳米形貌的CS 涂层,发现涂层中纳米片结构的引入降低了涂层的降解速率,提高了涂层成骨和成血管化活性。Hu 等人[10]也报道了类似的实验结果。相比于等离子喷涂CS 涂层,经水热处理后的CS 涂层表面具有微/纳米复合结构,而且显著改善了BMSCs 细胞的成骨分化能力。由此可见,等离子喷涂和水热处理的组合使用是在骨科植入物表面构建具微/纳米形貌涂层的有效策略。等离子喷涂CS 涂层在水热过程中引入Zn2+,有望赋予涂层抗菌和促成骨细胞分化的功能,但是其炎症反应的研究未见报道。骨免疫学理论揭示免疫系统和骨骼系统联系密切,炎症细胞(如巨噬细胞等)在骨相关的生理和病理过程中发挥了重要作用。随着骨免疫学研究的深入,骨科植入涂层材料的设计思路也由“避免宿主炎症反应”向“主动调控炎症反应”转变。
基于此,本文采用等离子喷涂技术并结合水热处理方法,制备了具有微/纳米表面结构的含锌硅酸钙基生物涂层,研究涂层材料表面形貌和溶出的生物活性离子对BMSCs 细胞成骨能力和RAW264.7 巨噬细胞极化行为的影响。
1 试验
1.1 涂层样品制备
采用化学沉淀法制备CS 粉体,选用烧结-破碎法对合成粉体进行造粒,以制备成流动性好、适合喷涂的颗粒。具体步骤如下:选取Ca(NO3)2·4H2O 和Na2SiO3·9H2O 为 原 材 料,按 照摩尔比为1:1 称取,用去离子水将两者分别配置成浓度为0.5 M 溶液。将氨水加入Ca(NO3)2溶液,调节pH 值至11,边搅拌边滴加Na2SiO3溶液。待沉淀完全后,继续搅拌8 小时。将沉淀物用去离子水、无水乙醇抽滤洗涤后,80 ℃下烘干8 小时,在1250 ℃下煅烧并保温3 小时,获得CS 粉体。将粉体压片,在1250 ℃下煅烧并保温3 小时,然后将煅烧后的陶瓷片破碎后过筛。
使用大气等离子喷涂设备,将烧结-破碎法制得的粉末喷涂于 Ti-6Al-4V 基底上,制备得到CS 涂层,具体参数见表1。随后对CS 涂层进行水热处理。具体步骤如下:称取Zn(NO3)2,用去离子水配制0.01 M 的溶液。将涂层样品放置在反应釜中,分别取50 mL 去离子水和0.01 M 的Zn(NO3)2溶液作为水热介质加入到反应釜中,180℃水热处理24小时,制得Zn0-CS、和Zn1-CS涂层。

表1 喷涂工艺参数Table 1 Plasma spraying parameters
1.2 涂层表面物理化学性能表征
采用X-射线衍射仪(XRD)测定粉体和涂层的相结构,连续扫描范围为2θ=10~70°,并选用Jade 软件分峰拟合功能分析涂层物相组成。利用场发射扫描电镜(FE-SEM)观测样品表面形貌和截面组织,样品化学元素分布通过扫描电镜附带的元素能谱仪(EDS)进行检测。采用比表面积测定仪检测涂层的比表面积和总孔体积,使用表面Zeta 电位仪测量材料的表面电位。采用电感耦合等离子质谱仪(ICP-OES)测量溶液中离子浓度,将涂层材料浸没于1 mL 细胞培养液中,在37℃、5% CO2条件下无菌浸泡1、4 和7 天。收集液体,检测其中Ca、Si 和Zn 离子含量,计算累计浓度。
1.3 涂层成骨性能表征
将涂层样品转移到24 孔板内,每孔加500µL 细胞培养液,37℃的细胞培养箱培养3 小时。吸走废液,磷酸缓冲盐溶液(phosphate buffered saline, PBS)清洗后,将涂层样品转移至新的24孔板。每孔加入500 µL 1%的十二烷基硫酸钠,在室温下摇床1 小时,使得材料表面蛋白脱落。采用BCA 试剂盒方法检测蛋白浓度,使用酶标仪检测λ 为562 nm 的吸光度(OD)值。
选取状态良好的BMSCs,吸去废液,PBS 缓冲液轻轻冲洗,用胰酶消化后,用培养液调整细胞浓度至 3×104细胞/mL。将涂层材料放入48孔板中,加入1 mL 细胞悬液,在37℃、5% CO2条件下孵育24 小时,吸去废液,PBS 缓冲液小心冲洗涂层表面。将材料转移至新的孔板中,用于电镜观察。
采用Cell Counting Kit-8 试剂盒检测细胞增殖能力。BMSCs 以1×104细胞/mL 的密度接种在涂层表面,在生长培养液中培养1、4 和 7 天。使用酶标仪检测波长为450 nm 的OD 值。采用实时-聚合酶链反应(Real-time PCR)技术检测涂层表面BMSCs 中基因的表达。具体来说,BMSCs以5×105细胞/mL 的密度接种于涂层表面,在细胞贴壁后,在成骨诱导培养液中继续分别培养2和7 天。待到时间节点,使用仪器实时监测PCR反应进程并记录。第2 天检测整联蛋白(Integrin)α2、α5、αv、β1、β3 和黏着斑蛋白(vinculin)和黏着斑激酶(focal adhesion kinase, FAK)相关基因表达。待到第7 天,检测成骨分化相关基因,包括核心结合因子ALP、骨钙素(OCN)、缺氧诱导因子(HIF)-1a、血管内皮生长因子(VEGF)、核因子κB 受体活化因子配体(RANKL)和骨保护素(OPG)的表达。
1.4 涂层炎症反应测试
采用 Real-time PCR 技术检测涂层表面RAW 264.7 巨噬细胞中基因的表达。具体来说,RAW 264.7 以5×105细胞/mL 的密度接种于涂层表面,在37 ℃、5% CO2条件下孵育3 天。待到时间节点,利用仪器实时监测PCR 反应进程并记录。检测基因包括趋化因子受体(CCR7)、一氧化氮合成酶(iNOs)、甘露糖受体(CD206)、I 型精氨酸酶(ARG)、大鼠肿瘤坏死因子-α (TNF-α)、白介素-1β(IL-1β)、白介素-6 (IL-6)、白介素-1 受体拮抗剂(IL-1ra)和白介素-10 (IL-10)。
1.5 数据统计
实验数据都重复至少三次。用Origin 9.0 进行数据分析处理,数据采用平均值±标准差表示。组间数据的比较采用方差分析法(ANOVA),P <0.05 即代表组别之间具有显著性差异,其中*表示P < 0.05, **表示P < 0.01。
2 结果与分析
2.1 涂层表面的物理化学性能
图1(a)~(c)分别是不同放大倍数下等离子喷涂CS 涂层、纯水水热改性Zn0-CS 涂层和0.01 M的Zn(NO3)2水溶液水热改性涂层的表面形貌照片。CS 涂层由熔融以及半熔融颗粒堆积而成,表面呈粗糙结构。从图中可以看出,利用纯水和0.01 M Zn(NO3)2溶液为水热介质,经过180 ℃水热反应24 小时后,CS 涂层表面覆盖了一层具有纳米薄片表面结构(记为Zn0-CS 和Zn1-CS)。有研究表明[11],溶液中钙硅比能够调控形成的水合硅酸钙形貌,较低钙硅比的水化硅酸钙微观结构主要呈片状,随着钙硅比提高出现短粗的针棒状,当钙硅比继续提高则以细长的针棒状为主。

图1 涂层的表面形貌:(a1), (a2) CS; (b1), (b2) Zn0-CS; (c1), (c2) Zn1-CSFig. 1 SEM images of the coatings: (a1), (a2) CS; (b1), (b2) Zn0-CS; (c1), (c2) Zn1-CS
图2 是CS、Zn0-CS 和Zn1-CS 涂层的截面背散射形貌。Zn1-CS 涂层截面厚度明显增加。为了进一步观察CS、Zn0-CS 和Zn1-CS 涂层中各元素分布变化情况,对涂层截面进行了面扫描分析。从图中可以看出CS、Zn0-CS 和Zn1-CS 涂层中Ca、Si 和O 元素分布均匀,Zn1-CS 涂层中Zn 元素主要集中在涂层表面。

图2 涂层截面SEM 形貌和元素面扫描:(a) CS; (b) Zn0-CS; (c) Zn1-CSFig. 2 SEM images of the coatings and elements mappings: (a) CS; (b) Zn0-CS; (c) Zn1-CS
图3 是CS、Zn0-CS 和Zn1-CS 涂 层 表 面的XRD 图谱。由图中可以看出,CS 涂层表面主要由α-CaSiO3相组成,同时存在大量非晶相。Zn0-CS 涂层表面α-CaSiO3主相的特征峰强度略降低,同时出现托贝莫来石相。Zn1-CS 涂层中α-CaSiO3相基本消失,表面出现新的物相Zn4Si2O7(OH)2(H2O),与截面元素分布结果相符合。

图3 CS、Zn0-CS 和Zn1-CS 涂层的XRD 图谱Fig. 3 XRD patterns of the CS, Zn0-CS and Zn1-CS coatings
表2 是CS、Zn0-CS 和Zn1-CS 涂层部分表面性质,包括比表面积、总孔体积(孔容)以及表面Zeta 电位。Zn0-CS 和Zn1-CS 涂层比表面积和孔容均有提高,比表面积分别是CS 涂层的1.3 和1.6 倍,而孔容分别达到CS 涂层的12.2 和36.0 倍。Zn0-CS 和Zn1-CS 涂层表面纳米片状结构相互堆积而形成的狭缝孔,有助于提高涂层总孔体积(孔容)。有学者[12]研究发现具有纳米结构的材料拥有高的比表面积,能够富集蛋白质,激活整联蛋白相关信号通路,继而调控细胞粘附、增殖与分化行为,改善植入物的表面生物学性能。另外,Zn0-CS 和Zn1-CS 涂层表面Zeta 电位有所降低。表面电势降低可能是由于硅酸钙涂层水热处理后表面形成电负性的Si-OH[13]。

表2 涂层的表面性质Table2 The surface properties of the coatings
图4 是CS、Zn0-CS 和Zn1-CS 涂层浸泡于细胞培养液中1 天后的Ca、Si 和Zn 离子浓度。从图中可以看出,Zn1-CS 涂层中Ca 和Si 离子释放量显著低于CS 和Zn0-CS 涂层。这与Zn1-CS 涂层表面形成稳定新物相Zn4Si2O7(OH)2(H2O)有关。有研究[14]报道,一定含量的Zn2+释放,能显著促进细胞增殖、分化等行为。

图4 CS、Zn0-CS 和Zn1-CS 涂层浸泡于细胞培养液中1 天的离子溶出量Fig. 4 Ca, Si and Zn ion concentration from the coatings in the cell culture medium for 1 day
2.2 具微纳米复合结构的含锌硅酸钙涂层的成骨性能
为了研究纳米片表面结构与Zn 离子对生物学性能的影响,将Zn0-CS 和Zn1-CS 涂层作为研究对象,CS 涂层作为对照。图5 (a)和(b)分别是CS、Zn0-CS 和Zn1-CS 涂层浸泡于细胞培养液中2 小时后的总蛋白和纤连蛋白FN 吸附量的结果。相较于CS 涂层,Zn0-CS 和Zn1-CS 涂层表面总蛋白吸附量略有增加,且Zn0-CS 涂层表面总蛋白吸附量最高。这可能是因为Zn0-CS 涂层表面Zeta 电位高于Zn1-CS,有利于带负电的蛋白质的静电吸附。另外,Zn1-CS 涂层表面FN 吸附量显著高于Zn0-CS 涂层。以上结果表明,纳米表面结构整体对总蛋白吸附影响有限,Zn 的引入能够显著促进FN 吸附。特异性蛋白FN,广泛参与细胞迁移、粘附、增殖及组织修复等过程,调动单核吞噬细胞系统清除损伤组织处有害物质,具有趋化因子作用。
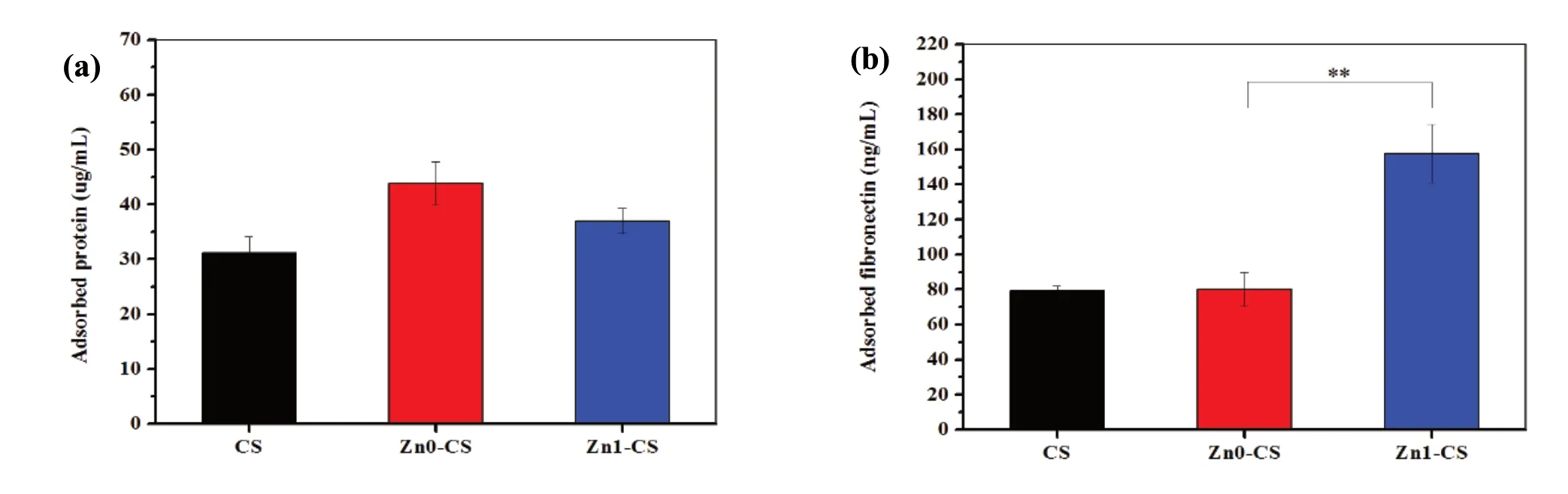
图5 CS、Zn0-CS 和Zn1-CS 涂层表面浸泡于细胞培养液中2 小时后:(a) 总蛋白吸附量;(b) 纤连蛋白吸附量Fig.5 CS, Zn0-CS and ZN1-CS coating surfaces were immersed in cell culture medium after 2 hours:(a) serum protein adsorption; (b) fibronectin adsorption
图6 是CS、Zn0-CS 和Zn1-CS 涂 层 表 面BMSCs 粘附24 小时后的SEM 形貌。从图中可以看出,CS 涂层表面细胞只有轻微铺展,呈现细长形态,与涂层表面复杂形貌相适应。Zn0-CS 涂层表面细胞铺展良好,具有典型的多边形的成骨细胞的形态,但只有少量伪足形成。Zn1-CS 涂层表面细胞铺展程度更高,且质膜外突起伸展形成较多丝状伪足牢固地粘附于材料表面。结果表明,纳米表面结构具有较好的细胞相容性,能支持细胞的粘附与铺展。


图6 涂层表面培养24 小时后的BMSCs 的SEM 形貌:(a) CS; (b) Zn0-CS; (c),(d) Zn1-CSFig.6 SEM morphologies of BMSCs cultured on the coating surfaces for 1 day: (a) CS; (b) Zn0-CS; (c), (d) Zn1-CS
利用Real-time PCR 技术检测BMSCs 在涂层表面培养2 天后的粘附相关基因表达。从图7 中结果可以看出,相较于CS 涂层,Zn0-CS 和Zn1-CS 涂层表面细胞Integrin 以及下游vinculin 和FAK 均有显著提高,结果表明纳米表面结构显著促进Integrin 相关基因表达。

图7 BMSCs 在CS、Zn0-CS 和Zn1-CS 涂层表面培养2 天后:(a) Integrin α2、α5、αv、β1、β3 表达结果;(b) vinculin 和FAK 因子表达结果Fig.7 BMSCs were cultured on CS, Zn0-CS and ZN1-CS coatings for 2 days:(a) gene expression of integrin α2, α5, α V, β1, β3; (b) gene expression of Vinculin and FAK factors
图8 是BMSCs 在CS、Zn0-CS 和Zn1-CS 涂层表面培养1、4 和7 天的CCK-8 分析结果。随着培养时间增加,三种涂层表面细胞数量均增加,均能支持BMSCs 的增殖行为。在同一时间内,BMSCs 在Zn1-CS 涂层表面细胞数量最多,而在Zn0-CS 涂层表面细胞数量最少。Zn0-CS 涂层表面细胞增殖速率降低的原因,可能是由于细胞与涂层表面纳米结构紧密地结合从而阻碍了细胞迁徙与分裂。Zn0-CS 和Zn1-CS 涂层表面形貌接近,但Zn1-CS 涂层在细胞培养液中释放少量的Zn2+,能够促进细胞增殖。

图8 BMSCs 在CS、Zn0-CS 和Zn1-CS 涂层的表面培养1、4 和7 天的CCK-8 分析结果Fig.8 The BMSCs proliferation of cultured on the coatings for 1, 4 and 7 days
图9 是BMSCs 在CS、Zn0-CS 和Zn1-CS 涂层表面培养7 天后的成骨分化和成血管化相关基因表达。从图中可以看出,相较于CS 和Zn0-CS 涂层,Zn1-CS 涂层表面BMSCs 成骨分化基因ALP、OCN 表达显著增加。结果表明,纳米表面结构能够促进成骨分化基因ALP 和OCN 的表达,Zn 的引入能够进一步增强成骨分化作用。虽然Zn1-CS 涂层表面BMSCs 成血管分化基因HIF-1α 表达有所增加,但VEGF 表达无显著变化。另外,BMSCs 在CS、Zn0-CS 和Zn1-CS 涂层表面培养7 天后的破骨分化相关基因OPG、RANKL表达以及OPG/RANKL 比值无显著性差异。OPG/RANKL 比值是调节破骨细胞生物学性能和骨吸收最终效应的决定性因素,比值越高表明抑制破骨分化能力越强。结果表明Zn1-CS 涂层显著促进BMSCs 成骨分化,但对成血管化和抑制破骨分化作用甚微。

图9 BMSCs 在CS、Zn0-CS 和Zn1-CS 涂层表面培养7 天后的骨相关基因表达情况:(a) ALP、OCN、HIF-1a、VEGF; (b) OPG、RANKL、OPG/RANKLFig. 9 Bone-related gene expression of BMSCs cultured on the CS, Zn0-CS and Zn1-CS coating surfaces for 7 days:(a) ALP、OCN、HIF-1a、VEGF; (b) OPG、RANKL、OPG/RANKL
2.3 具微纳米复合结构的含锌硅酸钙涂层的炎症反应
巨噬细胞作为固有免疫的重要组成部分,其效应功能对于骨科植入物愈合过程中炎症的发展和纤维化的发生发挥重要作用[15]。人们通常用经典活化巨噬细胞(M1 型)和替代活化巨噬细胞(M2 型)来区分其效应功能,其中M1 型巨噬细胞具有促进炎症的功能,倾向于引起慢性炎症反应和纤维化,相比之下,M2 型巨噬细胞可促进细胞外基质构建,倾向于终结炎症反应和促进组织愈合。图10 是RAW 264.7 细胞在CS、Zn0-CS 和Zn1-CS 涂层培养3 天后的M1 和M2 表型相关基因表达,检测基因包括CCR7、iNOs、CD206 和ARG。从图中可以看出,相较于CS 涂层,Zn0-CS 和Zn1-CS 涂层表面细胞M1 表型因子(CCR7和iNOs)略有降低,而M2 表型因子(CD206 和ARG)表达显著增加,其中Zn1-CS 涂层细胞M2表型因子表达显著高于Zn0-CS 涂层。

图10 RAW 264.7 细胞在CS、Zn0-CS 和Zn1-CS 涂层表面培养3 天后的M1 和M2 表型标记:(a) CCR7; (b) iNOs; (c) CD206; (d) ARGFig.10 Relative mRNA expressions of the M1 marker (CCR7 and iNOs) and M2 marker (CD206 and ARG)by RAW 264.7 cells cultured on the CS, Zn0-CS and Zn1-CS coatings: (a) CCR7; (b) iNOs; (c) CD206; (d) ARG
图11 是RAW 264.7 细 胞 在CS、Zn0-CS 和Zn1-CS 涂层培养3 天后的炎症相关因子表达,检测的基因包括TNF-a、IL-1b、IL-6、IL-1ra 和IL-10。从图中可以看出,相较于CS 涂层,Zn0-CS和Zn1-CS 涂层表面细胞促炎症因子(TNF-α、IL-1β和IL-6)表达略有降低,而抑炎症因子(IL-1ra和IL-10)表达显著增加,其中Zn1-CS 涂层表面细胞抑炎症因子表达显著高于Zn0-CS 涂层。Varmette 等人[16]研究结果也证实,掺Zn 的58S生物活性玻璃(Zn-58S)能够显著降低由内毒素脂多糖刺激产生的TNF-α 和IL-6,具有抗炎症的效应。结果表明,纳米表面结构能显著促进抑炎症因子表达,有利于创建良好的骨免疫微环境,Zn的引入进一步促进了这一过程。
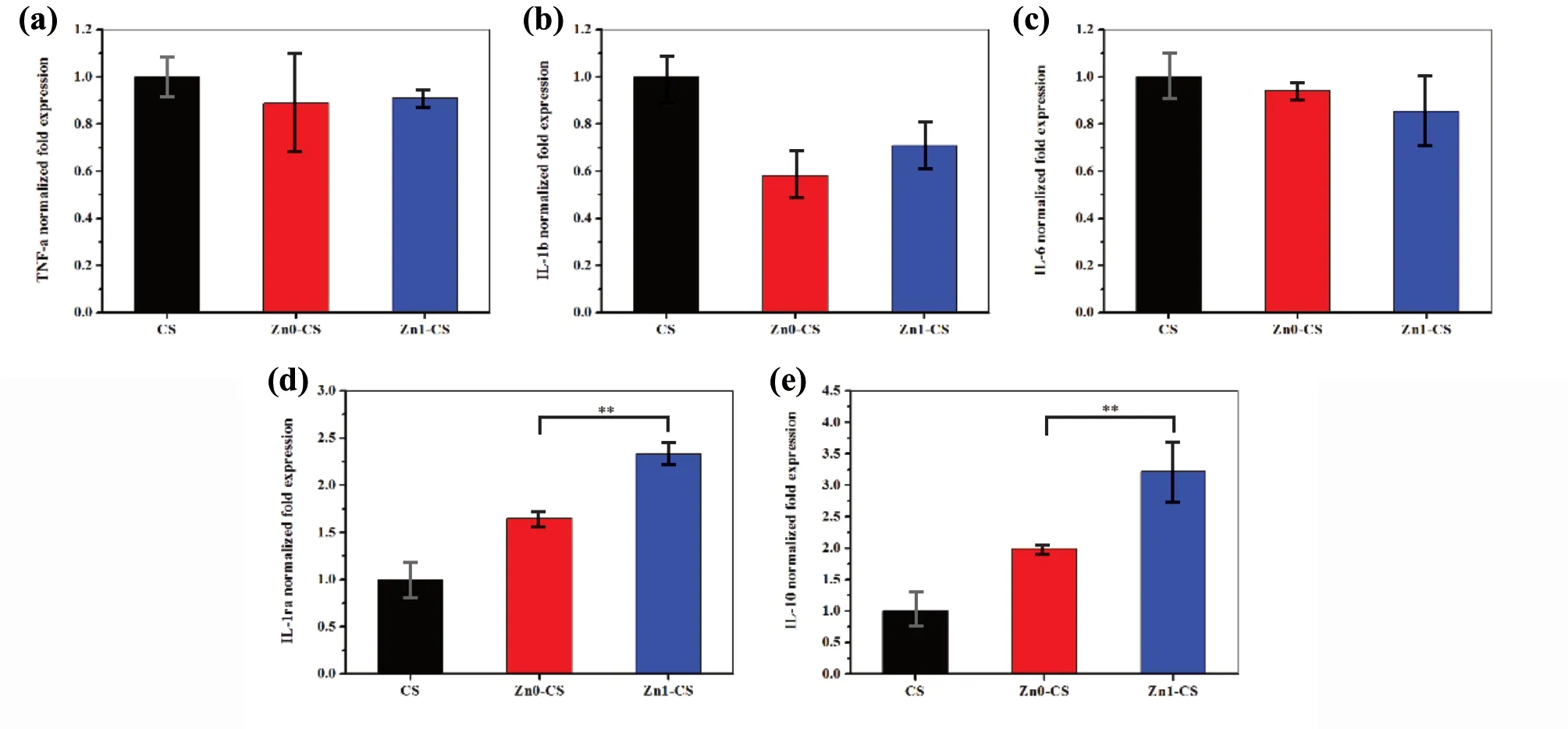
图11 RAW 264.7 细胞在CS、Zn0-CS 和Zn1-CS 涂层表面培养3 天后的炎症相关基因表达情况:(a) TNF-a; (b) IL-1b; (c) IL- 6; (d) IL-1ra; (e) IL-10Fig.11 Relative mRNA expressions of inflammation related genes by RAW 264.7 cells cultured on the CS,Zn0-CS and Zn1-CS coatings: (a) TNF-a; (b) IL-1b; (c) IL- 6; (d) IL-1ra; (e) IL-10
3 结论
(1) 等离子喷涂CS 涂层表面引入纳米片结构可提高其比表面积和孔容,能够吸附更多血清蛋白和特异性蛋白FN,通过刺激整联蛋白以及下游vinculin 和FAK 基因表达,提高了BMSCs 铺展能力。涂层中Zn2+的引入进一步提高了其表面BMSCs 的增殖能力和与成骨相关的ALP 和OCN基因表达,可诱导BMSCs 向成骨细胞分化。
(2) 等离子喷涂CS 涂层中引入纳米片结构能够上调RAW264.7 巨噬细胞中M2 表型因子(CD206 和ARG)表达,Zn2+的引入进一步促进了抑炎症因子IL-1ra 和IL-10 表达,促使RAW 264.7 细胞向抑炎症M2 型转化,这有利于创建良好的骨免疫微环境,促进骨形成的发生。
