NCX-4016通过下调终末化糖基产物受体表达抑制高糖内环境诱导的动脉粥样硬化
2022-08-06寇进,尹锐,任锋△
寇 进,尹 锐,任 锋△
1.武警陕西省总队医院心血管内科,陕西西安 710054;2.成都医学院第二附属医院心血管内科,四川成都 610057
近年来,我国冠心病发病率快速增长[1]。目前,尽管临床上对冠心病采取了有效的二级预防及介入治疗措施,但其发病率及病死率在西方国家仍居高不下[1]。动脉粥样硬化是一种由脂代谢异常和血管壁斑块脂质沉积介导的慢性炎症性疾病[2]。近年来,终末化糖基产物受体(RAGE)作为天然免疫中的一种模式识别受体,其在动脉粥样硬化进程中的作用及机制已被广泛深入地研究,已被证实不仅参与了动脉粥样硬化的早期形成,也促进了晚期斑块的进展[2-3]。研究发现,通过基因敲除或给予竞争性拮抗剂等方法降低RAGE表达,可明显抑制动脉粥样硬化斑块的形成,并稳定晚期斑块[4],这说明RAGE是防治动脉粥样硬化的潜在关键靶点。内皮功能不全常常与动脉粥样硬化合并发生,既是冠状动脉粥样硬化的起始阶段,也是血管壁炎性反应激活状态下血管内皮细胞的损伤性反应[5]。一氧化氮(NO)作为一种重要的血管舒张因子,通过鸟苷酸环化酶途径促进环磷酸鸟苷(cGMP)的生成,其减少将抑制cGMP形成,导致血管收缩,进一步加重血管内皮功能障碍。因此,NO是一种抗动脉粥样硬化和抗血栓形成的内源性物质[6]。有学者在动物实验中已经发现NO供体药物NCX-4016对脂多糖(LPS)介导的大鼠内毒素血症具有明显的抗炎作用,但没有对其是否可以明显抑制或逆转动脉粥样硬化斑块的形成做出解答[7]。从机制上来说,虽然目前已有研究发现在慢性肾脏病和糖尿病肾病患者中,AGEs/RAGE通路通过抑制内皮型一氧化氮合酶 (eNOS),影响内源性NO的产生,从而使正常的抗炎和细胞保护效应丧失。但是否存在RAGE-eNOS的正反馈环路,即外源性补充NO分子是否能够通过抑制RAGE介导的固有免疫炎症通路同时促进下游eNOS表达的增加,从而发挥抗炎和抗动脉粥样硬化作用仍然不得而知[8-9]。因此,本研究提出了NO可以直接影响血管RAGE表达水平,发挥抗炎作用,进而抑制动脉粥样硬化进程的假设,希望证实并阐明NO对动脉粥样硬化及损伤内皮细胞中RAGE表达的调节作用及机制,为动脉粥样硬化的防治提供新的理论依据。
1 材料与方法
1.1动物来源 2型糖尿病动脉粥样硬化模型小鼠为apoE-/-小鼠和db/db小鼠模型杂交鼠10只,购自南京大学模式动物研究所,给予高脂饮食喂养诱导动脉粥样硬化模型,分为实验组和对照组,每组5只。实验组根据小鼠体质量,给予5 mg/g尾静脉注射NCX-4016,2 d 1次,持续4周。对照组给予等量生理盐水注射,2 d 1次,持续4周。
1.2主要试剂 人脐静脉内皮细胞系(hUVECs)购自上海复祥生物科技有限公司。NO供体药物NCX-4016由纽约大学STEFANO FIORUCCI教授实验室馈赠,RAGE、白细胞介素(IL)-1β、高迁移率族蛋白B1(HMGB1)、核转录因子-κB(NF-κB)p65、IL-6、肿瘤坏死因子(TNF)-α等抗体均购自Abcam公司(美国)。PKG抑制剂TK5823购自碧云天生物技术有限公司。小鼠血清可溶性晚期糖基化终末产物受体(sRAGE)酶联免疫吸附试验(ELISA)检测试剂盒购自默沙克生物科技有限公司。 晚期糖基化终末分化产物标准品AGE-BSA购自BioVision(丹麦)生物科技有限公司。
1.3ELISA检测sRAGE水平 给予两组小鼠相应处理4周后,采集小鼠血液标本。按照ELISA检测试剂盒说明书对小鼠血清sRAGE水平进行检测,利用标准品设立标准曲线后,采用双抗夹心法标记生物素,加入辣根过氧化物酶结合物工作液,37 ℃孵育30 min,加入TMB显色试剂进行显色反应后立即在酶标仪上测量吸光度(A)值,根据A值在标准曲线上求出相应的血清sRAGE水平。
1.4主动脉根部油红,染色和斑块面积评估 在分别给予实验组NCX-4016治疗和对照组生理盐水注射4周后,处死两组小鼠,暴露胸腔,切除心脏,取主动脉根部组织包埋于—20 ℃ OCT包埋剂中,从心底朝主动脉开口方向连续切片,自出现主动脉瓣膜开始,每隔80 μm取一张切片,连续取6张贴于同一载玻片上,切片于—80 ℃冰箱中保存。主动脉根部粥样硬化斑块油红染色步骤如下:(1)冰冻切片取出后室温干燥1 h;(2)4%中性甲醛溶液固定10 min,去离子水洗2次,每次5 min;(3)60%异丙醇洗30 s;(4)油红O染液染色18 min;(5)60%异丙醇洗30 s,去离子水洗2次,每次5 min;(6)苏木素染液染核10 min;(7)自来水冲洗5 min,去离子水洗5 min;(8)亮绿染液染4 min,去离子水洗1 min;(9)干燥后纯甘油封片;(10)Leica光学显微镜下观察并拍照后,采用Image Pro Plus图像软件计算斑块面积。
1.5免疫组化染色 为了观察动脉粥样硬化斑块内RAGE表达情况,采用免疫荧光染色法检测主动脉根部组织冰冻切片中RAGE相对表达水平及部位,步骤如下:(1)主动脉根部组织冰冻切片取出后室温干燥1 h;(2)4%中性甲醛溶液固定10 min,去离子水洗2次,每次5 min;(3)5%山羊血清封闭1 h;(4)加一抗4 ℃孵育过夜;(5)磷酸盐缓冲液(PBS)洗3次,每次5 min,加红色荧光二抗(1∶500)室温孵育1 h;(6)PBS洗3次,每次5 min,加DAPI(1 μg/mL)染核10 min;(7)PBS洗3次,每次5 min,并采用纯甘油封片;(8)Leica荧光显微镜下观察并拍照,采用Ipp6.0图像软件进行灰度值计算。
1.6细胞培养及处理 hUVECs于25 mmol/L DMEM高糖培养基中加20%胎牛血清混合后分别培养,加1%链青霉素防止细胞污染。传代两次且待细胞融合度至80%左右,加入1 μg/mL LPS诱导炎症损伤反应6 h后,分为4组,按如下方法进行不同干预:(1)PBS处理组采用PBS进行处理;(2)NCX-4016组采用5 μmol/L NCX-4016 进行处理;(3)eNOS抑制剂+NCX-4016组采用100 μmol/L eNOS抑制剂,5 μmol/L NCX-4016进行处理;(4)PKG抑制剂+NCX-4016组采用1 μmol/L KT5823和5 μmol/L NCX-4016进行处理。所有细胞实验均进行3次独立重复实验。
1.7Western blot法检测 采用Western blot法检测两组小鼠主动脉根部组织和hUVECs中RAGE、NF-κB p65、eNOS、IL-1β、IL-6、TNF-α等相对表达水平。采用RIPA裂解液提取血管组织总蛋白,并用BCA试剂盒测定蛋白浓度后将相同质量蛋白上样至10% SDS-PAGE分离胶中,按60 V 40 min,90 V 150 min的条件进行蛋白电泳,电泳完成后利用湿转仪,以350 mA、120 min的条件将蛋白湿转至PVDF膜上,以5%BSA封闭液将PVDF膜室温孵育1 h,按最佳浓度配制一抗工作液进行一抗孵育,4 ℃过夜。弃去一抗工作液,用TBST洗膜3次,每次10 min后,按1∶4 000比例加入相应二抗,室温孵育1 h。弃去二抗工作液,用TBST洗膜3次,每次10 min,取出PVDF膜并用吸水纸吸取膜表面水分,将其浸入ECL工作液中(A及B液等体积混匀即可),室温孵育2 min后曝光,采用QUANTITY ONE软件分析蛋白条带灰度值,以β-actin作为内参计算蛋白质相对表达量。

2 结 果
2.1对照组与实验组主动脉根部斑块面积的比较 对照组小鼠主动脉根部动脉粥样硬化斑块面积明显大于实验组,见图1。对照组和实验组小鼠动脉粥样硬化斑块面积占主动脉根部面积比分别为(25.62±3.34)%、(37.43±3.56)%,差异有统计学意义(P<0.05)。
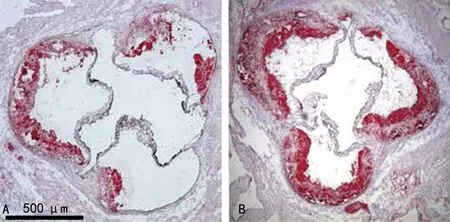
注:A为对照组;B为实验组。图1 两组小鼠主动脉根部油红染色图
2.2对照组与实验组主动脉根部斑块组织内RAGE、炎症信号通路蛋白和炎症因子水平比较 Western blot检测结果显示,与对照组比较,实验组小鼠主动脉根部RAGE及其下游炎症信号通路蛋白和炎症因子相对表达水平明显降低,见图2A。与对照组比较,实验组主动脉根部斑块组织内RAGE和NF-κB p65相对表达水平明显减少,eNOS相对表达水平增加,差异均有统计学意义(P<0.05);两组HMGB1蛋白表达水平比较,差异无统计学意义(P>0.05),见图2B。同时,与对照组比较,实验组TNF-α、IL-6、IL-1β水平明显减少,差异均有统计学意义(P<0.05),见图2C。
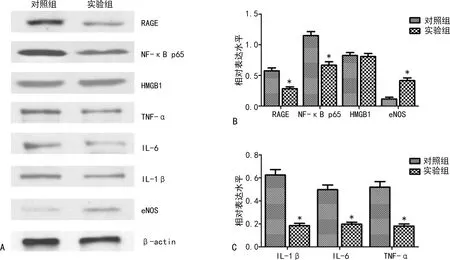
注:A为各项指标Western blot检测结果;B为对照组与实验组主动脉根部斑块组织内RAGE、炎症信号通路蛋白比较;C为对照组与实验组主动脉根部斑块组织内炎症因子比较;与对照组比较,*P<0.05。图2 对照组与实验组主动脉根部组织RAGE、炎症信号通路蛋白和炎症因子水平比较
2.3糖尿病动脉粥样硬化小鼠的sRAGE血清学水平 ELISA检测结果显示,实验组与对照组血清sRAGE水平分别为(2.82±0.19)、(2.44±0.20)ng/mL,两组比较,差异无统计学意义(P>0.05)。
2.4NCX-4016处理对高糖刺激联合LPS诱导后的hUVECs的细胞炎症信号通路蛋白、炎症因子表达水平的影响 与PBS处理组比较,NCX-4016组中,NCX-4016处理接受高糖刺激及LPS诱导的hUVECs后,采用Western bolt法检测细胞炎症信号通路蛋白和炎症因子的表达情况,其中HMGB1表达无明显改变(P>0.05),RAGE及NF-κB p65表达明显降低(P<0.05,图3),炎症因子IL-1β、IL-6和TNF-α表达明显降低(P<0.05,图4)。 与NCX-4016组比较,eNOS抑制剂+NCX-4016组IL-6表达水平无明显改变(P>0.05),但NF-κB p65、RAGE、IL-1β、TNF-α表达水平明显升高,差异有统计学意义(P<0.05,图5、6)。与NCX-4016组比较,PKG抑制剂+NCX-4016组NF-κB p65、IL-1β、IL-6和TNF-α表达水平均明显升高,差异有统计学意义(P<0.05,图5、6)。
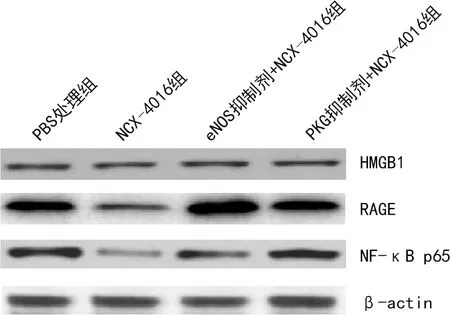
图3 不同体外干预方式处理hUVECs后炎症通路蛋白的Western blot检测结果

图4 不同体外干预方式处理hUVECs后炎症因子的Western blot检测结果

注:与NCX-4016组比较,*P<0.05。图5 不同体外干预方式处理hUVECs后炎症因子水平比较

注:与NCX-4016组比较,*P<0.05。图6 不同体外干预方式处理hUVECs后炎症通路蛋白水平比较
3 讨 论
近年来RAGE在动脉粥样硬化进程中的作用引发了极大关注。RAGE可与HMGB1、晚期糖基化终末产物(AGEs)、S100/钙颗粒素、β-淀粉样蛋白及两性蛋白多个配体结合,从而活化P38、NF-κB等信号通路,进而上调细胞间黏附分子1、血管细胞黏附分子1及TNF-α等炎症因子水平[10-11]。在糖尿病致动脉粥样硬化斑块形成和进展的过程中,内源性生成增加的AGEs通过与其在炎症细胞和内皮细胞上的RAGE相结合,激活炎症通路并释放炎症因子,这些炎症因子可活化单核/巨噬细胞等炎症细胞,促进其黏附、浸润至血管内膜下,进一步促进局部炎性反应及动脉粥样硬化的发生、发展[8-9]。已有研究证实,RAGE与apoE基因双敲除小鼠动脉粥样硬化斑块面积明显低于apoE-/-小鼠,同时,采用sRAGE对apoE-/-小鼠进行干预,通过其竞争性抑制RAGE的作用可以明显抑制动脉粥样硬化斑块的形成及晚期斑块的进展[12]。此外,临床研究发现低血浆sRAGE水平与非糖尿病男性冠心病心血管事件发生相关[13]。这些研究提示RAGE在动脉粥样硬化的进展中起了关键作用。因此,阐明动脉粥样硬化中RAGE的表达机制,从而探索调节RAGE水平的方法已成为防治动脉粥样硬化的一条可行途径。
RAGE有组成型和诱导型两种,组成型RAGE主要表达于胚胎发育时期,成年后除肺与皮肤外,其他组织、细胞表达均下调,而诱导型RAGE在单核/巨噬细胞、内皮细胞、平滑肌细胞等多种细胞内正常生理条件下表达很低,只有在RAGE的配体增多或者其转录因子(包括SP-1与NF-κB)活化时,诱导型RAGE才表达增多[14-15]。RAGE还可分为细胞表面的膜RAGE和sRAGE,前者为AGEs的模式识别受体,激活后可以介导炎性反应,后者为可溶性分子形式,由RAGE的mRNA剪接演变而来,可以在循环血中捕获AGEs,竞争性拮抗经典性受体控制的炎症信号通路。RAGE信号通路激活后可介导活性氧(ROS),活化下游NF-κB,促进炎性反应的发展,而炎症细胞可直接释放HMGB1与S100/钙颗粒素,这些因子均可诱导RAGE表达增加[14,16]。本研究发现,对照组的apoE-/-小鼠和db/db小鼠模型杂交鼠主动脉内膜上已有明显的炎症细胞黏附、浸润,表明本研究处理之前已经发生了内皮功能不全;同时,对照组apoE-/-小鼠和db/db小鼠模型杂交鼠主动脉根部斑块组织内的RAGE表达明显升高。故内皮功能不全可能参与了RAGE的表达调节。
内皮功能不全以内皮源性NO减少为主要特点,通过减少内皮源性NO、增加ROS水平、上调内皮细胞表面黏附分子、增加内皮细胞通透性、促进炎症细胞黏附浸润等促进动脉粥样硬化的发生、发展,是动脉粥样硬化的起始阶段[17]。NO供体药物已经被证实可以在动物模型中抑制LPS介导的内毒素血症和炎性反应。NO供体及其他改善内皮功能不全的药物(如他汀类药物)均可通过抗炎效应抑制动脉粥样硬化的进程[18]。近年来,研究发现他汀类及血管紧张素转换酶抑制剂(ACEI)类药物可抑制动脉粥样硬化斑块中RAGE的表达,且对RAGE的抑制作用在此类药物改善动脉粥样硬化中发挥了重要作用,说明RAGE作为一种重要的炎症信号通路在冠状动脉粥样硬化形成中具有重要意义[19-20]。本研究进一步研究发现,NO供体药物抑制了具有2型糖尿病背景的模型小鼠动脉粥样硬化的进展,同时也降低了血管中RAGE的蛋白表达,但不影响RAGE上游的HMGB1。此外NO供体药物可以通过抑制RAGE表达,减轻RAGE对eNOS表达的负调控作用,促进eNOS表达增加,从而产生NO内源性合成的正反馈效应。而上述作用在体外诱导hUVECs实验中均被NO抑制剂和PKG抑制剂所逆转。NO供体药物可以通过抑制RAGE表达,减轻RAGE对eNOS表达的负调控作用,促进eNOS表达增加,从而产生NO内源性合成的正反馈效应[21]。另外,本研究还发现NCX-4016抑制RAGE蛋白表达的同时,并未增加血清sRAGE水平,说明NO供体药物和外源性NO通过直接抑制RAGE的转录而非其他转录后调控机制(RNA剪接)发挥抗炎作用。此外本研究发现与抑制eNOS相比,直接抑制PKG信号通路,将会导致IL-1β的表达更加明显增加,且二者差异有统计学意义(P<0.05),说明抑制PKG信号通路将会更明显地抑制NCX-4016的抗炎保护作用。可能原因为NCX-4016作为NO供体,增加了外源性NO的补充,从而部分抵消了eNOS抑制所导致的NO生成不足,而PKG抑制剂则直接抑制了NO的下游信号途径,导致NO失能,因此更加彻底地消除了NO的抗炎效应。
综上所述,本研究发现了NCX-4016可以作为NO供体药物在2型糖尿病动脉粥样硬化模型小鼠中发挥动脉粥样硬化保护作用。外源性NO分子可以作为上游信号分子,以cGMP/PKG依赖的途径负调控RAGE的转录和表达,同时抑制RAGE下游对于eNOS表达的负性作用,形成内源性NO分子的正反馈环路,最终发挥抗炎抗动脉粥样硬化作用。该研究进一步明确了NO在抗炎和抗动脉粥样硬化中的重要作用,说明了NO可以依赖于cGMP/PKG途径同时发挥舒血管作用与抗炎作用,在糖尿病动脉粥样硬化模型中抑制血管壁RAGE的表达发挥保护作用,为RAGE作为靶点的抗动脉粥样硬化治疗提供了理论基础。
