外周血IL-6可能通过促进滤泡辅助性T细胞的分化参与1型糖尿病的发生
2022-08-06牛腾耀崔振华岳晓琪詹静慧张艳丽
牛腾耀,崔振华,高 强,岳晓琪,詹静慧,张艳丽
宁夏医科大学基础医学院病原生物学与免疫学系,宁夏银川 750004
1型糖尿病(T1DM)是由T细胞介导的胰岛β细胞破坏引起的自身免疫性疾病,严重威胁人体健康。T1DM患者因自身免疫及胰岛β细胞被损伤,引起胰岛素分泌不足,必须长期采用胰岛素进行治疗,而我国T1DM的发病率为1.01/10 000[1]。定位于淋巴滤泡的滤泡辅助性T(Tfh)细胞是发挥免疫效应的CD4+T细胞亚群,是一种辅助B细胞[2]。研究表明,CD4+CXCR5+ICOS+PD1+T细胞是与淋巴滤泡中的Tfh细胞功能对应的细胞群体,可分泌白细胞介素(IL)-21,并促使B细胞增殖分化,使体液免疫增强[3-4]。众所周知IL-6是趋化因子家族成员之一,主要由单核巨噬细胞、血管内皮细胞等生成,其作用靶细胞较多,是一种具有复杂生理功能的细胞因子,与感染性疾病有关,可促进B细胞的增殖分化。IL-21是Tfh细胞活化后分泌的特征性细胞因子,主要存在于生发中的B细胞卵泡中,可以调节B细胞的活性[5]。但IL-6能否作用于Tfh细胞参与自身免疫性疾病的发生尚不清楚,本研究通过分析T1DM患者外周血中CD4+CXCR5+ICOS+PD1+T细胞占CD4+T细胞百分比与IL-6、IL-21之间的相互关系,尝试为T1DM的发病机制与诊断提供新思路。
1 资料与方法
1.1一般资料 选择2019年10月至2020年10月在宁夏医科大学总医院(以下简称“本院”)内分泌科住院的30例T1DM患者为研究组。所有患者均符合1999年世界卫生组织(WHO)制定的T1DM诊断标准,以无任何自身免疫性疾病、C肽释放正常为排除标准。选择同期在本院体检的20例健康者作为健康对照组,均无感染性疾病、自身免疫性疾病及糖尿病。所有研究对象均签署知情同意书,本研究经过本院医学伦理委员会批准。
1.2仪器与试剂 FC酶标仪购自美国Thermo公司,Accuri C6流式细胞仪购自美国BD公司。使用的主要试剂盒包括Anti-human Percpcy5.5-CD4试剂盒(美国,Biolegend)、Anti-human AF488-CXCR5试剂盒(美国,BD)、Human-IL-6 酶联免疫吸附试验(ELISA)试剂盒(上海,江莱生物技术有限公司)、Human-IL-21 ELISA试剂盒(上海,江莱生物技术有限公司)。
1.3方法
1.3.1T1DM患者外周血淋巴细胞分离及处理 抽取所有研究对象外周血3 mL,乙二胺四乙酸(EDTA)抗凝,磷酸盐缓冲液(PBS)与全血按照1∶1比例稀释,采用密度梯度离心法分离周围淋巴细胞,PBS洗涤,调整细胞数后采用流式细胞术检测CD4+CXCR5+ICOS+PD1+T细胞占CD4+T细胞百分比。
1.3.2流式细胞术检测人CD4+CXCR5+ICOS+PD1+T细胞占CD4+T细胞百分比 取细胞悬液100 μL于试管中,依次加入抗体Anti-human Percpcy5.5-CD4、Anti-human AF488-CXCR5,4 ℃、振荡、避光、孵育30 min,洗涤,以300 μL冷PBS重悬,于流式细胞仪上进行检测。所得数据用配套软件进行分析,在FSC-SSC图上选定淋巴细胞群,然后以CD4和SSC设门分析CD4+CXCR5+ICOS+PD1+T细胞占CD4+T细胞百分比。
1.3.3T1DM患者血清中IL-6、IL-21水平检测 采用ELISA法检测血清中IL-6、IL-21水平,严格按照Human-IL-6 ELISA试剂盒和Human-IL-21 ELISA试剂盒中的说明书操作。
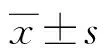
2 结 果
2.1两组外周血CD4+CXCR5+ICOS+PD1+T细胞占CD4+T细胞百分比比较 研究组、健康对照组中CD4+CXCR5+ICOS+PD1+T细胞占CD4+T细胞百分比分别为(23.8±0.68)%、(14.1±0.46)%,研究组明显高于健康对照组,差异有统计学意义(P<0.05)。
2.2两组外周血IL-6、IL-21水平比较 研究组、健康对照组IL-6水平分别为(34.45±8.31)、(23.46±5.52)ng/L;研究组、健康对照组IL-21水平分别为(202.0±46.51)、(102.9±32.78)ng/L。研究组IL-6、IL-21水平均明显高于健康对照组,差异有统计学意义(P<0.05)。
2.3T1DM患者CD4+CXCR5+ICOS+PD1+T细胞占CD4+T细胞百分比与血清IL-6、IL-21水平的相关性 采用Pearson相关分析发现,T1DM患者CD4+CXCR5+ICOS+PD1+T细胞占CD4+T细胞百分比与外周血血清IL-6、IL-21水平均呈正相关(r=0.449 2、0.572 9,P<0.05),见图1。

注:A为IL-21与CD4+CXCR5+ICOS+PD1+T细胞占CD4+T细胞百分比相关分析;B为IL-6与CD4+CXCR5+ICOS+PD1+T细胞占CD4+T细胞百分比相关分析。图1 T1DM 患者血清IL-6、IL-21与CD4+CXCR5+ICOS+PD1+T细胞占CD4+T细胞百分比的相关分析
3 讨 论
T1DM是一种由遗传易感性和环境危险因素相互作用导致胰岛β细胞被破坏,进而造成胰岛素分泌不足的自身免疫性疾病[6]。Tfh细胞是位于次级淋巴组织(SLOs)生发中心的可辅助B细胞产生抗体的CD4+T细胞,其特征性膜表面分子主要有程序性细胞死亡蛋白(PD-1)、趋化性细胞因子受体(CXCR5)、诱导共刺激分子(ICOS)等,具有辅助B细胞的功能,可参与生发中心的形成及B细胞发育、活化增殖与功能调节,也可为高亲和力抗体的产生提供帮助,是机体适应性免疫的重要组成部分,同时参与多种自身免疫性疾病的发病[7-10]。
在自身抗体产生的过程中,生发中心中的Tfh细胞识别B细胞或B细胞所呈递的抗原,通过CD40L、ICOS和OX40等共刺激,分子与细胞间产生稳定的相互作用,在这种相互作用中,Tfh细胞与B细胞互相依赖,并分泌IL-21、IL-4、IL-9和IL-10等效应细胞因子,它们可促进生发中心反应并可促使B细胞分化为浆细胞和记忆细胞[11]。
IL-6主要由单核巨噬细胞、血管内皮细胞等生成,其作用靶细胞较多,是一种具有复杂生理功能的细胞因子。IL-6参与了多种生物学过程,如免疫应答、炎性反应,同时,低水平IL-6可促进胰岛素的分泌,高水平IL-6则可抑制胰岛素分泌,但年龄、种族、病程则对血清IL-6水平无影响[12-14]。IL-21是Tfh 细胞活化后分泌的特征性细胞因子,可诱导 Tfh 细胞分化,促进生发中心的B细胞分化为浆细胞,并产生不同类型的抗体。
在本研究中,研究组CD4+CXCR5+ICOS+PD1+T细胞占CD4+T细胞百分比、IL-6水平明显高于健康对照组,且CD4+CXCR5+ICOS+PD1+T细胞与IL-6水平呈正相关。IL-6有两条信号通路传导途径,一条为IL-6与其受体膜蛋白结合,即与IL-6Rα相结合形成一种复合物;另一条则是IL-6与gp130膜蛋白相结合,使体内对IL-6有反应的细胞数量增加[15]。IL-21通过与生发中心B细胞表面或Tfh细胞自身表达的IL-21受体结合,促进浆细胞分化产生大量抗体,诱导Tfh细胞表达CXCR5并迁移至生发中心,维持T-B细胞动态平衡[16]。血清中IL-4、IL-9与人体的免疫反应具有一定的关系。IL-10也称为细胞因子合成抑制因子(CSIF),是一种多效性细胞因子,可以在多种类型细胞中发挥免疫抑制或免疫刺激的作用[17]。结合本研究可推测,T1DM自身免疫的发生原因为体内IL-6大量增多,促使CD4+CXCR5+ICOS+PD1+T细胞的过量分化,并分泌IL-21,IL-21与CD4+CXCR5+ICOS+PD1+T细胞自身表达受体结合,辅助作用于B细胞的分化;同时,IL-4、IL-9、IL-10的分泌也会增多,其促进生发中心反应并促使B细胞分化为浆细胞和记忆细胞,浆细胞分泌蛋白酪氨酸磷酸酶抗体、谷氨酸脱羧酶抗体、胰岛细胞自身抗体、抗胰岛β细胞抗体等多种自身抗体,损伤胰岛细胞,造成胰岛素分泌不足,进而导致T1DM的发生。
综上所述,IL-6可能促进Tfh细胞的活化并分泌IL-21进而辅助B细胞产生自身抗体参与T1DM的发生。但研究样本量较小,还需进一步扩大临床样本量,并结合动物模型进行更深入的机制研究。
