虎杖解毒颗粒(无糖型)的药效毒理学研究
2022-08-05白雨鑫童荣生李晋齐陈韵蓓
白雨鑫,童荣生,李晋齐,陈韵蓓
0 引言
虎杖解毒颗粒是四川省人民医院的医院制剂,已在临床应用30余年,清热、解毒疗效显著,广受患者好评,但其制剂辅料含大量蔗糖,易吸潮,不宜用于老年、糖尿病等禁糖患者,临床应用局限。虎杖解毒颗粒(无糖型)系在不改变原虎杖解毒颗粒方中药味、药量的基础上,将蔗糖替换为乳糖、甜菊素而制得的无糖剂型。本课题组前期已对虎杖解毒颗粒(无糖型)的成型工艺、质量标准等进行研究[1]。根据《药品注册管理办法》要求,临床前的药理、毒理研究结果是综合判断药物能否进入临床研究的重要依据之一。因此,本文对虎杖解毒颗粒(无糖型)、虎杖解毒颗粒的急性毒性和解热、抗炎情况展开研究,初步对比评价改制前后颗粒的有效性和安全性,为剂型改进的科学性、合理性提供依据。
1 实验材料
1.1 药物与试剂 虎杖解毒颗粒(无糖型)规格10 g/袋,相当于2.67 g生药/g颗粒,成人3次/d,1袋/次,成人按标准体重60 kg计算,即成人1.335 g生药/(kg·d);虎杖解毒颗粒规格10 g/袋,相当于2.67 g生药/g颗粒,成人3次/d,1袋/次,即成人 1.335 g生药/(kg·d);布洛芬片(安徽云鹏制药有限公司,批号:201420122,规格1 g,成人2 g/d);醋酸地塞米松片(安徽金太阳生化药业有限公司,批号:130722,规格0.75 mg,成人2~4次/d,0.75~3.00 mg/次);干酵母(英国OXIOD公司,批号:LP0021);二甲苯(成都市科龙化工试剂厂,批号:20120721)。
1.2 动物 昆明种(KM)小鼠160只,体重 18~22 g (其中雄鼠120只,雌鼠40只);SD雄性大鼠90只,体重 180~220 g,均由四川省医学科学院提供,动物合格证号:SCXK(川)2013-15。所有动物实验前于四川省医学科学院实验动物中心适应性观察1周后使用。饲养环境:四川省医学科学院实验动物中心,湿度30%~50%,温度22~23 ℃。饲养方法:按组分笼饲养,雌雄分开,每笼5只,自由进食、进水。
1.3 实验仪器 欧姆龙 MC-142L型电子体温计(欧姆龙大连有限公司);BP211D型十万分之一电子分析天平(德国Sartorius公司);鼠耳打孔器(上海玉研科学仪器有限公司)。
2 方法及结果
2.1 配置最大给药浓度的药液 称取50 g颗粒,按梯度少量多次地加入蒸馏水,不断搅拌,待颗粒溶解后,用灌胃针头吸取药液,以药液能通过灌胃针管为临界点,此时药液浓度为实验的最大给药浓度。上法确定虎杖解毒颗粒(无糖型)和虎杖解毒颗粒的最大给药浓度分别为2.43 g生药/ml、2.225 g生药/ml。
2.2 急性毒性实验(最大给药量实验)[2]
2.2.1 半数致死量预实验及结果 选取昆明种小鼠20只,雌雄各半。试验前小鼠禁食不禁水12 h,按体重随机分为虎杖组和虎杖(无糖)组,分别灌服虎杖解毒颗粒和虎杖解毒颗粒(无糖型),以最大给药浓度和小鼠灌胃可承受的最大体积(40 ml/kg)进行灌胃,3次/d,每次间隔8 h,给药后自由进食和饮水,连续观察 7 d。结果小鼠无一死亡,未出现毒性反应,提示药品安全范围大,需进行小鼠的最大给药量实验。
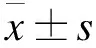
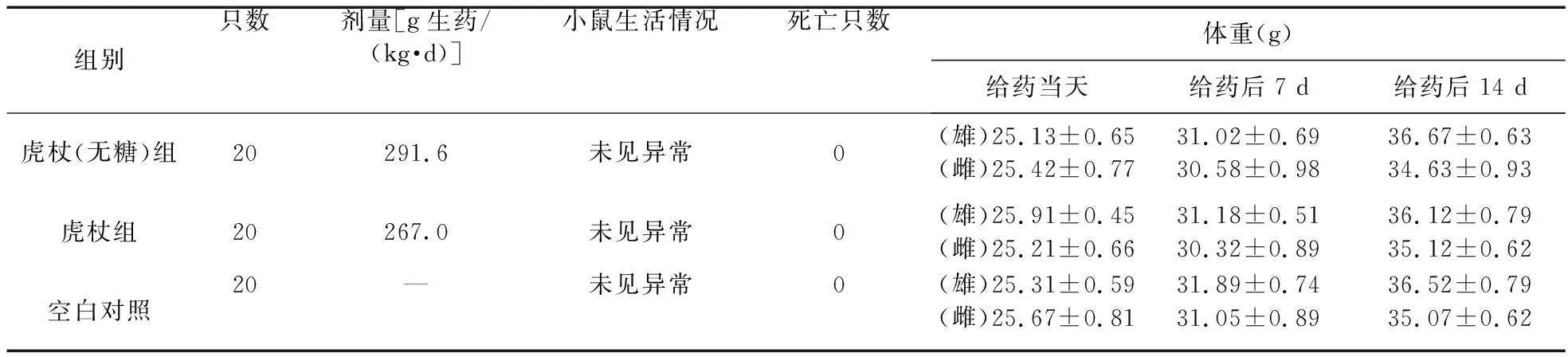
表1 药物最大给药量实验的测定结果
2.3 抗炎药效-对二甲苯所致小鼠耳肿胀模型的影响实验[3-4]
2.3.1 实验方法 取体重18~22 g雄性昆明种小鼠80只,随机分为模型组,地塞米松组,虎杖高、中、低剂量组,虎杖(无糖)高、中、低剂量组,每组10只。配制浓度为0.1 mg/ml的地塞米松药液。根据“动物与人体的每公斤体重剂量折算系数表”,人∶小鼠=1∶9.01换算,计算出小鼠用药剂量的临床治疗等效剂量为12.03 g生药/(kg·d),设定高、中、低3个剂量组小鼠给药剂量分别为26.7 g生药/kg、13.4 g生药/kg、6.6 g生药/kg,相当于人临床推荐每日用量的20倍、10倍、5倍。配制虎杖组和虎杖(无糖)组的高剂量(1.335 g生药/ml)、中剂量(0.67 g生药/ml)、低剂量(0.33 g生药/ml)药液。
各组小鼠均按20 ml/kg体积灌胃给药,1次/d,连续灌服给药4 d,模型组灌服等量的蒸馏水。第4天,给药后60 min,用移液枪吸取10 μl二甲苯涂于各组小鼠右耳的内外两面,左耳不涂作为对照。30 min后颈椎脱臼法处死小鼠,分别剪下左、右耳片,对齐,用直径9 mm的打孔器在耳片上固定位置打孔,得面积相同的耳圆片,迅速用电子天平称量。
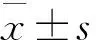
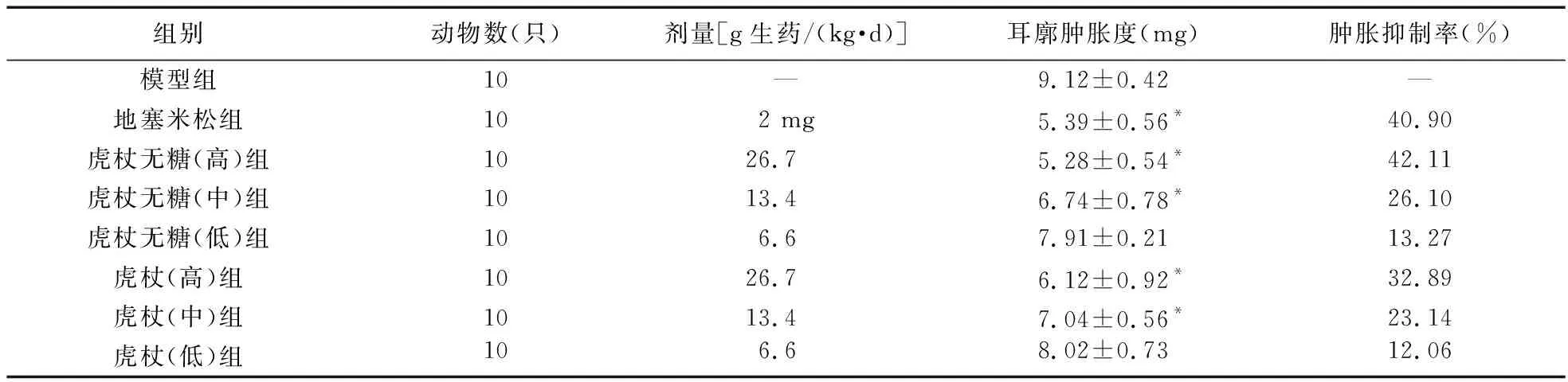
表2 药物对二甲苯所致小鼠耳肿胀模型的影响
由表2可知,与模型组相比,地塞米松组、虎杖(高、中)组、虎杖无糖(高、中)组的肿胀度差异显著(P<0.05),对炎症抑制作用强;虎杖(低)组、虎杖无糖(低)组的肿胀度较空白对照组差异无统计学意义(P>0.05),对炎症抑制作用不明显。同时,虎杖(无糖)组和虎杖组在所试剂量范围内,对二甲苯所致小鼠耳肿胀均有抑制作用,且抑制程度相近。
2.4 解热药效-对干酵母所致大鼠发热模型的影响实验[6]
2.4.1 实验方法 取体重180~220 g雄性SD大鼠80只,随机分为空白组、模型组、布洛芬组,虎杖高、中、低剂量组,虎杖(无糖)高、中、低剂量组,每组10只。配制浓度为0.016 7 mg/ml的布洛芬混悬药液[7]。
根据“动物与人体的每公斤体重剂量折算系数表”,人∶大鼠=1∶6.25换算,计算出大鼠用药剂量的临床治疗等效剂量为8.34 g生药/(kg·d),设定高、中、低3个剂量组大鼠给药剂量分别为26.7 g生药/kg、13.4g生药/kg、6.6 g生药/kg,相当于人临床推荐每日用量的20倍、10倍、5倍。虎杖(无糖)、虎杖组的高剂量(1.335 g生药/ml)、中剂量(0.67 g生药/ml)、低剂量(0.33 g生药/ml)药液以及10%的干酵母混悬液[8]。
实验前6 h禁食不禁水,将受试大鼠的3次体温平均值作为基础体温,各组大鼠均按20 ml/kg体积灌胃给药,1次/d,连续灌服给药3 d,模型组灌服等量的蒸馏水。第3天给药后,立即在大鼠背部皮下注射10%干酵母混悬液10 ml/kg致热,在致热后1、2、4、6、8、12 h后,分别测量并记录各组大鼠体温[9]。
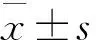
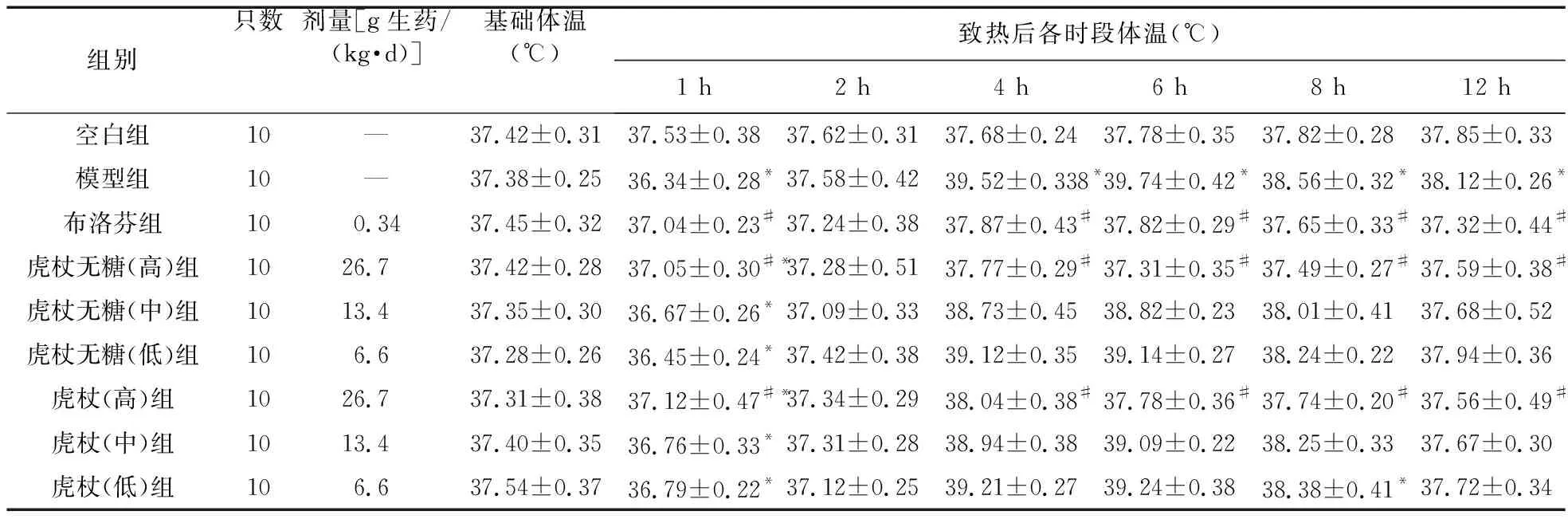
表3 药物对干酵母所致大鼠发热模型的影响
由表3、图1可知,与空白组比较,模型组在致热后1 h有明显降温,之后模型组升温明显(P<0.05),说明造模成功。与模型组比较,在致热后的4、6、8 h,布洛芬组、虎杖(高)、虎杖无糖(高)组对干酵母致大鼠发热模型的解热作用较明显,差异具有统计学意义(P<0.05);与模型组比较,虎杖(中、低)、虎杖无糖(中、低)组在致热后的各时段,解热作用不明显,差异无统计学意义(P>0.05)。致热12 h后,模型组升温效果减弱,与各组差异减小。
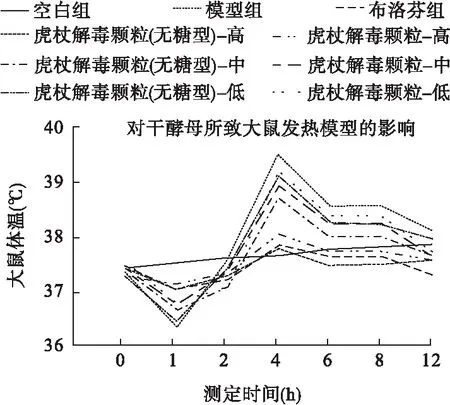
图1 药物对干酵母所致大鼠发热模型的影响
结果表明,口服虎杖解毒颗粒(无糖型)、虎杖解毒颗粒对干酵母致热大鼠具有解热作用,其中高剂量的解热效果最好,中、低剂量的效果不明显。同时,两组实验颗粒各浓度的解热程度相近,说明制剂改制后,其解热疗效未受明显影响。
3 讨论
本实验为明确虎杖解毒颗粒(无糖型)、虎杖解毒颗粒的复方毒性,对制剂灌胃给药小鼠的急性毒性进行了研究,结果均未能测出其LD50,表明药品的毒性很小,进行最大给药量实验。已知按体重和日服生药量计算,若小鼠的最大给药量相当于临床成人日剂量的100倍以上,则说明药品较安全,可以提供临床应用[10]。在本文最大给药量实验中,颗粒用量分别相当于成人日剂量的218倍和200倍,结果小鼠无一死亡,生存状况无异常,提示药品毒性低,临床使用安全。
在抗炎药效研究实验中,选用地塞米松作为阳性对照药,以二甲苯为致炎剂,建立持久稳定且操作简便的小鼠耳肿胀模型,来验证药物的抗炎作用。该模型的作用机制是二甲苯可作用于血管,使毛细血管扩张,通透性增加,引起组织液大量渗出,局部红肿[11]。中药创新药物研发中,常以二甲苯诱发小鼠耳壳急性肿胀,模拟机体急性炎症的病理状态,以评价药物抗炎作用[12]。本研究结果表明,虎杖解毒颗粒(无糖型)、虎杖解毒颗粒对二甲苯所致小鼠耳廓肿胀均有一定的抑制作用,且较模型组差异明显,肿胀抑制作用明显,为药品的抗炎作用提供了理论支持。
在解热药效研究实验中,选用布洛芬作为阳性对照药,以干酵母为致热剂,建立大鼠发热模型,实验要求低且成功率高,其中干酵母的致热成分是全菌体及菌体内所含的荚膜多糖和蛋白质。干酵母所致的发热是由于注射部位的局部溃烂引发的剧烈炎症反应,是最常用的大鼠发热模型[13]。已知皮下注射干酵母混悬液,注射初期体温下降,2~3 h开始升温,6~7 h达峰值,升温持续20 h,本实验造模成功。结果表明,虎杖解毒颗粒(无糖型)、虎杖解毒颗粒均可缓解干酵母引起的大鼠发热反应,其中高剂量组[26.7 g生药/(kg·d)]在大鼠致热后4~8 h有明显的降温作用,且降温幅度相近。
本实验研究证明,虎杖解毒颗粒(无糖型)、虎杖解毒颗粒毒性均较低,具备一定解热、抗炎作用。同时,制剂改制前后急性毒性及药效强度未发生明显改变,结合课题组前期实验证明改制前后制剂质量标准、指纹图谱共有模式基本一致,证明了更改辅料对本制剂处方中的化学成分、物质基础基本没有影响。
本研究通过大量实验结果表明,虎杖解毒颗粒(无糖型)的工艺稳定、质量可控、安全有效,为该制剂研发的科学性、合理性提供了依据。
