以多巴胺为载体采用化学键合的方式共递送甲氨蝶呤及地塞米松
2022-08-05张志华罗芳梅王方杰郭丽娜
王 婷,张志华,罗芳梅,王方杰,刘 淼,郭丽娜
0 引言
类风湿性关节炎(Rheumatoid arthritis,RA)是以关节滑膜炎和关节外病变为主要临床表现的慢性、进行性、自身免疫性疾病,全球平均发病率约为1%,我国约为0.3%~0.4%,首选治疗方法是药物治疗[1]。临床研究表明,将甲氨蝶呤(Methotrexate,MTX)与糖皮质激素联用可更好地控制RA的进程,缓解炎症相关症状[2-3]。临床中已将MTX与糖皮质激素短期联用作为RA的一线疗法[4]。但MTX和Dex的体内分布的选择性差,非特异性分布可导致骨髓抑制、胃肠道功能失调、肝肾损伤等不良反应,且长期高剂量使用不良反应加重[1,5]。RA作为一种慢性疾病需长期给药,药物不良反应的风险增加。因此,构建新型的递药系统成为一个重要的研究方向。在RA过程中,快速增殖的滑膜组织需要大量养分,因此会产生大量的新生血管;同时,在炎性环境的刺激下,血管内皮相互牵拉,在血管内皮间会形成约700 nm宽的缝隙[6]。因此,纳米制剂可利用类似肿瘤组织中的EPR效应,被动靶向至炎性关节处,减少非靶部位的药物浓度。目前已有许多关于RA纳米递药系统的研究[7-11],但仅可包载单一药物,难以实现药物的共递送,尚无共递送MTX和糖皮质激素用于治疗RA的相关报道。
多巴胺(Dopamine,DA)是一种神经递质,其可在碱性条件下发生氧化自聚,形成聚多巴胺(Polydopamine,PDA),且易进行表面修饰,具有良好的生物相容性和生物可降解性,其可被谷胱甘肽还原酶还原,实现谷胱甘肽还原酶响应的药物释放[12-13],可作为一种良好的药物载体。PDA不仅能保护组织免受自由基的损伤,而且增强了中性粒细胞改善急性炎症的能力[14]。RA的病变部位是一个慢性炎症的微环境,采用PDA作为药物载体实现载药的同时,也对炎症部位的自由基进行清除,缓解RA的炎症微环境,辅助一线药物治疗。与物理包裹相比,采用化学键合的方式载药通常具有较高的载药量,且可防止药物的提前释放[15]。已有大量研究将聚合物与药物键合后通过自组装的方式制得了高载药量的纳米粒[16]。因此,本研究选择PDA作为纳米药物递送系统的载体,制备MTX/Dex@PDA NPs,研究结果将为药物的共递送提供新思路,课题组后期可在其表面修饰唾液酸(Sialicacid,SA)[17]、叶酸(Folic acid,FA)[7-9]等靶向配体,实现药物主动靶向递送至病灶部位。
1 材料与仪器
1.1 主要材料 MTX(上海源叶生物科技有限公司,纯度98%),Dex(上海源叶生物科技有限公司),丁二酸酐(SA,上海阿拉丁生化科技股份有限公司),多巴胺盐酸盐(DA·HCl,上海毕得医药科技有限公司),二甲亚砜(DMSO),氨水,碳二亚胺盐酸盐(EDC·HCl),4-二甲氨基吡啶(DMAP),二氯甲烷,甲醇,葡聚糖凝胶LH-20,柱层析硅胶(100~200目,300~400目)。
1.2 主要仪器 LCMS-8060液相色谱质谱仪[岛津仪器(苏州)有限公司],UV-2600紫外可见分光光度计[岛津仪器(苏州)有限公司],AVANCEⅢ 400M核磁共振波谱仪(美国BRUKER公司),CP225D型电子天平(德国Sartorius公司),纳米粒径电位分析仪(马尔文仪器有限公司)。
2 方法与结果
2.1 MTX-DA的合成、纯化及表征
2.1.1 MTX-DA的合成 将60 mg DA·HCl (0.316 mmol)溶于10 ml DMSO中,并加入50 μl氨水,在30 ℃下搅拌2 h,为反应体系1。另将72 mg MTX(0.158 mmol)和60.6 mg EDC·HCl (0.316 mmol)溶于5 ml DMSO中,在30 ℃下搅拌2 h,为反应体系2。在体系2中先后加入19.3 mg DMAP (0.158 mmol)和反应体系1,在30 ℃中搅拌24 h,即得MTX-DA,其合成路线见图1。
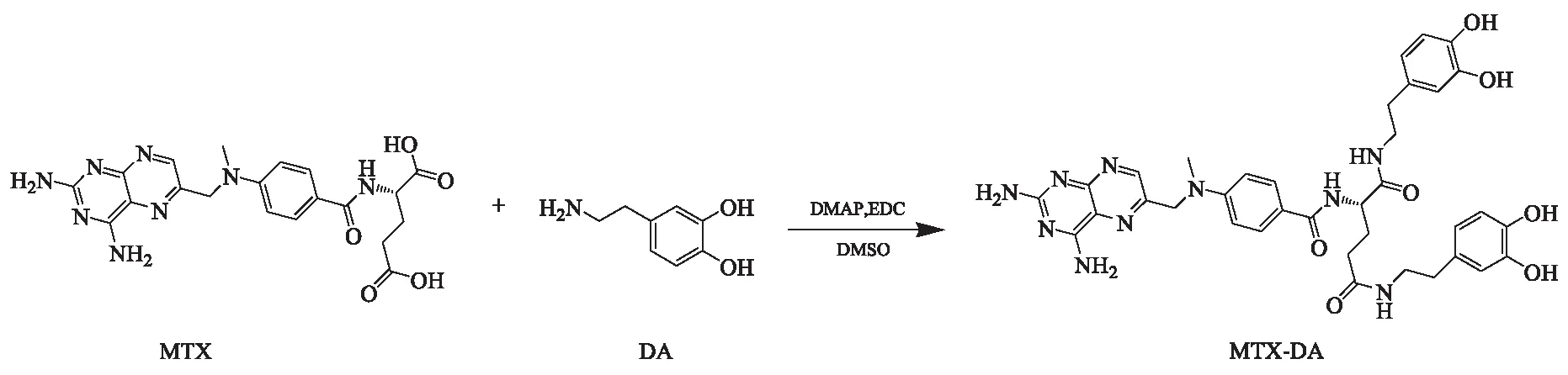
图1 MTX-DA合成路线
2.1.2 MTX-DA的纯化 在15 ml MTX-DA终反应溶液中缓慢加入300 ml二氯甲烷,并不断搅拌,可观察到有黄色沉淀析出。抽滤,收集沉淀。将沉淀用4 ml甲醇复溶,然后将溶液用滤膜过滤。将滤液采取湿法上样,进行葡聚糖凝胶柱层析,以甲醇洗脱,正丁醇醋酸水溶液监测,收集目标洗脱液,并将多余洗脱剂旋转蒸发,得黄色油状液体12.9 mg,产率为11.27%。
2.1.3 MTX-DA的全波长扫描 将MTX、DA与MTX-DA分别用甲醇配成浓度约为5 mg/ml的稀溶液,使用紫外可见分光光度计在200~800 nm区间扫描,得到三者的紫外吸收光谱。MTX-DA、MTX和DA的紫外吸收光谱如图2,DA在300 nm左右有1个小的吸收峰,MTX在250~300 nm左右有2个相近的宽峰,而MTX-DA中出现了MTX和DA的峰形的叠加,初步证明目标产物是MTX和DA的键合物。
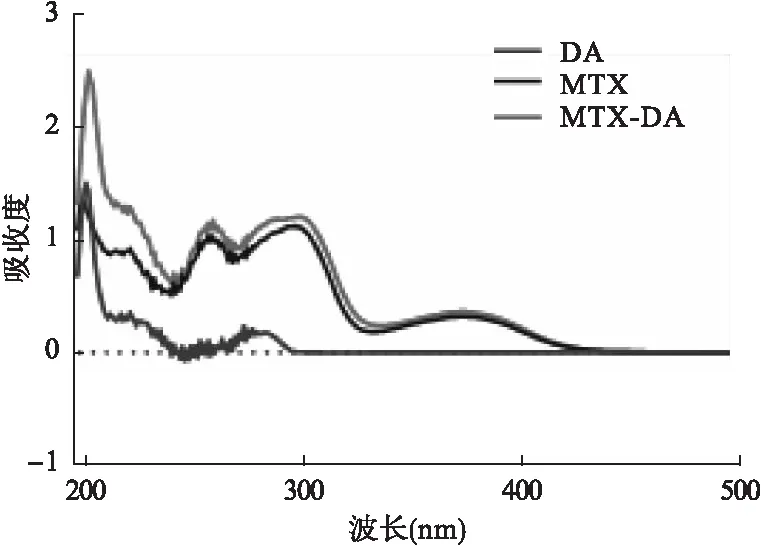
图2 MTX、DA和MTX-DA的紫外扫描光谱图
2.1.4 MTX-DA的1H NMR表征 将MTX用氘代DMSO配成浓度为20~30 mg/ml的稀溶液,将DA与MTX-DA分别用氘代甲醇配成浓度为20~30 mg/ml的稀溶液,使用核磁共振波谱仪测得三者的1H NMR谱图。
将MTX、DA和MTX-DA的1H NMR谱图相叠加得到图3。DA在溶剂氘代甲醇中无法显示出氨基、羟基的活泼氢,但可以看出δ 6.77、6.74、6.61的峰是来源于DA苯环上的3个特征氢。MTX的溶剂是氘代DMSO,在δ 8.78、7.81、6.80出现峰信号,δ 8.78左右是MTX活泼氢的特征峰,推测δ 6.80是MTX苯环的特征信号。而在MTX-DA中δ 8.58处的峰信号能与MTX的特征峰δ 8.78对应;δ 7.80的峰信号与MTX的δ 7.81处对应;MTX-DA中δ 6.90、6.70和6.49是来自MTX与DA苯环上的特征氢。1H NMR谱图也证实MTX与DA成功偶联。
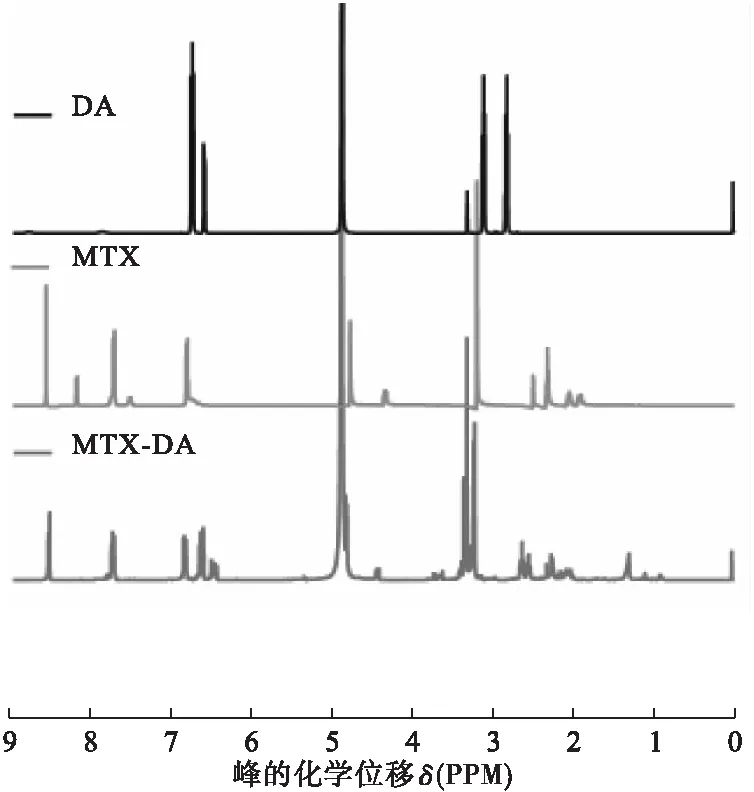
图3 MTX、DA及MTX-DA的1H NMR谱图
2.1.5 MTX-DA的MS表征 将MTX-DA用甲醇配成浓度为50 ppm左右的极稀溶液,利用质谱仪从MS谱图上确认MTX-DA的分子量。MS鉴定(图4)表明,在负离子模式下,其中主峰[M-H]-=723.295 10,与1个MTX和2个DA分子偶联的分子质量M=724.72吻合。根据基团分析,MTX的2个羧基分别与DA的氨基反应合成酰胺键。
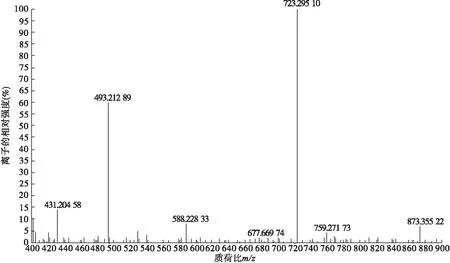
图4 MTX-DA的MS谱图
实验结果说明,MTX与DA成功偶联,反应比例为MTX∶DA=1∶2。按照基团和分子量分析,MTX与DA成功通过酰胺反应键合。
2.2 Dex-SA-DA的合成、纯化及表征
2.2.1 Dex-SA-DA的合成 将100 mg Dex(0.254 mmol)、15.52 mg DMAP(0.127 mmol)和50.84 mg SA(0.508 mmol)溶于5 ml丙酮溶液中。密封,在25 ℃下反应0.5 h。反应完毕后,在50 ℃下旋蒸除去丙酮溶剂。将产物溶解于10 ml无水乙醇中,随后不断加入60 ℃纯化水至产生沉淀。加热回流使沉淀溶解。自然冷却,在4 ℃下过夜自然结晶。在60 ℃下烘干得Dex-SA[18]。本品为白色针状晶体73 mg,产率为58.12%。
将上一步所得的白色针状晶体溶解于3.35 mlDMSO中,加入33.82 mg EDC·HCl (0.176 mmol),在30 ℃下反应2 h。将33.45 mg DA·HCl (0.176 mmol)溶解在4 ml DMSO中,并加入35 μl氨水,在30 ℃下搅拌反应2 h。将2个反应溶液合并,加入17.96 mg DMAP (0.147 mmol),在30 ℃下反应24 h,得Dex-SA-DA,其合成路线见图5。
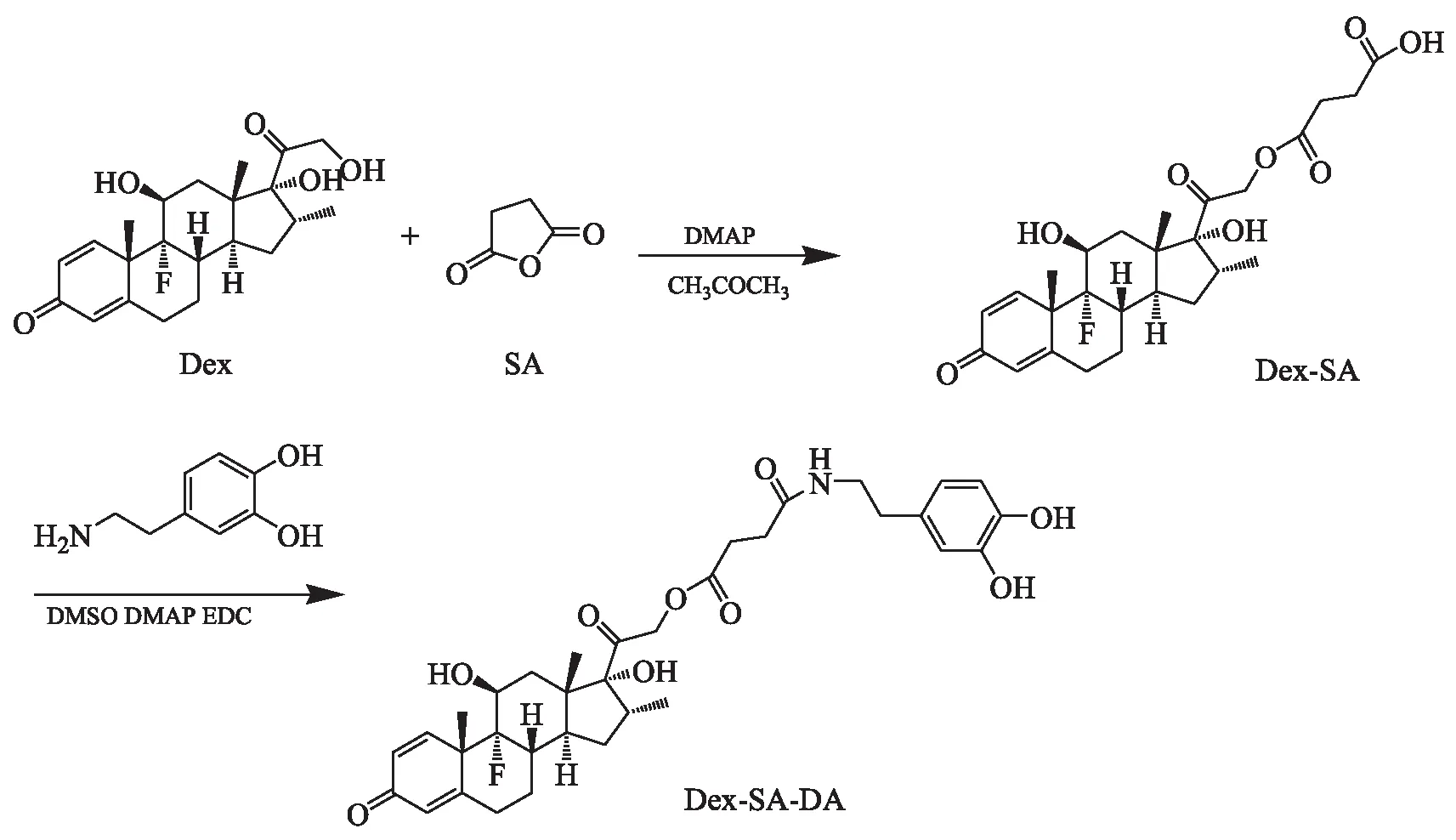
图5 Dex-SA-DA的合成路线
2.2.2 Dex-SA-DA的纯化 在反应液中加入80 ml纯水,用80×3 ml乙酸乙酯萃取3次,用无水硫酸钠干燥有机层,旋转蒸发除去乙酸乙酯,收集浓缩产物。将产物以少量甲醇溶解,100~200目硅胶拌样,以300~400目硅胶装柱,干法上样,以二氯甲烷-甲醇(15∶1)洗脱,二氯甲烷-甲醇(10∶1)作为展开剂监测,收集洗脱液,旋蒸除去洗脱剂,得30 mg无色油状液体,Dex-SA与DA反应产率为32.29%。两步反应终产率为18.74%。
2.2.3 Dex-SA-DA的全波长扫描 将Dex、DA、SA与Dex-SA-DA分别用甲醇配成浓度约为5 mg/ml的稀溶液,使用紫外可见分光光度计在200~800 nm区间扫描,得到各自的紫外吸收光谱。
将Dex-SA-DA、Dex、DA及SA以适量甲醇溶解,在紫外可见分光光度计下扫描得图6,SA在检测波段无明显吸收,Dex在240 nm左右有一宽峰,DA在285 nm左右有一小的吸收峰。Dex-SA-DA中出现了Dex和DA的峰形的叠加,Dex与DA二者之间没有能够相互反应的基团,初步判定Dex先和SA通过酯键键合为Dex-SA,Dex-SA和DA通过酰胺反应键合。
2.2.4 Dex-SA-DA的1H NMR表征 将Dex、DA、Dex-SA分别用氘代甲醇配成浓度约为20~30 mg/ml的稀溶液,将Dex-SA-DA用氘代DMSO配成浓度在20~30 mg/ml的稀溶液,使用核磁共振波谱仪测得各自的1H NMR谱图。
将DA、Dex、Dex-SA与Dex-SA-DA的1H NMR谱图重叠得图7,Dex的谱图中δ 7.43的d峰,6.31的dd峰和6.10的s峰,是来自2个双键上的特征氢。Dex-SA的谱图中,δ 7.45、6.31和6.10处的峰与Dex的特征峰对应,所以Dex-SA中Dex的结构依然存在。由于氘代甲醇无法显示活泼氢,所以无法确认SA的羧基。Dex-SA-DA中,溶剂氘代DMSO可显示出活泼氢,δ 8.74、8.67、7.96处的氢来自氨基或者羟基,δ 7.96、7.32、6.63处对应于Dex双键上的特征峰;此外,δ 6.43的d峰、6.23的d峰和6.01的s峰是来自DA苯环上的3个特征氢,表明Dex-SA-DA中Dex和DA存在。
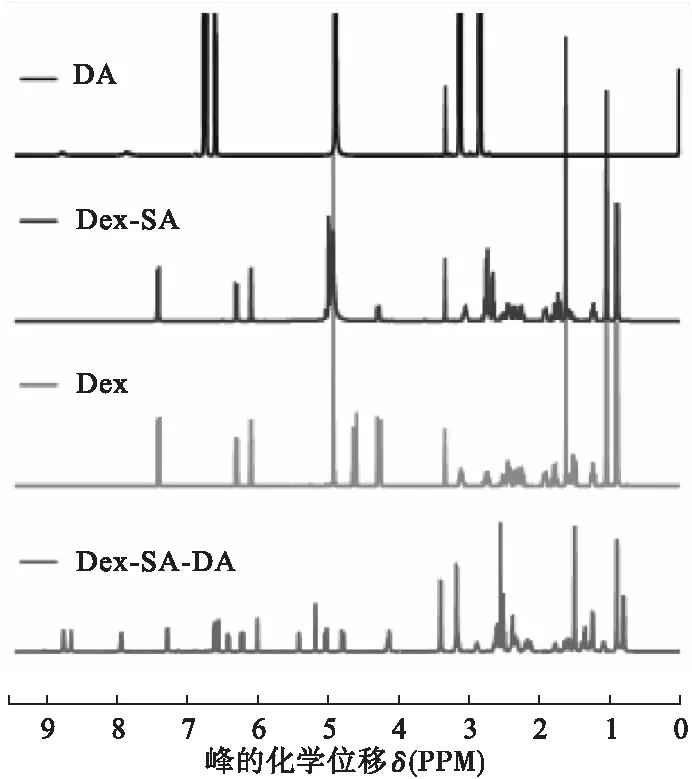
图7 DA、Dex-SA、Dex及Dex-SA-DA的1H NMR谱图
2.2.5 Dex-SA-DA的MS表征 将Dex-SA与Dex-SA-DA用甲醇配成浓度为50 ppm左右的极稀溶液,利用质谱仪从MS谱图上确认两者的分子量。Dex-SA的MS谱图(图8)显示,在正离子模式下,主峰[M+H]+=493.217 99,Dex-SA的分子质量M=492.53,从分子质量上确证,最终确定Dex-SA成功合成。Dex-SA-DA的MS谱图(图9)显示,在正离子模式下,主峰[M+H]+=628.284 85,Dex-SA-DA的分子质量M=627.67,在分子质量上确证。
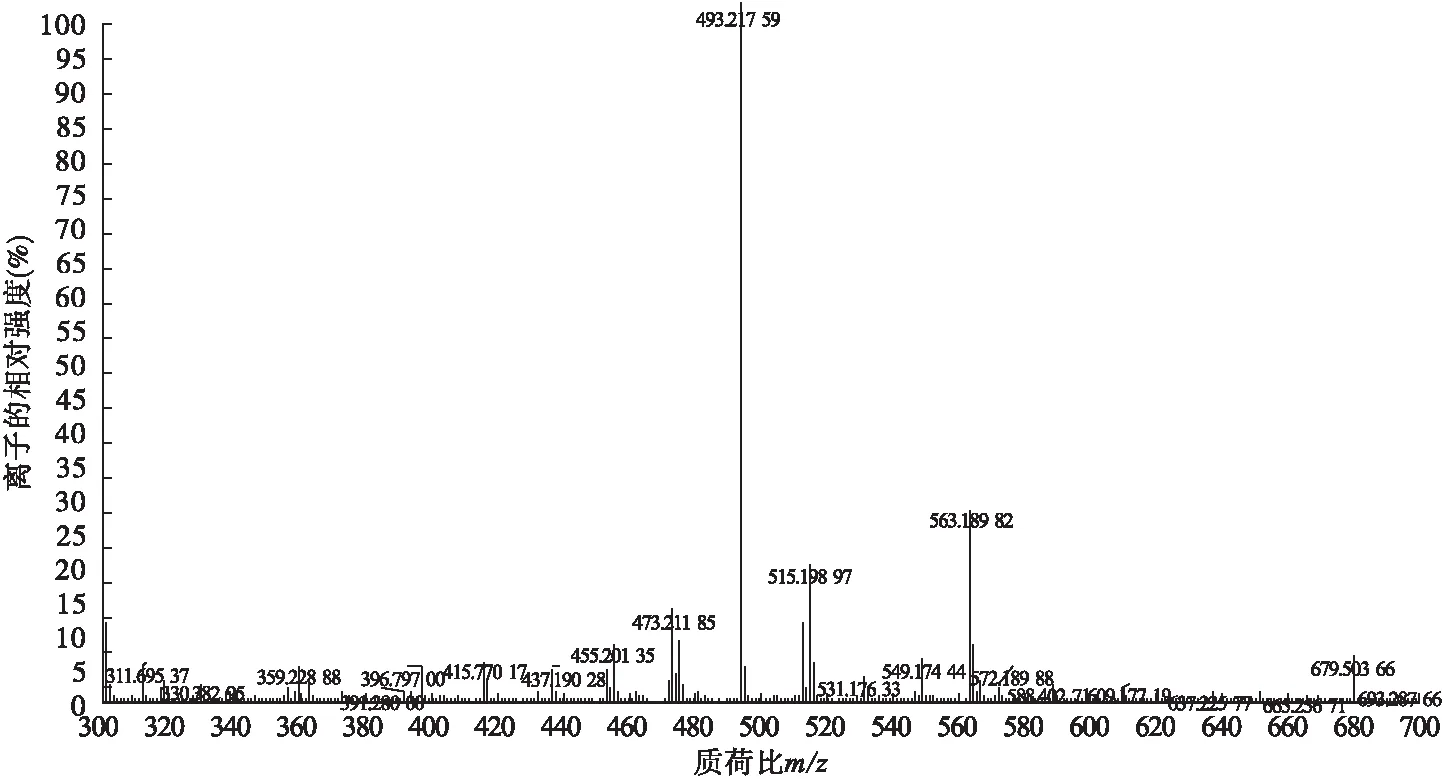
图8 Dex-SA的MS谱图
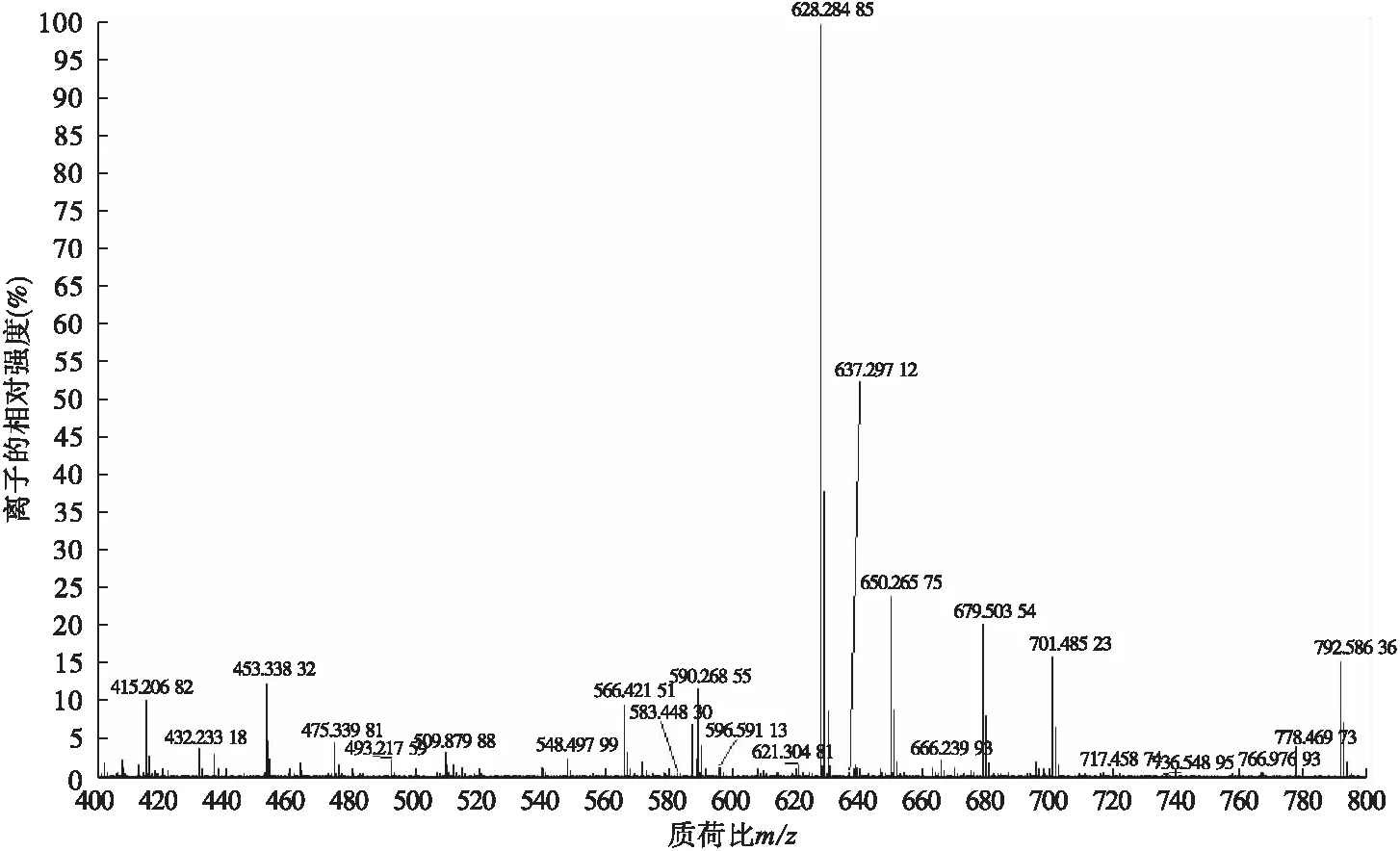
图9 Dex-SA-DA的MS谱图
2.3 MTX/Dex@PDA NPs的制备 将3.2 ml MTX-DA反应液和2.8 ml Dex-SA-DA反应液先后加入25 ml 10 mM的Tris缓冲液与5 ml乙醇的混合溶液中,在30 ℃的温度下搅拌24 h,溶液逐渐变为灰黑色,得到MTX/Dex@PDA NPs。
2.4 MTX/Dex@PDA NPs的放置稳定性 制得MTX/Dex@PDA NPs放置24 h未出现絮积或沉淀,表明制备的纳米粒性质较稳定。
2.5 MTX/Dex@PDA NPs的粒径分布 取制备好的MTX/Dex@PDA NPs溶液,用超纯水稀释至能透光,再取1 ml稀释后的纳米粒溶液注入样品池中,加盖后放入粒径仪中进行粒径、电位的测量。MTX/Dex@PDA NPs平均粒径为(295.8±3.69) nm,电位为(-30.5±0.49) mV,表明纳米粒大小均一,其粒径分布见图10。
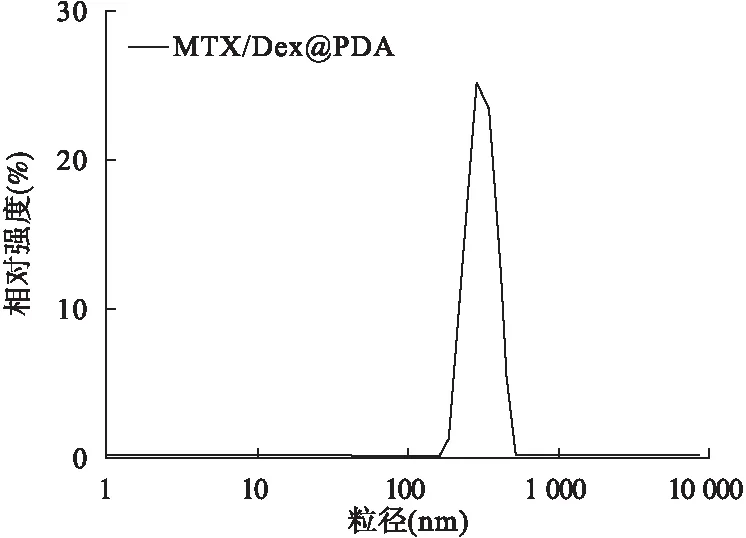
图10 MTX/Dex@PDA NPs的粒径分布
3 讨论
3.1 化学键合载药 考虑到MTX-DA酰胺键较稳定,本研究探索使用容易断裂的其他化学键如亚胺键进行连接,如采用MTX与DA的另一类似物3,4-二羟基苯甲醛(3,4-Dihydroxy benzlaldehyde,DHB)进行席夫碱反应来合成MTX-DHB,但由于席夫碱反应条件苛刻,无水无氧的条件难以控制,采用TLC监测显示未能成功合成MTX-DHB,有待探索MTX与DA类似物的其他化学成键方式。因Dex无法直接与DA成键,本研究选择DA的类似物3,4-二羟基苯丙酸(3,4-dihydroxy benzene propanoic acid,DHPA)与Dex反应,以酯键连接合成Dex-DHPA。但在预实验过程中发现该方案的反应原理与预期并不相符,分离纯化困难。之后改用SA作为桥梁,先合成Dex-SA,再用Dex-SA与DA反应为Dex-SA-DA。经过预实验发现此方案简单易行,且易于纯化,最后本研究采用了此种方案。键合药是否能释放MTX与Dex来发挥靶向治疗作用尚需通过后期体内外相关实验进行验证。
3.2 MTX/Dex@PDA NPs 本研究采用MTX-DA及Dex-SA-DA的反应液初步制备了MTX/Dex@PDA NPs,双载药纳米粒常温下放置24 h 稳定,粒径均一。研究结果表明,DA可通过化学键合的方式作为共递送药物的纳米载体。课题组将对双载药纳米粒制备时的反应时间、反应温度和反应体系等进一步优化,并对其进行进一步的表征,以用于课题组后续制备SA、FA等修饰的多功能靶向纳米递药系统。
4 结论
MTX/Dex@PDA NPs的粒径均一,制备方法简单,可作为药物共递送的新思路,也为构建联合治疗类风湿性关节炎的多功能靶向纳米递药系统提供了实践依据。
