供者HLA 分型信息缺失移植受者DSA 判定2 例并文献复习
2022-08-05黄铭理王於尘严紫嫣方翊灵刘燕娜耿舰邓文锋肖露露徐健苗芸南方医科大学南方医院器官移植科广东广州5055北京大学医学部基础医学院病原生物学系北京009南方医科大学南方医院病理科广东广州5055
黄铭理,王於尘,严紫嫣,方翊灵,刘燕娜,耿舰,邓文锋,肖露露,徐健,苗芸 (.南方医科大学南方医院器官移植科,广东 广州 5055;.北京大学医学部基础医学院病原生物学系,北京 009;.南方医科大学南方医院病理科,广东 广州5055)
近年来,随着我国经济持续发展,人口流动性不断增强,此外,我国器官移植体系逐步规范,部分医院不再具有器官移植资质,造成相当数量的受者在非手术医院进行长期随访的现状。跨地区、跨医疗中心的移植后随访常造成供者人类白细胞抗原(human leucocyte antigen,HLA)分型信息的佚失,对群体反应性抗体(panel reactive antibody,PRA)阳性受者体内供者特异性抗体(donor specific antibody,DSA)的判读造成了不小的困难。本研究通过2 个案例和相关文献复习,为供者HLA 分型信息缺失并可疑抗体介导排斥反应(antibodymediated rejection,AMR)的临床情景提供DSA 判读的方法,以提高临床诊疗的准确性。
1 方 法
1.1 组织消化与DNA 提取:小心剪下1 mm3待测新鲜移植肾组织,加入800 μl 裂解液以及40 μl 蛋白酶K,56℃水浴48 ~ 72 h,直至组织全部溶解。在组织溶解液中加入异丙醇,混匀并离心后取沉淀。使用70%乙醇洗涤2 ~ 3 次,150 μl 洗脱液溶解干燥后的DNA 沉淀。或根据NuClean FFPE DNA Kit(康为世纪,CW2646S)试剂盒说明在石蜡切片中提取DNA。将提取完成的DNA 使用浓度测定仪进行浓度测定,选取浓度在30 ng/μl 以上,纯度(OD260/OD280)为1.7 ~1.9 的标本进行进一步检测。
1.2 HLA 分型:使用NGSgo-AmpX 试剂盒(GenDx)进行HLA-A/B/C/DRB1/DQB1/DPB1 位点基因扩增,然后将扩增子序列汇集后酶切修饰(NGSgo LibrX 试剂盒,GenDx 公司),之后依照NGSgo 说明书将每个样本添加“barcode”信息(NGSgo-Indx 试剂盒,GenDx 公司)。最后将所有样本汇集上机进行illumina MiniSEQ 二代测序。测序所得FASTQ 原始数据利用NGSengine (GenDx)分析后得到HLA 分型结果。
1.3 HLA 抗体测定:使用HLA 特异性抗体检测试剂盒(流式细胞仪-微珠法),试剂盒内的反应微珠按着交叉反应组的规则包被了不同的HLA-Ⅰ类(HLA-A、HLA-B) 和Ⅱ类(HLA-DR、HLA-DQ)重组抗原,将待测血清与包被了特异性抗原的微珠加入到微孔板中,经过30 min 孵育,若血清中存在HLA 抗体则可与微珠上的抗原发生特异性结合反应。利用抽真空方法洗涤除去没有结合的抗体或其他杂质,再加入PE 标记的二抗再次孵育30 min。通过Luminex 平台获取特异性结合微珠的荧光信号。
2 结 果
2.1 病例1:男性,现年48 岁,8 年前因慢性肾脏病5 期于外院接受了1 例车祸捐献者供肾,围术期免疫诱导方案为抗人胸腺细胞免疫球蛋白+甲泼尼龙,术后规律服用他克莫司+吗替麦考酚酯+强的松三联抗排斥反应治疗。2019 年因肺部感染至当地医院就诊,停用抗排斥反应药物2 月余后发现血清肌酐(serum creatinine,Scr)升高,免疫抑制冲击治疗无效并开始规律血液透析,3 次/周。2021 年4 月,患者诊断为“移植肾功能不全尿毒症期”,欲再次肾移植至南方医院就诊;血清尿素氮(serum urea nitrogen,BUN)为37.9 mmol/L,Scr 为1075 μmol/L,尿酸为525 μmol/L;移植肾及移植肾血管彩色多普勒检查显示移植肾体积偏小,实质回声增强;CT 全腹平扫显示移植肾血管硬化伴移植肾小囊肿;复查PRA(+),遂行移植肾切除术。病理结果显示大部分肾小球萎缩、透明变性、纤维化,肾小管周围血管内皮细胞增生致内膜显著增厚,管腔狭窄闭塞,符合局灶节段性肾小球硬化(focal segmental glomerulosclerosis,FSGS)表现(图1),C4d(-)。由于供者HLA 信息缺失,一部分移植肾组织被用于供受者HLA 分型(表1),结合HLA抗体检测结果(表2)拟诊为DSA 介导的C4d(-)AMR。术后继续维持血透治疗,目前患者生存情况良好,等待再次移植中。

图1 病例1 移植肾组织病理镜检结果(HE 染色和C4d 免疫组化)
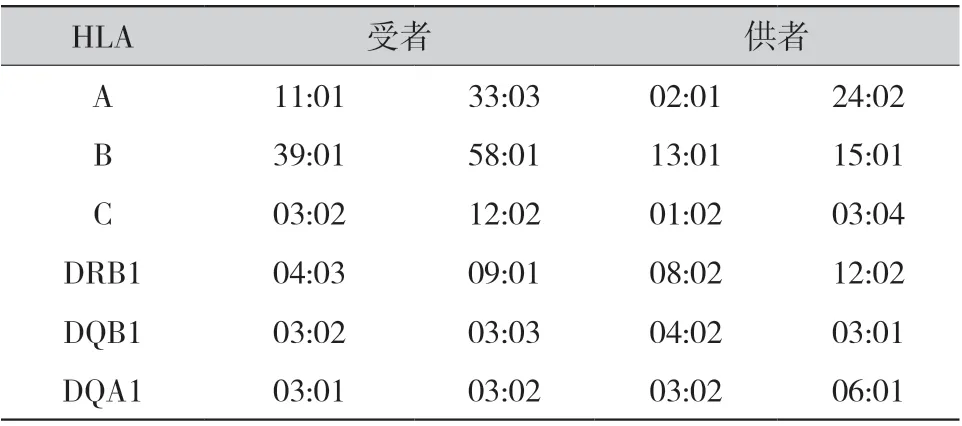
表1 病例1 供受者高分辨HLA 分型结果
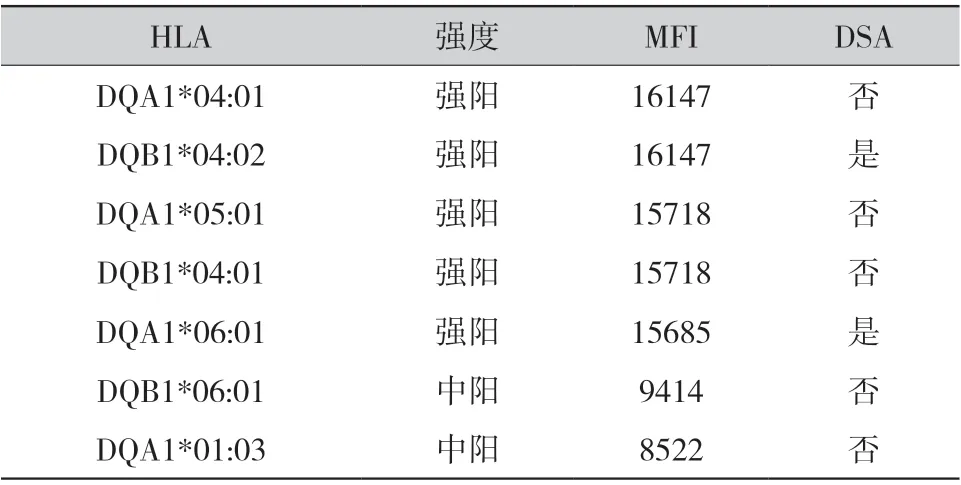
表2 病例1 HLA 抗体检测结果
2.2 病例2:男性,现年54 岁,6 年前因慢性肾脏病5 期于外院接受了1 例脑死亡捐献者供肾。围术期免疫诱导方案为抗人胸腺细胞免疫球蛋白+甲泼尼龙,他克莫司+麦考酚酸+强的松三联抗排斥反应维持治疗。患者术后出现移植肾功能延迟恢复,经血液透析治疗后移植肾功能好转出院,Scr水平维持在130 μmol/L 左右。2020 年1 月患者随诊时尿蛋白(+),予雷公藤多甙治疗,效果欠佳;2021 年5 月复查尿蛋白(+++),Scr 为142 μmol/L,尿酸为429 μmol/L。移植肾及移植肾血管彩色多普勒检查显示移植肾内各级动脉阻力指数轻度升高,结合爬行肌酐和蛋白尿等,符合移植肾穿刺指征。病理活检结果显示移植肾符合非特殊型FSGS 伴中度慢性肾小管-间质损伤,C4d (-)。由于供者HLA 信息缺失,一部分移植肾组织被用于供受者HLA 分型(表3),HLA 抗体检测结果(表4)显示DSA(-)。予甲泼尼龙冲击治疗3 d,复查血肌酐降至125 μmol/L,尿蛋白(+),目前患者生存情况良好。

表3 病例2 供受者高分辨HLA 分型结果
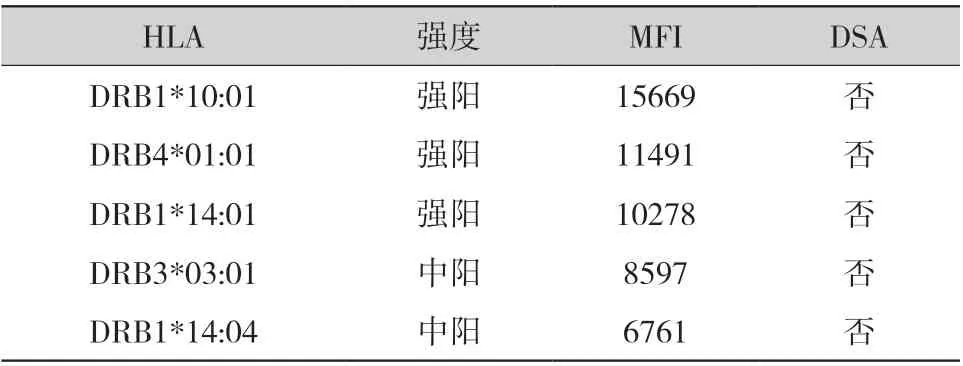
表4 病例2 HLA 抗体检测结果
为验证该技术的可靠性,我们从1 例常染色体隐性多囊肾患者的肾切除组织石蜡切片中提取DNA,并按本研究的方法对其HLA 进行分型,结果与既往传统方法得出的HLA 分型一致。
3 小 结
AMR 是肾移植术后的一种严重并发症[1-3],在1% ~ 10%的肾移植受者中造成近期和长期的移植物损伤[4]。其中,新发DSA 及其持续存在的状态被认为是造成急性或慢性AMR 的关键因素[5]。DSA 可分为HLA 抗体和包括抗ABO、抗次要组织相容性复合物(MiHA)等在内的其他非HLA 抗体,其中HLA 抗体起主导作用[6]。在肾移植领域,HLA 抗体产生的主要原因为供者HLA 与受者不相容。在免疫抑制不足的情况下出现新发DSA,多为HLA-Ⅱ类抗体,包括DR、DP 和DQ 等位点抗体[7]。

图2 病例2 移植肾组织病理镜检结果(HE 染色和C4d 免疫组化)
PRA 可在一定程度上提示潜在或进展中的AMR,但相较于DSA 而言,并不意味着绝对的免疫风险,且肾移植术后PRA 阳性群体中DSA 阳性患者的移植肾功能和长期存活率远远低于DSA阴性的患者[8-9]。本组2 例患者均在随访过程中丢失供者HLA 信息。我院接诊时表现为移植物功能不全、蛋白尿,PRA(+)。病例1、2 移植肾穿刺病理均显示C4d(-)。结合DSA 判读结果可确定病例1 存在DSA 介导的AMR,患者肌酐维持1000 μmol/L 以上并大量蛋白尿,遂予以移植物切除;病例2 虽有阳性的Ⅱ类HLA 抗体,但均不属于DSA,可能由既往输血引起,适当增加免疫抑制后血肌酐显著回落。因此,DSA 的判读在AMR 的诊断、治疗及预后评估中起到不可替代的作用[10-11]。
对于拟接受再次移植的患者来说,DSA 的判读和首次移植HLA 配型相合情况决定了再次移植的供者错配可接受性、再次移植风险评估和术前准备方案[12]。例如,病例1 为HLA-Ⅱ类DSA 阳性受者,当考虑再次移植时,应当首选HLA-Ⅱ类位点相容率高的供者,其中DQ 位点应完全相容;对于HLA-Ⅰ类和Ⅱ类DSA 滴度都较高的患者,术后超急性排斥反应风险较大,根据《再次肾移植技术操作规范(2019 版)》,予以血浆置换、IVIG 应用和利妥昔单抗应用的脱敏预处理[13]。
传统的DSA 检测方法基于细胞学的表现,需使用25 ~ 60 个真实的供者来源淋巴细胞以代表供者的HLA 表型分布,然后加入受者的血清检测补体依赖的细胞毒作用[14]。该方法受制于来自于供者的细胞样本,仅适用于移植前的DSA 检测,且假阳性、假阴性率均较高[15]。此后问世的酶联免疫 吸 附 技 术(enzyme-linked immunosorbent assay,ELISA)[16]和随着流式细胞术的发展而产生的基于固相的Luminex 分析系统[17]可以高敏感、高通量地测定供者体内Ⅰ类、Ⅱ类HLA 抗体,但DSA 的判读仍需结合供者的HLA 分型信息,尚不能完全满足日益增多的供者HLA 分型信息缺失受者的需要。
Liu 等[18]从受者中段尿中分离、培养供者来源细胞,提取DNA 并对供者HLA 基因进行测序与分型。该方法的突出特点为无创与安全,具有很大的应用前景,目前已经实现产学研转化。但由于该方案涉及细胞培养过程,对操作者的实验技术要求较高,耗时较长、较难实现自动化,且费用昂贵,推广仍具有一定难度。
本研究适用于移植肾穿刺组织进行HLA 的鉴定,可利用新鲜组织或石蜡切片,虽为有创操作,但用量仅为1 mm3且无皮髓质的部位要求,对临床症状显著、具有病理活检指征的可疑AMR 移植受者并未增加额外的医疗风险。该方法中的组织消化和DNA 提取流程简便,较尿沉渣[19]而言,抽提DNA 质量更高且稳定,可满足HLA 分型需要,最快96 h 内可报告结果,为临床诊疗争取了更多的时间。虽然该方法无法区分与受者完全相同的供者HLA 分型,但该方法的目的本身就是鉴定不相容的HLA 位点,因此当DNA 含量不足时低分辨HLA 分型也能满足临床需求,而高分辨HLA 分型技术的应用则会大大降低该情况出现的可能[20]。
综上,本文总结了一种在供者HLA 分型信息缺失情况下,利用移植肾活检组织对供者进行HLA 分型从而判定DSA 存在的方法,为跨地域、跨医疗中心就医的移植肾受者随诊工作提供必要的技术支持。对于可疑AMR 患者,应当结合供受者HLA 分型、DSA 判读与病理活检结果,以作出准确的临床诊断,指导患者的精准治疗。
