猪DCD 模型撤除呼吸机后肝脏生理和病理变化
2022-08-05严皓敏潘崎余梓桐程颖中国医科大学附属第一医院器官移植暨肝胆外科辽宁沈阳110001
严皓敏,潘崎,余梓桐,程颖(中国医科大学附属第一医院器官移植暨肝胆外科,辽宁沈阳,110001)
肝移植是目前治疗终末期肝病的唯一有效方法[1-3]。每年都会有许多移植等待名单上的患者由于捐赠资源短缺失去了生命。因此,很有必要充分利用心脏死亡后器官捐献(donation after circulatory death,DCD)来扩大捐赠来源[4-5]。根据器官共享联合网络(United Network for Organ Sharing,UNOS)的数据,美国DCD 捐赠者在所有移植捐赠者中的比例稳步上升,从2008 年的6.29%上升到2018 年的12.14%。肝移植供肝捐赠比例从6.25%上升至8.61%。在英国,2014 年至2015 年度1282 例已故器官捐赠者中有570 例为DCD 捐赠者[6]。与脑死亡后器官捐献(donation after brainstem death,DBD)相比,DCD 来源的器官从心脏停搏到确认死亡通常会经历一段灌注不良的时期,这会给器官带来性更多的缺血损伤,从而极大地影响了器官的活性[7]。与其他器官相比,肝脏通常更容易受到缺血的影响,这也解释了为什么源于DCD 的供肝质量不及其他器官[8-10]。尽管如此,仍有研究表明DCD肝移植仍然可以为患者提供了生存优势[11]。Scalea等[12]的一项研究表明,选择冷缺血时间短的年轻DCD 供者的肝脏可能会产生更好的移植结果。随着新的器官保存和复苏的技术正在不断进步[13-17],包括常温灌注、低温充氧灌注、体外再灌注和复苏,DCD 的移植物质量有望得到进一步改善。
大多数DCD 供肝源于Maastricht 分类Ⅲ类捐赠者,这部分患者往往在重症监护病房或急诊室等待生命维持治疗的停止(withdrawal of life-sustaining therapy,WLST)。然而,目前对于WLST 过程本身是否会对供体器官质量产生影响还没有确定的结论。此前有几项使用大型动物模型来研究诱导心脏骤停的研究中大多采用心脏除颤或使用心脏停搏药物的方式使得供体模型安乐死[18-21],然而这在临床上是不能进行的。还有一种实验模型是通过夹闭胸主动脉的方式来建立的不可控的DCD 猪模型[15]。这些模型显然不能用于模拟临床上肝移植前可控DCD 的状况。因此,为了更好地研究供体从撤离呼吸机至循环死亡过程中供体肝脏的变化,在本研究中,我们利用巴马小型猪建立了一种可控的撤离呼吸机模型。通过这一模型和过程,我们研究了撤除呼吸机阶段体循环的变化以及热缺血时间(warm ischemia time,WIT)对供体模型肝脏组织活性的影响。
1 材料和方法
1.1 实验动物处理:所有动物实验均按照“动物管理指南”进行,并经中国医科大学第一附属医院动物医学伦理委员会批准。选用16 只巴马小型猪,雌雄各8 只,体重均在45 ~ 55 kg,购自天津市实验小型猪繁育中心。
这些动物在手术前禁食24 h,充分补充水分。术前给实验动物肌注咪唑安定(0.2 mg/kg)和阿托品(0.2 mg/kg),气管插管前20 ~ 30 min 用速眠新Ⅱ号(0.1 ml/kg)镇静以及使用异氟醚(100%氧气中1% ~ 2%)麻醉。
应用颈动脉和静脉插管方式分别监测实验动物动脉压(arterial blood pressure,ABP)和中心静脉压(central venous pressure, CVP)。用血气分析仪(GEM Premier 3000)进行血气分析,同时连续监测心电图。
采用窒息法建立猪DCD 模型。加用异丙酚(500 mg/10 ml)和罗库溴铵(100 mg/10 ml)使实验动物维持适当程度的持续麻醉。通气维持在15 b/min 的呼吸频率,最大呼吸压低于25 cmH2O(1 cmH2O=0.098 kPa)。建立模拟临床过程的窒息模型,通过拔除气管导管来切断通气并且将该时间点定义为“撤机零点”。心电图监测显示心脏无电活动或临界低收缩压(SBP <50 mmHg)为供体心脏死亡的循环指征,标志着WIT 开始。临床上大多将器官WIT 定义为自撤除生命支持至原位主动脉冷灌注这段时间,本实验不涉及后续冷灌注,因此将WIT 定义为猪模型自心脏死亡开始后的相关时长,本实验仅观察WIT 延长至60 min 的猪模型的相关变化。
1.2 血流动力学监测:在整个手术过程中监测血流动力学和生化参数。模型存活时间(min)定义为从撤除呼吸机零点到确认动物模型心脏死亡的时间。每隔5 min 记录心率(heart rate,HR),血气分析:二氧化碳分压(partial pressure of carbon dioxide,PaCO2)、氧分压(oxygen partial pressure,PaO2)、平均动脉压(mean artery pressure,MAP)、中心静脉压(central venous pressure,CVP)、舒张压(diastolic blood pressure,DBP)、收缩压(systolic blood pressure,SBP)和血pH 值。
1.3 肝脏的病理检查:光镜下可检测内容包括血栓/出血、肝细胞肿胀、微泡性脂肪变性、细胞凋亡和坏死等形态学改变。电镜可观察亚细胞结构,包括内质网肿胀、线粒体质膜完整性、染色质边集和凝聚等情况。
1.3.1 光学显微镜检测方法:从WIT 开始到WIT后30 min,每5 min 取一次肝组织活检。组织用磷酸盐缓冲液洗净,用10%福尔马林固定至少24 h,以石蜡包埋,以5 μm 厚度切片。随后,切片脱蜡,再水化,苏木精伊红(hematoxylin and eosin,HE)染色检查。
1.3.2 电子显微镜方法:分别于WIT-0 min、WIT-30 min、WIT-60 min 取体积为1 mm3的肝活检标本,用Trump’s 固定剂固定,在20℃的温度下用1%四氧化二钐和碳酸氢钠缓冲液后固定3 h,用5%醋酸铀酰水溶液整块染色。厚片(1 m)用甲苯胺蓝染色。用LKB8801 超微切片机(LKB,瑞典斯德哥尔摩)从厚片上切下50 ~70 nm 的薄片,以醋酸铀酰和柠檬酸铅染色。所有样品均用透射电子显微镜(飞利浦EM201)检查和拍照。
2 结 果
2.1 血流动力学参数变化:实验动物的平均存活时间为17.94(11.3 ~24.5)min。在模型撤除呼吸机后的最初5 min 内,我们观察4 个血流动力学参数值均升高,如图1 所示,包括MAP、CVP、DBP 和SBP。其中SBP 中尤为突出。除CVP 在10 min 后开始下降外,其他所有指标都开始下降。心率也在撤除呼吸机后的前5 min 内升高,之后下降(图2)。撤 除 呼 吸 机 后5 min 内PaO2急 剧 下 降(图3),10 min 后逐渐降至0 mmHg(1 mmHg=0.133 kPa)。PaCO2值与实验动物的血液pH 值呈负相关(图4),这归因于实验动物的血液中碳酸含量逐渐增加。
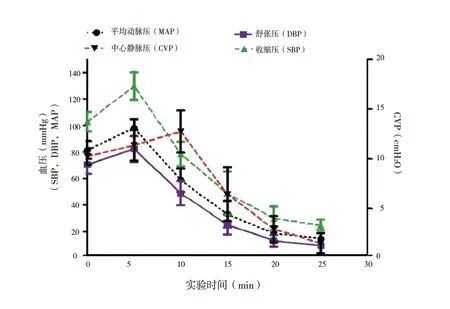
图1 血流动力学变化趋势
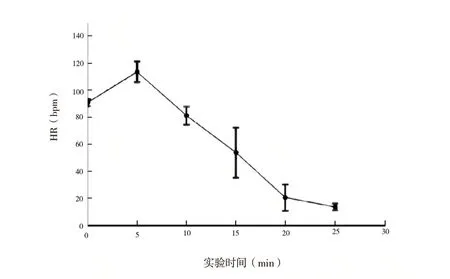
图2 HR 随实验时间的变化

图3 血气分析用来监测PaCO2 和PaO2
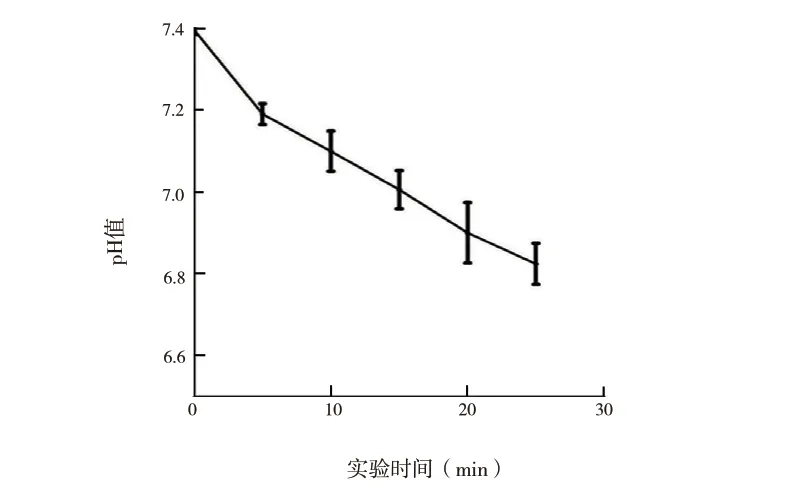
图4 pH 值变化
2.2 肝脏热缺血损伤的组织学评价
2.2.1 光学显微镜观察结果:如图5 所示,我们发现随着WIT 的延长,组织损伤程度逐渐严重。在WIT 的前10 min(图5B、5C 与5A 相比),实质内肝细胞仅有轻微肿胀,血管内的微血栓很容易被观察到。WIT-15 min 时(图5D),中心静脉周围可见放射状中心性水肿。中心静脉附近也可见炎性细胞。部分肝细胞表现出微泡性脂肪变性。凋亡肝细胞内可见嗜酸性小体,肝窦内可见5 ~8 个红细胞坏死。WIT-20 min 时(图5E),肝细胞和间质状况恶化,细胞肿胀加重,可见出血,并有局灶性或片状坏死,细胞核出现标志细胞发生坏死裂解。WIT-25 min(图5F),细胞肿胀加重,可见肝细胞空泡化,斑片状坏死明显。虽然中心静脉附近出血和脂肪变性加重,但门静脉区域结构保持完整。撤除呼吸机后30 min(图5G),大部分细胞出现膨胀,细胞间隙充满红细胞。大部分区域可见片状坏死,脂肪变性加重。大量细胞坏死裂解,出现大量细胞核。
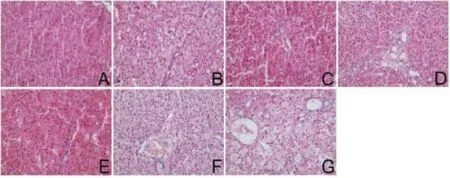
图5 组织学评价
2.2.2 电子显微镜:在WIT 刚开始时,肝细胞内线粒体呈圆形,内膜清晰,内质网排列整齐未见明显的染色质边集或凝聚(图6A)。WIT 延长至30 min 时,可见肝细胞呈广泛的空泡化,线粒体结构改变,内膜模糊。大多数肝细胞出现内质网肿胀(图6B)。WIT 延长至60 min 时,电镜下可见许多肝细胞出现了坏死。在相当数量的肝细胞中,内质网、线粒体甚至整个细胞都呈现严重的空泡化。线粒体整体密度降低,同时线粒体内可见大量电子致密沉淀物(图6C)。大多数肝细胞出现明显的染色质边集和凝集。结果显示WIT 控制在30 min 内对肝细胞的损伤呈现可逆,而WIT 延长至60 min 后肝细胞会出现不可逆的损伤,表现为广泛的严重空泡化和明显的染色质凝聚(图6C)。
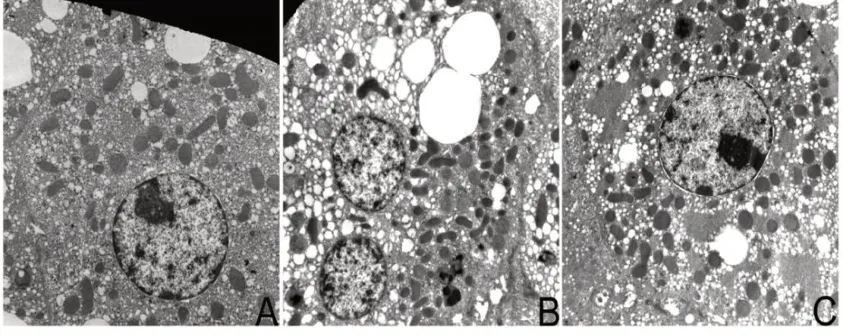
图6 电镜观察下的亚分子结构
3 讨 论
根据心脏骤停的情况,Maastricht 分类系统将DCD捐赠者分为两类:可控(Ⅰ和Ⅱ类)和不可控(Ⅲ和Ⅳ类)[22]。目前临床上大多数DCD 捐赠者被归类为Ⅲ类,即循环系统死亡发生在WLST 之后。从WLST开始到确认死亡再到最终获得器官,总会经历一段时间,这会导致不可避免的高血压和全身性低灌注的状态。在这个WIT 内,供体器官在没有血液和氧气供应的情况下,在体温下会仍然在经历高代谢状态。
与DBD 供体相比,DCD 供体通常会经历较长的WIT,因为确认心脏死亡需要更多的时间,这可能会导致DCD 捐赠者的器官遭受更严重的缺血性损伤[23-25]。目前已经有许多研究利用人类[23-25]以及动物实验模型[26-27]发现了长时间WIT 对器官的不利影响。然而,从停止生命维持治疗到宣布循环死亡的这个过程中,有关供者循环系统的全身性变化以及这段WIT 对器官的影响还没有得到详细的描述。特别是在猪DCD 窒息模型的研究中,鲜有研究涉及到停用生命支持过程中供体循环参数的波动问题。一些研究表明,供体低收缩压与移植的预后直接相关,而WIT 时间跨度与移植物活性呈负相关[20,26-27]。在Ho 等[28]的一项研究中提出,供者SBP 降至50 mmHg 以下的持续时间对移植物存活至关重要。在本研究中,我们重点关注了在这一过程中实验动物全身血压、氧气供应以及肝组织学的变化。
大多数已建立的大型动物DCD 模型尚不能很好地模拟临床情况。研究者们开发了一些方法,例如通过诱导心室颤动[20]或给予高浓度的钾[18]来诱导心脏骤停。在Banan 等[29]的研究中,通过静脉注射氯化钾诱导心脏骤停,并将WIT 定义为腹腔内阻断到开始常温体外肝脏灌注(normothermic extracorporeal liver perfusion,NELP)之间的时间。事实上,当捐赠者停止生命维持治疗时,器官会经历一段缓慢而渐进的缺血损伤时间直到心脏骤停,期间供体氧气供应随之减少。在我们的研究中,该模型非常接近临床上DCD 捐赠者停止生命维持治疗后的情景。我们采用了被动的方法,通过切断通气来诱导心脏骤停,从而允许对内脏的氧气输送和灌注可以缓慢而逐渐地减少。我们发现,从切断通气到确认心脏死亡之间的时间间隔并不恒定,这可能会导致WIT 时长的不确定性。因此,传统的心脏死亡标准确认开始定义的WIT 可能不能准确地反映供体器官真实的遭受热缺血损伤的时间。供体模型SBP在撤除呼吸机前5 min 升高,之后明显下降,撤除呼吸机后15 min 降至50 mmHg 以下。同时,撤除呼吸机10 min 后,血氧分压降至0 mmHg。我们定义的WIT 始于心脏死亡的确认,实际上移植物所经历的WIT 可能会更长。然而,不论WIT 如何定义,移植物的状况都可能受到额外的不确定WIT 的影响。
组织学研究结果表明,随着WIT 的延长,供肝组织遭受的损伤也更严重。我们在不同的时间点可以观察到不同程度的肝窦扩张、肝细胞肿胀和空泡化。这些发现与之前的一些相关性研究[30-31]是一致的。值得注意的是,肝细胞同时发生了细胞和亚细胞水平的改变。这些变化是在再灌注前发现的,这表明减少WIT 对移植物的保存至关重要。
目前,已有相关临床研究实验证实WIT 超过30 min 被认为是引起移植物进一步丢失的危险因素[32-35]。一项Sher 等[36]基于UNOS 数据对DCD供体的调查研究中表明美国大多数器官移植中心可接受的WIT 不超过30 min。国内有关猪肝移植时无心跳供体可耐受WIT 的研究中也认为安全时限为30 min,然而该研究中有关不同热缺血时长所致供肝热缺血损伤病理变化重点是于再灌注1 h 之后观察的[37]。然而之前Takada 等[38]研究认为猪肝移植可耐受的WIT 长达60 min,其结论主要基于其研究结果显示WIT 长达1 h 供肝的移植术后生存率可达80%。然而在国内相似研究[39]中,心脏死亡确定后60 min 供肝肝移植术后却无存活。有关热缺血安全时限报道差异较大,可能是由于评判标准,以及手术方法等差异,还需进一步研究。在我们的实验研究中,主要是通过对组织学结果评价可耐受的热缺血时长,结果表明WIT 在30 min 内供肝组织的损伤尚且可逆,至60 min 则不可逆。目前供肝资源短缺,有关热缺血时限的研究有助于进一步扩大DCD 供肝来源,Paterno 等[40]有关WIT 对受体预后的研究结果表示WIT 在30 ~40 min,移植存活率无明显差异。这一研究结果也提示有关供肝WIT 的筛选条件可适当放宽,以进一步扩大捐赠来源以及移植机会。
我们建立了一种模拟人类DCD 的心脏骤停的大型动物模型并观察和记录了在这个过程中供体血流动力学参数和供肝组织学的变化。我们的研究表明,从停止生命支持治疗到确认心脏死亡的这个缓慢过程可能会使移植物承受额外的缺血性损伤。
我们的研究还存在一些局限性。实验中使用的动物是健康的猪,而DCD 捐赠者通常有严重的脑损伤,尽管不是致命的。这种差异是否会对DCD供者所经历的缺氧过程产生影响,还需进一步研究。此外,虽然实验动物可以在切断通气后立即停止呼吸,但DCD 捐赠者可能在窒息死亡之前能够自主呼吸一段时间。因此,存在着一个未知的时间段,这段时间内尽管供体处在缺氧状态中,但循环仍在发生,这可能会使所获得的器官的质量评估进一步复杂化。本研究的样本量不大,可能会限制数据的可靠性。今后的研究将致力于使用该DCD 供体模型进一步建立机械灌注干预恢复的全程移植模型,研究移植物的缺血/再灌注损伤,探讨不同操作方式与移植结果的相关性。
以上,我们建立了一类猪DCD 模型,通过给实验动物撤除呼吸机可以更好地模拟临床Maastricht Ⅲ类。我们发现,在撤除呼吸机之后实验动物血压立即升高,但之后会持续下降。而PaO2迅速下降,PaCO2相应上升并达到平台期。同时,我们也发现WIT 对供体肝组织完整性有直接影响。WIT在30 min内的组织损伤可能仍是可逆的,而WIT 达到60 min 时的组织损伤则不可逆。
