原发性肝癌基因突变筛查及免疫微环境检测2 例报道分析
2022-08-05邓雯李嘉浩杜英郑州大学基础医学院微生物学与免疫学系河南郑州45000中山大学孙逸仙纪念医院生物治疗中心广东广州5020中山大学附属第一医院器官移植科广东广州50080
邓雯,李嘉浩,杜英(.郑州大学基础医学院微生物学与免疫学系,河南 郑州,45000;2.中山大学孙逸仙纪念医院生物治疗中心,广东 广州,5020;.中山大学附属第一医院器官移植科,广东 广州,50080)
肝癌是全球六大常见恶性肿瘤之一[1-3],我国每年新增肝癌病例约46.6 万例,约38.3 万人不幸死于肝癌,其死亡数占全球肝癌死亡总数的51%[4]。肝癌所导致的严重后果给我国社会、经济等各方面造成了沉重的负担。原发性肝癌的预后较差,传统的治疗手段包括手术治疗、化疗以及放疗。手术是治疗原发性肝癌的有效方法[5],包括肝切除术和肝移植术。但肝切除术往往治疗不彻底,而肝移植术仍面临着器官短缺、器官缺血/再灌注损伤、移植后免疫排斥反应等重大问题[6-7]。此外,局部治疗亦是重要补充手段。经皮消融和动脉内化疗栓塞术在一些早期肿瘤上可作为首选治疗方式,但是治疗后复发十分常见[8]。放疗和化疗虽能在一定程度上缓解病情,但同时也会对患者产生不良反应,且治疗效果不理想。因此,新的治疗策略迫在眉睫。
近年来,随着医学的不断发展,免疫治疗作为一种新型的治疗方法被广泛研究和应用。以免疫为基础的治疗方法使晚期癌症的系统治疗发生了革命性的变化[9]。免疫治疗主要是激活人体的免疫系统,通过诱导自身免疫效应细胞杀灭肿瘤或增强人机体内的抗肿瘤免疫应答能力,从而抑制肿瘤的发生与发展[10]。由于肝脏中存在大量的免疫细胞,如Kupffer细胞,甚至还存在着一大批拥有强大抗肿瘤潜能的先天性细胞[11],再加上肝癌内含有丰富的免疫细胞浸润这一特殊的肿瘤微环境(tumor microenvironment,TME)[12],宿主的免疫系统可自发地介导抗肿瘤作用[13]。因此,免疫治疗对于肝癌而言极具希望。
在本文中,我们将以2 例原发性肝癌的基因检测和免疫组化检测为案例,探讨这2 例病例的基因突变筛查和免疫微环境检测结果,并根据本研究结果对未来的肝癌治疗提出初步见解。
1 方 法
1.1 病例样本:本研究将2 例病理诊断为肝癌的男性患者纳入研究,其中1 例为肝细胞癌,另1 例为肝内胆管癌。表1 总结了这2 例患者的临床特征。2 例受检患者均在中山大学附属第一医院进行血液样本的采集以及肝脏穿刺活检,肝脏穿刺活检获取一针以上长条组织,并于24 h 内处于4 ~ 8℃的环境下与血液样本一同送达同一实验室。本研究中所有患者均签署书面知情同意书同意进行样本采集和数据分析。
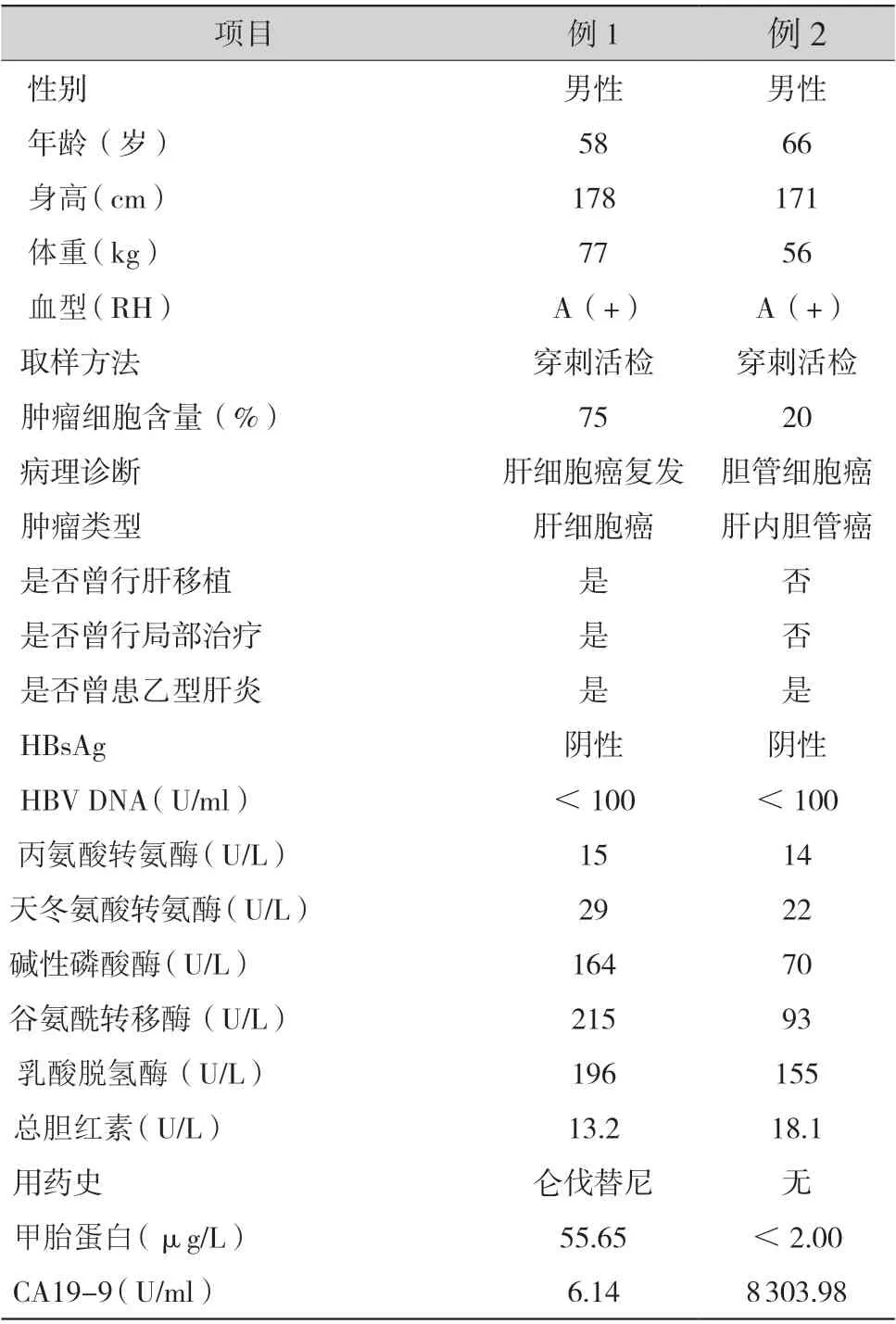
表1 患者的临床基本特征
1.2 免疫组化流程:在收到肝脏活检组织后立即用10%中性福尔马林固定液进行充分固定,制成FFPE组织切片。先将其放入Bond RX自动化染色仪器(Leica Biosystems)中进行HE 染色,并在光学显微镜下进行观察和记录(图1)。然后采用Akoya OPAL Polaris 7-Color Automation IHC 试 剂 盒(NEL871001KT) 进行多重免疫荧光染色。FFPE 组织切片首先在BONDRX 系统(Leica Biosystems)中脱蜡,依次与CD163(Abcam, ab182422,1:500)、CD68 (Abcam, ab213363,1:1000)、PD-1 (CST, D4W2J, 86163S, 1:200)、PD-L1 (CST, E1L3N, 13684S, 1:400)、CD3 (Dako,A0452)、CD4 (Abcam, ab133616, 1:100)、CD8(Abcam, ab178089, 1:100)、CD56 (Abcam, ab75813,1:100)、CD20 (Dako, L26, IR604)、FOXP3 (Abcam,ab20034, 1:100) 和pan-CK(Abcam, ab7753,1:100)一抗进行孵育,再依次与相应的二抗和活性荧光蛋白进行孵育。核酸用DAPI 染色。与一抗和二抗结合但不与荧光蛋白结合的组织切片作为阴性对照,以评估自身荧光。使用Vectra Polaris 定量病理成像系统(Akoya Biosciences)对多重染色切片进行扫描,扫描波长为20 nm,从440 nm 到780 nm,固定曝光时间,绝对放大率为×200。然后,将每张切片的所有扫描结果叠加在一起以获得一张图像。将多层图像导入inForm v.2.4.8 (Akoya Biosciences)进行定量图像分析。Pan-CK 染色鉴别肿瘤实质和间质。各种细胞群的数量以每平方毫米染色细胞的数量和所有有核细胞中阳性染色细胞的百分比表示(图2、3)。
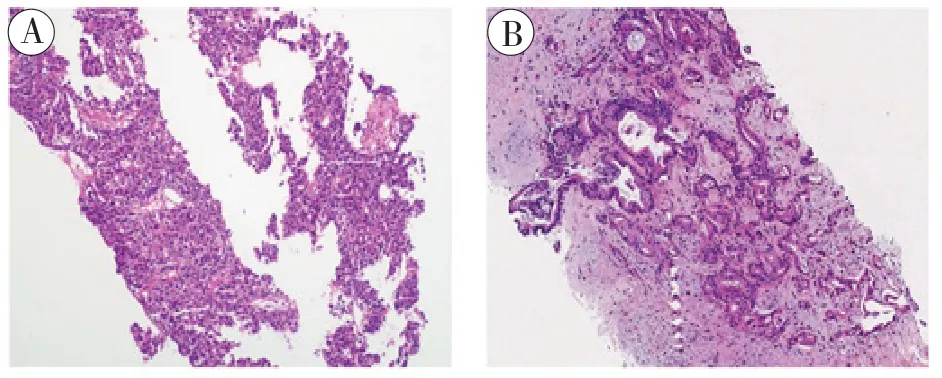
图1 HE 染色图(×200)
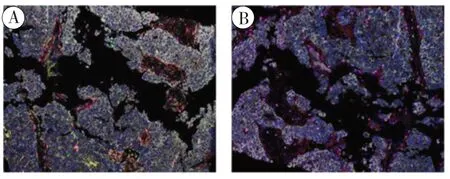
图2 免疫组化染色图(×200)
1.3 基因检测流程:组织处理和DNA 提取:用10%中性福尔马林制成FFPE 组织切片后,采用HE 染色评价肿瘤细胞含量,取肿瘤含量≥20%的样本进行后续分析。将FFPE 组织切片置于1.5 μl 离心管中,用矿物油脱蜡后,将样品与裂解液和蛋白酶K 在56℃条件下孵育过夜,直到组织完全消化。再用裂解液80℃孵育4 h,使用ReliaPrepTMFFPE gDNA Miniprep System(Promega)从组织样本中分离基因组DNA。
文库准备:使用S220 聚焦超声仪(Covaris)将DNA 提取物(30 ~ 200 ng)剪切至250 bp 的片段。使 用KAPA Hyper Prep 试 剂 盒(KAPA Biosystems)进行文库制备。
目标捕获:对多个与癌症相关的基因全外显子区域及部分内含子区域设计探针,制成NGS 基因面板。将500 ng 索引的DNA 文库合并,以获得总量为2 μg 的DNA。混合后的DNA 样本与人类cot-1 DNA和xGen Universal blocker - ts Mix 混合,并在SpeedVac系统中晾干。将杂交母液加入样品中,在95℃的热循环中孵育10 min,然后与4 μl 的探针混合,在65℃下孵育过夜。将捕获的文库加载到NovaSeq 6000平台(Illumina),进行100 bp 的配对端测序,平均测序深度为500X。配对样本(FFPE 样本及其正常组织对照)的原始数据使用Burrows-Wheeler对准器(v0.7.12)匹配到参考人类基因组hg19。分别使用Picard (v1.130)和SAMtools (v1.1.19)去除PCR 重复reads 并收集序列指标。
2 结 果

图3 免疫组化染色图(×200)
2.1 T 细胞分类以及亚型:2 例先以CD3+对T 细胞进行筛选,后再以CD4、CD8、FoxP3、PD-1+CD8+进行亚型分类。例1 肿瘤实质中CD3+单位密度个数为1413 个/mm2,占总细胞的18.48%,其中CD8+有8 个/mm2,占比0.1%,PD-1+CD8+有8 个/mm2,占比0.1%;FoxP3 单位密度为145 个/mm2,占1.9%;例2肿瘤实质中T 细胞数量较少,CD3+有283 个/mm2,占比3.03%,其中CD8+有26 个/mm2,占比0.26%,PD-1+CD8+有2 个/mm2,占比0.02%,FoxP3 单位密度为41 个mm2,占比0.43%。按照肿瘤组织CD8+T细胞的表达水平有两种表示方法:① CD8+T 细胞的密度 (个/mm2);② 根据CD8+T 细胞的百分比划分为0 ~ 3 分:0 分(没有或极少)1 分(<5%);2 分(> 5% 且<25%);3 分(> 25%)进行分级。肿瘤组织CD8+T 细胞密度 >330.1 个/mm2或评分>2 分,即可提示CD8+T 细胞密度较高[14]。由此可见例1、2的CD8+T 细胞密度较低。且2 例患者PD-1+CD8+比例和FoxP3 比例也较低(表2、3)。
2.2 PD-L1 免疫组化结果:在该研究当中,主要以肿瘤细胞阳性比例分数(TPS)(TPS=任何强度PD-L1 膜染色阳性肿瘤细胞数/ 肿瘤细胞总数×100%)、综合阳性分数(CPS)(CPS=PD-L1膜染色阳性肿瘤细胞+ PD-L1 阳性肿瘤相关免疫细胞/肿瘤细胞总数量×100)来表示PD-L1 的表达水平,例1 和2 的PD-L1 的TPS 小于1%且CPS 小于1,表示2 个案例的PD-L1 均呈阴性表达(表2、3)。
2.3 巨噬细胞以及NK 细胞的分型结果:根据生物学特征和表面标记物, 肿瘤相关巨噬细胞(tumourassociated macrophages,TAM) 可以分为M1型和M2型。M1 型 为CD68+、CD163-;M2 型 为CD68+、CD16+。例1 M1 型巨噬细胞为604 个/mm2,占总细胞个数的7.57%,M2 型巨噬细胞为303 个/mm2,占3.80%,例2 M1 型巨噬细胞为12 个/mm2,占总细胞个数的0.12%,M2 型巨噬细胞为11 个/mm2,占0.11%。2 例均以M1 型巨噬细胞为主。NK 细胞根据CD56的表达强度分为CD56 dim(弱着色)和CD56 bright(强着色)。例1 NK 细胞两种类型均为0,提示送检组织中可能不存在NK 细胞。例2 中bright 型为25 个/mm2,占0.26%,dim 型为20 个/mm2,占0.21%,bright 型较多(表2、3)。

表2 例1 的免疫检查点表达水平、肿瘤免疫微环境细胞构成和三级淋巴结构检测结果
2.4 B 细胞以及三级淋巴结构结果检测结果:以CD20 作为B 细胞的检测指标,以三级淋巴结构的典型结构作为三级淋巴结的检测指标,即中间是B 细胞 (CD20+) 细胞团簇, 外周被T 细胞(CD3+) 细胞包围,可以显示例1 B 细胞为240 个/nm2,占3.14%,而检测不出三级淋巴结构;例2 B 细胞以及三级淋巴结结构均未检测出(表2、3)。
2.5 基因检测结果:按照基因检测的测序结果显示,例 1 中样本组织肿瘤含量为75%(表1),肿瘤突变负荷为29.05 Muts/Mb,且属于微卫星稳定型(MSS),HLA-Ⅰ为杂合子,PTEN 基因拷贝数减少,TP53 基因发生点突变;例 2 中肿瘤含量为20%(表1),其中肿瘤突变符合为1.12 Muts/Mb,且属于微卫星稳定型(MSS),HLA-Ⅰ为杂合子,KRAS 基因出现点突变。
2.6 随访结果:2 例接受基因突变筛查以及免疫微环境检测后,并未正式开始接受免疫治疗。其中例1 在检测前已在规律服用仑伐替尼,但效果不佳。在进行检测后改为服用瑞戈非尼。后来病情进展,复查CT 结果提示肝癌病灶增多且大小增大,且肝酶以及胆红素指标相对较高,因此优先采取护肝利胆等保守治疗,不适宜马上接受免疫治疗。在保守治疗阶段复查CT 提示肿瘤仍在进展,后因肝癌并发症离世;例2 在检测后先行放射治疗,治疗结束后CT结果复查显示肿瘤稍缩小。后面计划采取相关的免疫/靶向治疗方案进行治疗。未来相关的治疗成果还需继续跟进。
3 讨 论
肝癌为一种免疫抑制的背景下发生的癌症,这使得免疫治疗成为一个潜在的、有吸引力的治疗选择[15]。肿瘤微环境以及免疫检查点治疗是免疫治疗的重要内容。
肿瘤微环境是指肿瘤的发生、发展及转移的能力,它与肿瘤细胞所处环境存在密切关系。肿瘤细胞可以通过自分泌或旁分泌的改变来维持自身的生存和发展[16]。除癌细胞外,肿瘤微环境还包含一系列免疫细胞、基质细胞、内皮细胞和癌症相关成纤维细胞[17]。CD8+细胞毒性T 细胞[18]和CD4+辅助T 细胞[19-20]为可直接或间接诱导癌细胞死亡的功能性淋巴细胞;控制调节性T 细胞(regulatory T cell,Treg)可以抑制过度反应性免疫反应,并且可抑制CD8+细胞毒性T 细胞对癌细胞的有效应答[21]。TAM 可分为促炎极化(M1 极化)和抗炎极化(M2 极化),M1极化巨噬细胞能防御和杀死肿瘤细胞,而M2 极化巨噬细胞可抑制免疫监视。这两类细胞可在肿瘤微环境的调控下相互转化[22]。自然杀伤细胞(NK 细胞)的功能与CD8+T 细胞相似,能介导肿瘤的免疫反应[23]。根据CD56 表达的强度,可以将NK 细胞分为CD56 dim(弱着色)和CD56 bright(强着色),CD56 dim 比CD56 bright 更具的杀伤活性[24]。B 细胞指能产生细胞因子,并可以与CD8+细胞毒性T 细胞协调免疫应答和担任抗原递呈细胞的一类淋巴细胞,其与一些肿瘤的良好临床结果相关[25]。三级淋巴结构是慢性炎症以及肿瘤形成过程中在非淋巴组织中形成的异位淋巴结构。在一些肿瘤中,B 细胞和三级淋巴结构的出现,与较好的免疫治疗结果相关[26]。

表3 例2 的免疫检查点表达水平、肿瘤免疫微环境细胞构成和三级淋巴结构检测结果
免疫检查点是免疫细胞上表达的、能调节免疫激活程度的分子,对维持自我耐受和调节外周组织生理免疫反应至关重要。一些肿瘤可利用某些免疫检查点作为免疫逃逸的主要机制[27]。目前最重要的一个研究方向是使用PD-1/PD-L1 抗体阻断PD-1 信号通路[16]。PD-L1 在多种肿瘤细胞上均有上调表达,它可与 T 细胞上的PD-1 相互结合,抑制T 细胞的增殖和活化,使得T 细胞处于失活状态,最终导致肿瘤免疫逃逸。根据肿瘤组织PD-L1 的表达与肿瘤浸润淋巴细胞(TIL),可以将肿瘤分为4 个免疫表型:免疫无反应型(TIL-、PD-L1-),该类型预后差;获得性免疫耐受型(TIL+、PD-L1+),其为PD-1/P-L1 抑制剂治疗的理想型;其他通道逃逸型(TIL+、PD-L1-),该型临床应用讨论尚不一致,仍需更多的临床研究来验证;原发诱导免疫型(TIL-、PD-L1+),该型临床少见,研究表明其对PD-1/PD-L1 抑制剂不敏感[28]。有多项研究表明,PD-L1 的表达水平与PD-1/PD-L1 抑制剂的疗效相关联[29]。
本研究中的2 例原发性肝癌的案例,其免疫组化结果相似。2 例患者PD-L1、CD8 定义为阴性,属于免疫无反应型,该类型的检测结果表示患者免疫治疗结果并不理想,预后相对较差。符合相关文献提到的PD-L1 表达为阴性的人群所占比例较阳性要高的结果[30];据其他免疫组化结果提示,2 例患者FoxP3 细胞密度低,提示免疫抑制作用低;2 例患者肿瘤相关巨噬细胞以M1 型为主,该类型的巨噬细胞抗肿瘤能力强,提示两患者可能具有一定的抗肿瘤能力;例1 中NK 细胞并未检测出,可能是检测视野中肿瘤组织中未含NK 细胞,提示该患者抗肿瘤免疫能力弱,例2 中NK 细胞CD56 染色结果显示bright类比dim 类多,提示该患者对肿瘤的杀伤能力不强;并且2 例患者的肿瘤组织中的B 细胞以及三级淋巴结构出现少甚至没有出现,更提示了患者接受免疫治疗后效果可能并不理想。
对于两个案例的基因检测结果方面,例1 和例2均属于微卫星稳定型,HLA-Ⅰ为杂合子。微卫星分为微卫星稳定型和不稳定型,多项研究结果表明高度微卫星不稳定型容易从免疫治疗指获益,特别是对于胃肠肿瘤[31-32];HLA-Ⅰ是存在于抗原呈递细胞表面的,主要负责抗原呈递的蛋白分子。据文献报道,其杂合子相对于纯合子在免疫检查点抑制剂治疗方面获益更多[33]。在肿瘤突变负荷上,例1 为29.05 Muts/Mb,高于98%的肝细胞癌患者,属于高肿瘤突变负荷组,而例2 为1.12 Mut/Mb,低于94%的肝内胆管癌患者,属于低肿瘤突变负荷组。据临床研究表明,肿瘤突变负荷可以作为免疫治疗效果评估的标记物之一,高肿瘤突变负荷的患者其总生存率更高[34]。例1 中PTEN 基因拷贝数减少,TP53 基因发生点突变。PTEN 基因的变化提示患者对mTOR抑制剂可能敏感[35],而对于EGFR 酪氨酸酶抑制剂可能存在耐药[36],TP53 基因的改变表明患者对于免疫检查点抑制剂治疗可能获益[37]。而例2 中KRAS基因出现点突变,其相较于野生型,可能更受益于免疫检查点抑制剂治疗[38]。
例1 和例2 的检测结果总体上提示其可能不适合于单药免疫治疗,这也符合了目前免疫治疗的临床有效率并不高的结果。毕竟对于总体患者而言,也仅有约20%对免疫治疗敏感[30]。该2 个案例都是由于综合检测结果表明对免疫治疗效果不佳而先采用其他治疗。例1 在检测后服用药物改为瑞戈非尼进行治疗,但未获得理想结果,肿瘤仍在进展,提示例1 基因突变结果(PTEN 基因和TP53 基因)对瑞戈非尼存在耐药的可能。再者,后面主要因肝脏功能较差,可能不能耐受免疫治疗而采取保守疗法,但事实证明如果采用进一步治疗如免疫治疗可能能延长患者生存期。例2 的治疗方案计划先采用放疗,后再结合免疫治疗。就前期的放疗疗效而言,可见肿瘤稍缩小,证明放疗可能有益于胆管细胞癌,对后续应用免疫治疗可能有帮助。
自从免疫治疗领域出现后,使用免疫疗法抗击癌症已经取得了许多突破性进展,其中包括使用基因疗法、溶瘤病毒、细胞因子、过继细胞疗法、肿瘤疫苗和免疫检查点抑制剂[39]。但就目前来看,单药免疫治疗对于癌症的临床有效率并不高,因此有人提出可以采用联合免疫治疗的方法,如例2 的治疗方案。
联合免疫治疗是指将多种免疫治疗措施有机地结合起来,形成一种对肿瘤有临床意义的治疗方法。由于肿瘤的免疫过程十分复杂,多种机制共同介导了肿瘤免疫逃逸结果。因此,联合免疫疗法联合应用了多种药物和措施,能通过多途径制约肿瘤生长,增强免疫治疗的疗效,提高患者的生存率。目前免疫联合治疗策略包括单/多个免疫检查点抗体、靶向药物、放化疗等的联用[40-42]。对于肝癌患者而言,也具有不错的临床效果。免疫联合治疗是一个创新且充满宝藏的领域,如果其能得到有效的利用,甚至能发挥出1+1 >2 的效果,未来在治疗肝癌的路上,更是一种有效的选择。
免疫治疗是治疗肝癌的一个有前途的新领域,目前有许多新的治疗策略正在开发中。PD-1 抑制剂等免疫治疗药物的临床应用结果令人鼓舞,联合免疫治疗的应用也让人对未来充满信心。但是对于原发性肝癌的免疫治疗方面,我们仍然需要砥砺前行,未来仍需进一步探索有关原发性肝癌的生物标记物,充分探索肝癌的肿瘤微环境状态,丰富在肿瘤方面的基因检测结果,为临床治疗提供更多更有效信息,尽力为每一个肝癌患者提供个性化的免疫治疗。
