优选本土非酿酒酵母混合发酵在干红葡萄酒中的应用潜力分析
2022-08-04梁丽红高娉娉张馨文康文军李敏王婧
梁丽红,高娉娉,2,张馨文,2,康文军,2,李敏,2,王婧,2*
1(甘肃农业大学 食品科学与工程学院,甘肃 兰州,730070)2(甘肃省葡萄与葡萄酒工程学重点实验室,甘肃 兰州,730070)
香气和感官特性是影响消费者葡萄酒偏好的重要因素之一。在酿酒过程中,酵母菌株的选择对芳香化合物的形成至关重要,进而决定葡萄酒的感官特性。目前,利用非酿酒酵母的混合发酵以定向改善葡萄酒某些酿酒参数和风味特征的研究已得到广泛关注[1]。许多非酿酒酵母菌株存在于酒精发酵(alcoholic fermentation, AF)阶段,通过产生一系列酶和代谢物影响葡萄酒的理化成分,香气特性和感官品质[2]。但非酿酒酵母通常不能独立完成AF,需要与发酵性能较强的菌株进行混合接种以完成AF[3]。
近年来,“微生物风土”对葡萄酒风格的影响逐渐受到关注,具有优良酿酒特性的本土酵母可促进产区或地域特色葡萄酒的风土表达[4]。酿酒酵母(Saccharomycescerevisiae)在AF过程中可快速适应高渗透压、低pH值、低氧气利用率、高乙醇浓度等苛刻的环境条件[5],逐渐开发为商业活性干粉制剂,尽管使用干粉制剂发酵具有易于控制和发酵迅速的优点,但会导致葡萄酒缺乏由本土酵母带来的风格的差异性和复杂性,使葡萄酒风味特征出现同质化现象[6]。有学者研究发现,接种优选的本土酵母菌的混合发酵有利于提高葡萄酒的香气复杂性[7]。LIN等[8]将筛选自南澳大利亚的多株本土非酿酒酵母与S.cerevisiae混合发酵,结果表明,酵母之间的相互作用促进灰比诺葡萄酒中短链脂肪酸乙酯的生成,对香气成分的促进效果显著,从而增强葡萄酒的地域特征。
耐热克鲁维酵母(Lachanceathermotolerans)在AF期间通过糖代谢产生较高的乳酸[9],其乳酸的产生量取决于菌株自身的特性和接种策略,在混合发酵过程中可能会因为菌株之间的拮抗作用产生较低的乳酸[10]。而粟酒裂殖酵母(Schizosaccharomycespombe)拥有较强的发酵能力和苹果酸降解能力,对葡萄酒生境有较强的耐受性[11]。另外,S.pombe可代谢产生含量较高的吡喃型花色苷和某些特征性香气物质,具有改善颜色参数、提高香气复杂性等优势[12]。
西班牙学者BENITO等[13]指出L.thermotolerans与S.pombe菌株是一对完美搭档,用于弥补彼此的缺陷。目前L.thermotolerans和S.pombe的混菌发酵在干红葡萄酒中的研究报道较少。本文以分离筛选于甘肃河西走廊的优良本土L.thermotolerans和S.pombe酵母作为发酵剂,以明确本土酵母在混合发酵中的细胞动态变化规律,评估其纯发酵和混合发酵引起的葡萄酒理化特性和香气成分的变化,为建立多菌种发酵工艺模式提供技术参考。
1 材料与方法
1.1 材料与试剂
1.1.1 试验原料
美乐葡萄:2020年10月采自甘肃省武威市民勤县夏博览葡萄酒庄园,葡萄汁含糖量229.5 g/L,葡萄汁含总酸量6.94 g/L(以酒石酸计)。
1.1.2 酵母与培养基
L.thermotolerans(LT),由甘肃省葡萄与葡萄酒工程学重点实验室筛选于甘肃祁连葡萄酒业有限责任公司的自然发酵葡萄醪;S.pombe(SP),由甘肃省葡萄与葡萄酒工程学重点实验室保藏。以上菌株均在甘油管中于-80 ℃保存。
酿酒酵母活性干粉(Vintage Red, VR),意大利Enartis公司;商业酒酒球菌(Oenococcusoeni):OMEGA,法国Lallemand公司。
YPD固体培养基(g/L):葡萄糖20.0,蛋白胨20.0,酵母浸粉10.0,琼脂20.0。
YPD液体培养基:同YPD培养基,不加琼脂。
WL培养基,青岛海博生物技术有限公司。
葡萄汁培养基:葡萄汁与无菌纯水(1∶1,体积比)。培养基均现用现配,于121 ℃高压灭菌20 min后备用。
1.2 试剂与设备
1.2.1 试验试剂
2-辛醇(色谱级),美国SIGMA-ALDRICH贸易有限公司;氯化钠(分析纯),天津市科密欧化学试剂有限公司;EX-V果胶酶(分析纯),法国Lallemand公司。
1.2.2 仪器与设备
SW-CJ-2FD超净工作台,苏州安泰空气技术有限公司;EX-150-II生化培养箱,上海跃进医疗器械有限公司;LDZX-50KBS立式压力蒸汽灭菌器,上海申安医疗器械厂;Genesis 10 s紫外-可见分光光度计、Ultimate 3000高效液相色谱仪,美国Thermo VRientific公司;TRACE 1310-ISQ气相色谱质谱仪,美国Thermo Scientific公司。
1.3 试验方法
1.3.1 酵母培养
挑取菌株LT和SP的单菌落分别接入YPD液体培养基,28 ℃培养48 h,连续培养2次后,以2%接种量接种至葡萄汁培养基,28 ℃培养48 h后接种于葡萄醪(生物量达到108CFU/mL)。
商业菌株活化:将菌株VR以0.02 g/L添加量加入6%无菌葡萄糖水溶液中,37 ℃活化30 min后,按2%接种量接于葡萄汁培养基中,连续培养2次后,接种葡萄醪。
1.3.2 小容器发酵
5 L的发酵罐中加入约3.5 L的美乐葡萄醪(装液量为70%),后加入20 mg/L的果胶酶、50 mg/L的SO2(以偏重亚硫酸钾的形式),15 ℃低温浸渍48 h后,按照接种方案分别接入种子液,25 ℃控温发酵,当残糖含量低于4 g/L时,添加60 mg/L的SO2终止发酵,倒罐除去酒泥后装入棕色发酵罐,进行满罐低温贮存(15 ℃,4个月),后续测定葡萄酒的发酵参数。
1.3.3 接种方案
酵母菌株经YPD培养基活化扩培,以2%接种量接种于葡萄醪中。对照组是以2%的接种量单独接种商业酿酒酵母VR,AF结束后按0.02 g/L接入商业酒酒球菌O.oeni启动苹果酸-乳酸发酵(malolactic fermentation, MLF),记为VR。同时接种:以LT (106)∶SP (103)=103∶1;LT (106)∶SP (102)=104∶1;LT (106)∶SP (10)=105∶1的比例接种,分别记为LS3, LS4, LS5。同时,以2%的接种量单独接种LT和SP进行纯发酵,记为LT和SP。所有试验组设置3个平行。
1.3.4 指标测定
1.3.4.1 理化指标测定
总糖,酒精度,总酸,挥发酸等酿酒参数参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》测定。
总花色苷含量采用pH示差法测定,参照岳泰新[14]的方法;色度和色调参照田秀等[15]的方法。
1.3.4.2 酵母计数
通过WL营养琼脂培养基平板计数法检测整个发酵过程中的细胞浓度。在27 ℃下培养48 h后,根据非酿酒酵母与酿酒酵母在WL培养基上所呈现的表型特征进行差异计数。
1.3.4.3 苹果酸、乳酸测定
参照BUGLASS等[16]的方法,并略作修改,采用高效液相色谱仪进行测定。
1.3.4.4 甘油含量测定
采用专用酶试剂盒进行测定,具体操作根据试剂盒说明书进行。
1.3.4.5 香气成分测定
参照宋茹茹等[17]的方法并略作修改。以2-辛醇为内标,采用内标法进行定量。
1.3.4.6 感官分析
由拥有葡萄酒品鉴资格证的专业品鉴员(5名女性和5名男性)组成的品尝小组对供试葡萄酒进行感官评定。分别从浓郁度,果香味,花香味,余味,生青味,酸味这6个方面对酒样进行评价,以8分结构数值量化为标准。感官分析过程中,每一供试酒样重复分析3次。
1.4 数据分析
采用Microsoft Office Excel 2010和Origin 9.0进行数据处理,SPSS 22.0对数据进行单因素方差分析,利用Duncan’s多重比较在置信区间0.05下对数据进行差异显著性分析和香气化合物分析。
2 结果与分析
2.1 不同接种方式对发酵速率的影响
如图1所示,各试验组均完成AF。VR对照组最快完成AF,历时9 d,LT和SP组分别于第14、15天完成AF。不同比例共接种发酵(LS3, LS4, LS5)均于第14天左右完成发酵。发酵第2天时,各试验组的发酵速率与VR对照组无显著差异。但随着发酵的进行,发酵速率呈现明显差异。与VR发酵相比,非酿酒酵母LT和SP混菌发酵在一定程度上延缓了发酵进程,可能是由于非酿酒酵母具有较弱的AF能力导致的[18]。

图1 不同接种方式下的发酵曲线Fig.1 Fermentation curve under different inoculation methods
2.2 菌株生长动态分析
图2为AF过程中的酵母细胞生长动态,图2-A表示单独接种VR、LT和SP菌株的酵母细胞数量变化,3株酵母的初始菌株生物量均在106~107CFU/mL,生长趋势较为相似。VR菌株在第2天时细胞数量达到最高值(7.6 lgCFU/mL),而非酿酒酵母LT和SP在第4天细胞数量达到最高值,分别为7.9、7.1 lgCFU/mL。随后菌体数量均开始下降,发酵结束时,VR和SP菌株细胞数量均稳定在106CFU/mL,而LT菌株细胞数量均稳定在105CFU/mL。
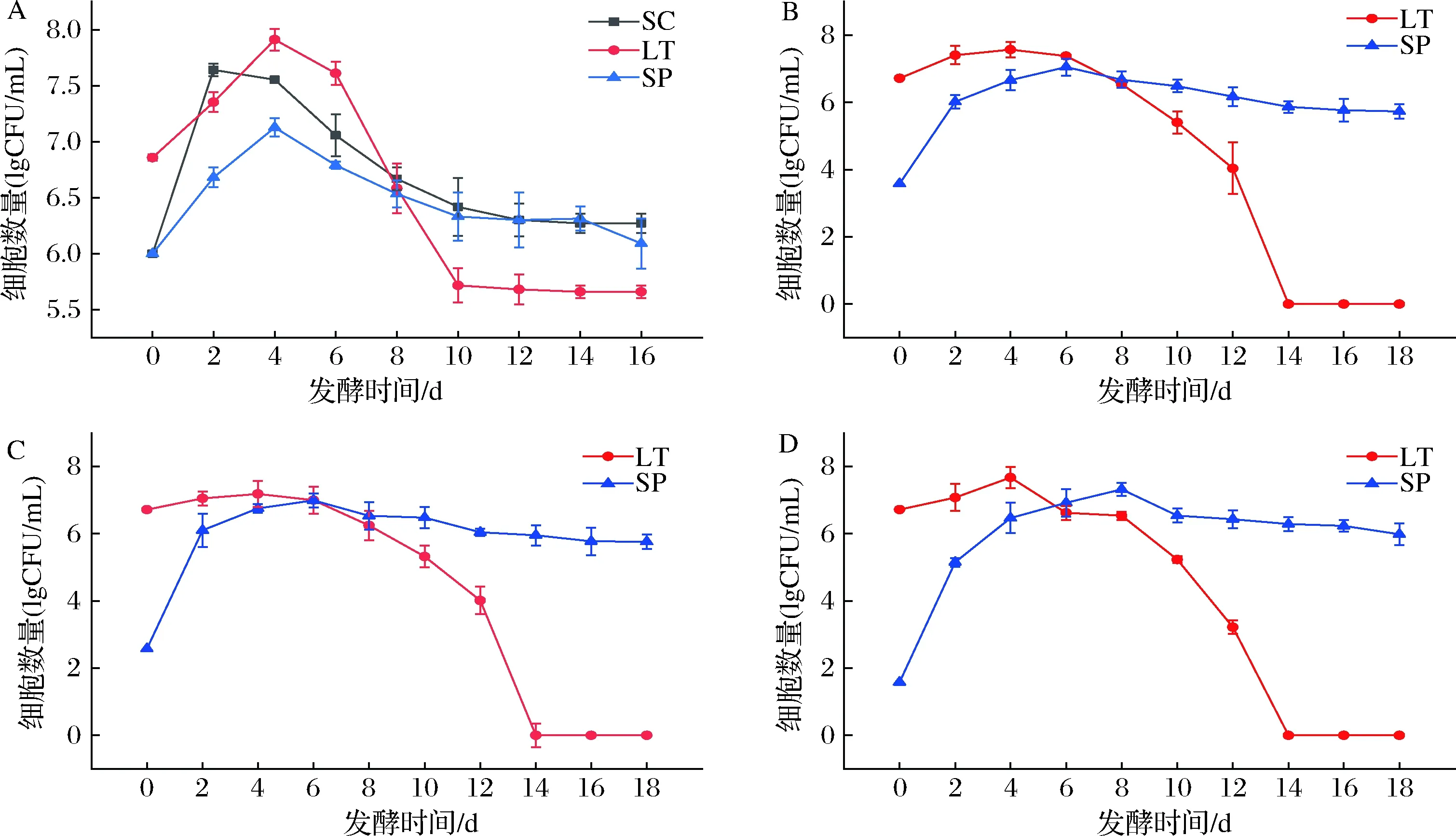
A-单独接种VR、LT和SP菌株的酵母细胞数量变化;B-LT和SP菌株以103∶1共接种发酵过程中酵母细胞数量变化;C-LT和SP菌株以104∶1共接种发酵过程中酵母细胞数量变化;D-LT和SP菌株以105∶1共接种发酵过程中酵母细胞数量变化图2 不同接种发酵中LT和SP的菌株生物量变化Fig.2 The changes of the number of LT and SP in different inoculation fermentation
图2-B~图2-D为LT和SP菌株以不同比例共接种发酵过程中酵母的生长动态变化。同时接种发酵中LT在第4天达到最大生长量后即开始逐渐下降,在发酵结束时(14 d左右)即无法检测到LT活细胞的存在。而SP在达到最大生长量后,随着发酵进程其细胞数量略有下降,直至发酵结束,细胞数量依然维持在106CFU/mL,表明SP在AF过程中具有良好的定殖能力。相关研究表明,当接种S.pombe时,L.thermotolerans细胞在几天内迅速消失[13, 19]。混合发酵中非酿酒酵母生存能力的丧失与主要代谢物(尤其是乙醇)浓度的变化有关。本试验中,LT菌株的衰亡与SP菌株的代谢产物或乙醇浓度的抑制作用是否有较强的相关性,还有待于进一步研究。
2.3 理化指标分析
2株本土非酿酒酵母以不同比例混合发酵对葡萄酒主要发酵参数的影响如表1所示。与VR对照组相比,LT和SP酒样的酒精体积分数较低,并且残糖含量较高;共同接种组酒样的酒精体积分数(11.05%~12.37%)略低于纯发酵组(12.65%~13.64%)。已有研究表明,使用非酿酒酵母可将碳代谢从乙醇途径转移到甘油等其他代谢产物途径,从而降低葡萄酒的酒精含量[20]。2株非酿酒酵母参与发酵的酒样挥发酸(以乙酸计)含量均低于VR酒样,其中SP酒样的挥发酸质量浓度最低(为0.30 g/L)。相比于VR组,其他试验组酒样中总酸含量升高,且随着LT菌株接种比例的增加,总酸含量逐渐增加。共同接种发酵酒样的pH值显著低于VR组,而SP纯发酵组的pH值显著高于其他试验组。
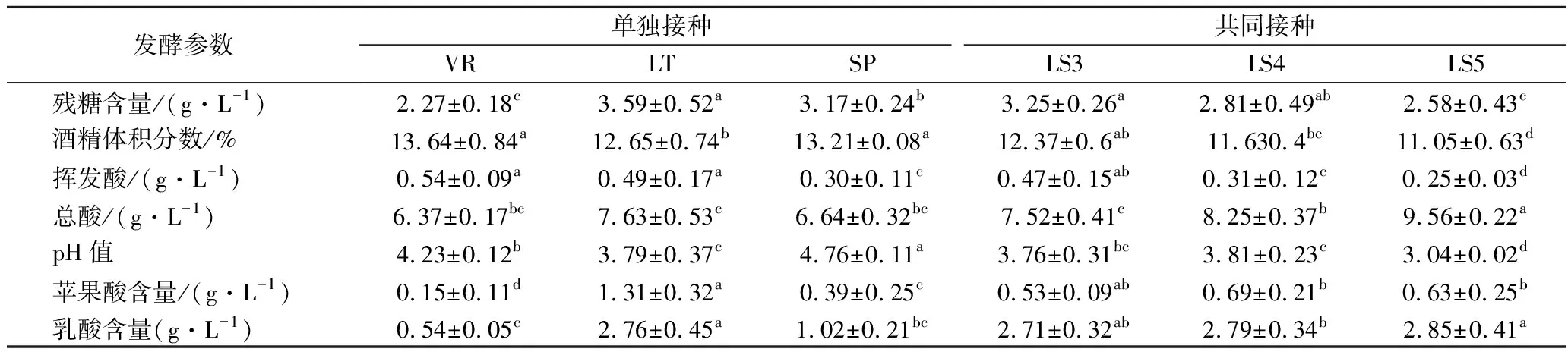
表1 发酵结束后酒样的基本理化指标Table 1 Chemical composition of wines at the end of fermentation
葡萄汁中的初始苹果酸含量为2.15 g/L,乳酸含量为0.31 g/L。对供试酒样苹果酸的含量分析表明,各试验组的苹果酸降解能力差异显著,且纯发酵组SP的苹果酸降解能力达81.86%,显著高于其他试验组。LS3、LS4、LS5组苹果酸降解率分别为75.35%,67.91%,70.71%,表明LT和SP按不同比例接种发酵,对最终的苹果酸含量有一定的调整作用。另外,涉及LT参与发酵的酒样中乳酸含量显著高于其他试验组。DEL FRESNO研究发现L.thermotolerans+S.pombe组合的试验中,最终乳酸含量显著增加,且大多数乳酸是在AF的第一阶段产生的,此时L.thermotolerans占据主导地位[13]。上述结果还表明LT菌株的接种比例会影响乳酸产生量,其可能是由于混合发酵酒样中菌株之间的互作作用和竞争作用。
2.4 颜色参数分析
图3为供试酒样的颜色参数,包括色度、色调和总花色苷含量。色泽是红葡萄酒主要发酵参数之一。各试验组的色调和色度值差异显著,SP单独发酵的色度值最高,为2.01,显著高于VR和LT纯发酵组。有学者研究发现,与S.cerevisiae相比,涉及S.pombe的混合发酵通常可使红葡萄酒的颜色强度增加[13],这与本试验结果一致。这种效应可能归因于AF期间产生的乳酸导致pH值降低,而这种低pH条件会增加花青素分子(如黄酮)的颜色强度[21]。LS3酒样色度值为最低水平0.83,显著低于LS4,LS5;就色调而言,共接种试验组的色调值均显著低于纯发酵组,其中共接种试验组间无显著差异,表明LT和SP共接种对干红葡萄酒的色调值影响较小。SP酒样中的总花色苷含量最高,达到141.98 mg/L,显著高于其他试验组酒样;且总花色苷含量随着LT接种比例的增高而逐渐升高(128.95~138.54 mg/L)。MORATA等[22]研究表明,S.pombe能够代谢产生高浓度的丙酮酸等物质以合成Vitis A的前体物质,其次,S.pombe具有较高的羟基肉桂酸乙酯脱羧酶活性,从而对红葡萄酒的颜色产生积极影响[23]。
2.5 甘油含量分析
甘油是葡萄酒中主要化合物之一,高水平的甘油含量通常会增强酒体结构、协调性或甜味等感官特性[23]。由图4可知,涉及非酿酒酵母LT和SP参与发酵的酒样中甘油含量显著增加,显著高于VR组,共同接种组的甘油含量随着LT菌株接种比例的增大,其含量不断升高,甘油含量在5.37~6.18 g/L。表明LT和SP菌株共接种发酵能够增加甘油含量。也有研究报道L.thermotolerans[23]和S.pomb[13]等非酿酒酵母可产生比S.cerevisiae更高含量的甘油。

图3 不同接种发酵对色度、色调和总花色苷含量的影响Fig.3 Effect of different inoculation fermentation on chroma, hue and total anthocyanin content注:不同小写字母表示组间差异显著(P<0.05)
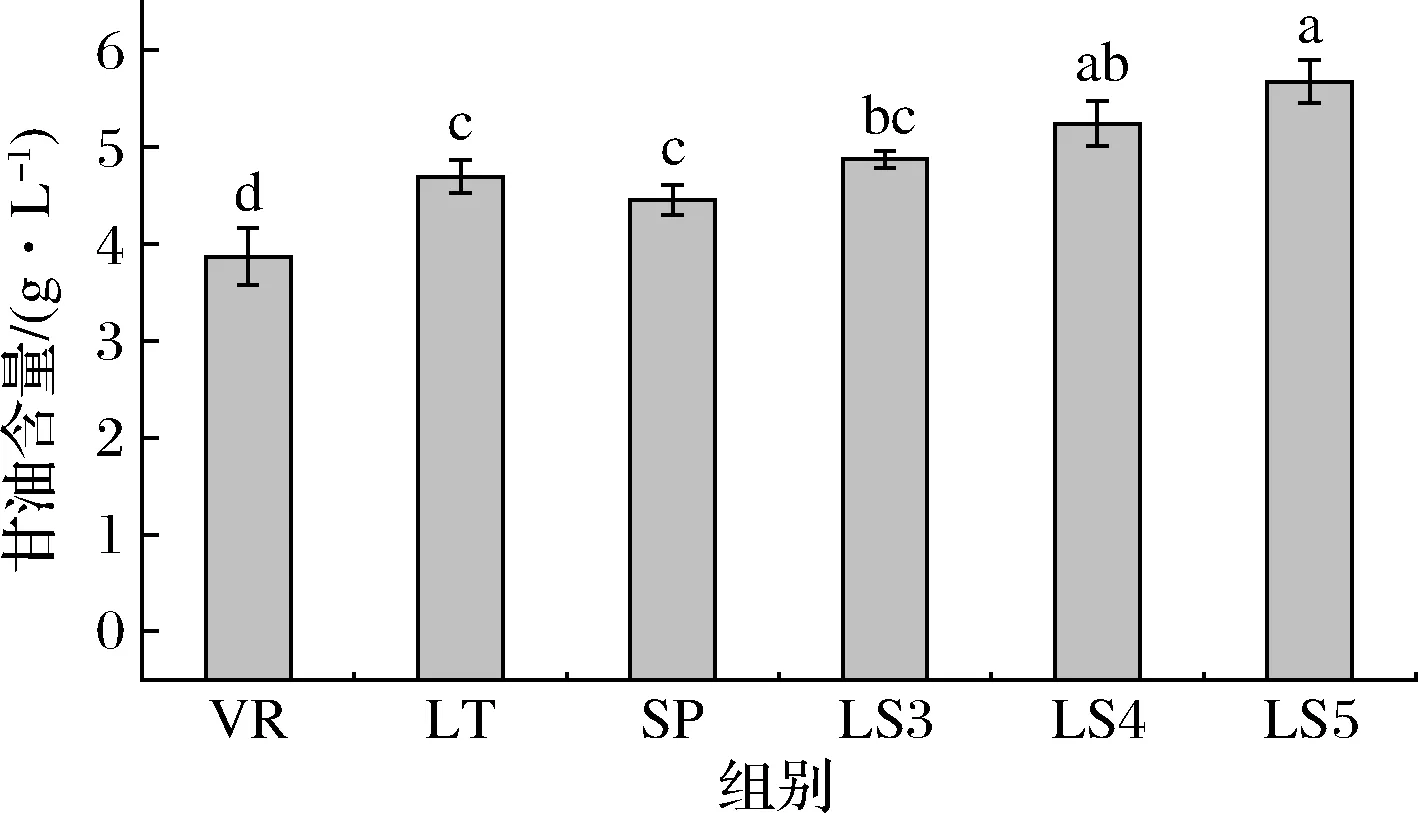
图4 供试酒样甘油生成量Fig.4 Glycerol production of sample wines注:不同小写字母表示差异显著(P<0.05)
2.6 香气化合物分析
不同处理组酒样中共检测分析出44种香气物质(相应结果见附表,https://kns.cnki.net/kcms/detail/11.1802.TS.20211216.1343.003.html),包括C6化合物,萜烯类,醛酮类,C13-去甲类异戊二烯,高级醇,乙酸酯,乙醇酯,脂肪酸,芳香醇等几大类物质。各处理间香气物质种类无显著差异,但物质含量存在显著差异。
2.6.1 挥发性香气物质热图分析
图5显示不同接种发酵过程中挥发性芳香化合物的含量差异变化。与VR对照组相比,LT纯接种发酵促进3-乙氧基丙醇(45.32 μg/L),2-壬醇(9.71 μg/L),癸酸乙酯(304.98 μg/L)和9-癸烯酸(203.43 μg/L)等物质的合成。而SP纯接种发酵对中链脂肪酸(4-癸烯酸乙酯、月桂酸乙酯、癸酸乙酯),高级醇和香叶醇有较好的促进作用。研究表明,葡萄酒中香气物质的生成在非酿酒酵母的共发酵体系中存在协同作用[24]。与纯发酵组相比,共接种组酒样的香气物质含量显著增加,且随着LT菌株接种比例的增大,C6醇、中链脂肪酸乙酯、琥珀酸二乙酯和乳酸乙酯等酯类香气物质的含量显著升高,有利于葡萄酒果香和香气复杂性的增强,这可能是混合发酵过程中酵母之间的互作作用促进酯类的生成。本试验还检测出3种乙酸酯类物质,包括乙酸异戊酯,乙酸苯乙酯和乙酸乙酯。而C6醇是通过脂肪酸代谢途径产生,但本试验酒样中仅检测到2种C6醇类物质,分别是正己醇和3-己烯-1-醇。本研究还发现高比例接种LT菌株发酵的酒样中苯甲醇和苯乙醇含量显著提高,其中苯乙基类物质可为葡萄酒带来玫瑰香等愉悦的香气特征。LS5组酒样的苯乙醇质量浓度最高,为6 905.10 μg/L。也有文献报道认为非酿酒酵母具有较高的苯乙醇合成能力[25]。
葡萄酒中的脂肪酸能够抑制对应芳香酯的水解,但含量过高(>11 mg/L)时会给葡萄酒带来刺激、腐败等不良风味[26]。本试验检出的丁酸,己酸,辛酸,癸酸,9-癸烯酸等脂肪酸,丁酸和辛酸的含量随LT菌株接种比例的增大显著升高。另外,其他挥发性物质中,共接种处理酒样中的β-大马酮含量显著提高,具有果香,甜香和蜂蜜香的香气特征。

图5 不同接种方式下挥发性物质的含量变化Fig.5 Changes in the content of volatile substances under different inoculation methods
2.6.2 感官分析
各试验组酒样的感官分析雷达图(图6)表明,不同接种发酵方式和菌株的选择对葡萄酒的酸味,果香味,生青味等香气特征有显著的影响。各发酵酒样在余味长短方面得分无显著差异。香气分析表明,非酿酒酵母的共接种处理的花香和果香味均有较高得分,其中,LS5酒样的香气浓郁度更强,整体评分较高。从口感方面分析,共同接种发酵酒样显著改善酒体的酸度,增加协调性。综上,共接种发酵有利于葡萄酒香气特征的提升,促进花香味和果香味的提高。
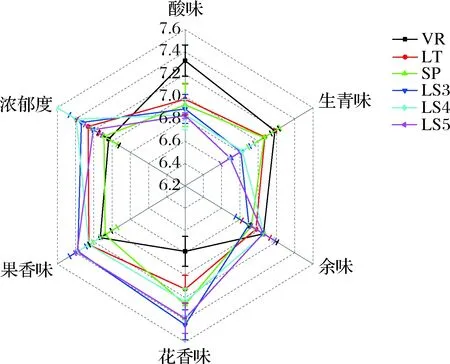
图6 感官分析雷达图Fig.6 Sensory analysis radar chart
3 结论
本土耐热克鲁维酵母(L.thermotolerans)菌株LT和粟酒裂殖酵母(S.pombe)菌株SP分别以不同比例同时接种发酵,探究其对干红葡萄酒相关酿酒参数、香气成分和感官特性的影响。通过对各供试酒样在AF过程中菌体数量的动态监测,结果表明,SP菌株在整个AF过程中表现出良好的定殖能力,而LT菌株最终全部消亡。葡萄酒的整体香气是多种挥发性物质相互作用的最终表现,其种类及含量显著影响葡萄酒的香气特征。LT和SP的混合发酵有利于干红葡萄酒香气质量的提升,且105∶1的比例同时接种发酵可显著提高C6醇、中链脂肪酸乙酯、琥珀酸二乙酯和乳酸乙酯等香气物质的含量,对花果香类成分有较好的促进作用。
