代谢工程构建谷氨酸棒杆菌合成5-氨基乙酰丙酸
2022-08-04魏敏华李宇虹张佳蓉孟静孟燕王浚哲张成林
魏敏华,李宇虹,张佳蓉,孟静,孟燕,王浚哲,张成林
(天津科技大学 生物工程学院,天津,300457)
5-氨基乙酰丙酸(5-aminolevulinic acid)是生物体内合成叶绿素、血红素和维生素B12等四氢吡咯化合物的前体物,广泛存在于微生物及动植物细胞中[1-2]。5-氨基乙酰丙酸因具有很好的安全性、特异性和渗透性,近年来被应用于肿瘤的定位和光动力学诊断[3]。此外,该物质还被用作植物生长促进剂、杀虫剂、除草剂等[4]。由此可见,5-氨基乙酰丙酸具有广阔的市场前景。
目前工业上主要采用化学法合成5-氨基乙酰丙酸,但该方法成本较高且对环境污染严重[5]。近年来,随着代谢工程和合成生物学的迅猛发展,生物法合成5-氨基乙酰丙酸倍受关注,底盘细胞主要集中于大肠杆菌和谷氨酸棒杆菌。目前已发现C4和C5两条5-氨基乙酰丙酸途径[6]。前者以甘氨酸和琥珀酰辅酶A为前体经5-氨基乙酰丙酸合成酶催化合成。利用该途径合成5-氨基乙酰丙酸的研究较为深入,主要策略为在底盘细胞中过表达5-氨基乙酰丙酸合成酶编码基因,并在发酵过程中添加甘氨酸和(或)琥珀酸(或琥珀酰辅酶A)[2,7-8]。但甘氨酸对细胞具有毒害作用,且底物添加增加了发酵工艺的复杂性和生产成本[2]。C5途径以L-谷氨酸为前体合成,因此可利用葡萄糖直接发酵合成(图1)。谷氨酸棒杆菌因能在天然条件下合成L-谷氨酸,被视为5-氨基乙酰丙酸的理想底盘细胞[9-11]。RAMZI等[10]首次报道了在谷氨酸棒杆菌中过表达来源于沙门氏菌(Salmonellatyphimurium)的5-氨基乙酰丙酸合成关键酶谷氨酰-tRNA还原酶编码基因hemAM和谷氨酸-1-半醛氨基转移酶编码基因hemL,重组菌株可合成457 mg/L 5-氨基乙酰丙酸,实现了利用C5途径直接发酵合成5-氨基乙酰丙酸。同时期,YU等[11]在谷氨酸棒杆菌中构建了C5途径,并发现Fe2+和溶氧是影响5-氨基乙酰丙酸的关键因素,经优化可合成1.79 g/L 5-氨基乙酰丙酸。我们在前期研究中,通过强化5-氨基乙酰丙酸合成途径、增强辅酶合成、动态调控三羧酸(tricarboxylic acid,TCA)循环及5-氨基乙酰丙酸输出等策略,使其产量提高到3.16 g/L[12]。
本研究拟在前期研究基础上,进一步探索影响5-氨基乙酰丙酸的关键因素。包括阻断L-谷氨酸的输出、利用脱氧核糖核酸(deoxyribonucleic acid,DNA)脚手架组装谷氨酰-tRNA还原酶和谷氨酸-1-半醛氨基转移酶、强化TCA循环等(图1),以期为提升5-氨基乙酰丙酸的合成效率提供依据。
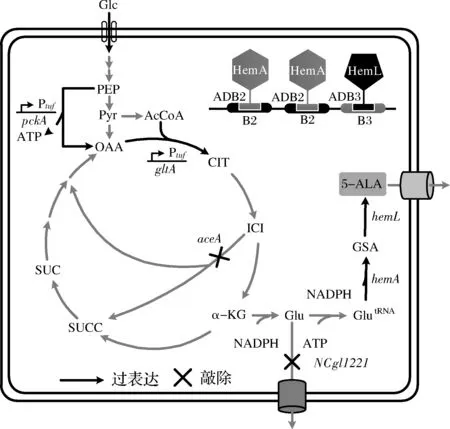
图1 5-氨基乙酰丙酸合成途径及本研究主要策略Fig.1 Pathway for synthesis of 5-aminolevulinic acid and the strategies used in this study注:Glc,葡萄糖;PEP,磷酸烯醇式丙酮酸;Pyr,丙酮酸;OAA,草酰乙酸;AcCoA,乙酰辅酶A;CIT,柠檬酸;ICI,异柠檬酸;α-KG,α-酮戊二酸;SUCC,琥珀酸辅酶A;SUC,琥珀酸;Glu,谷氨酸;GlutRNA,谷氨酸酰tRNA;GSA,谷氨酸-1-半醛;5-ALA,5-氨基乙酰丙酸;ADB,人工DNA结合域;B,ADB结合DNA序列
1 材料与方法
1.1 试剂与仪器
无机盐、葡萄糖等,国药集团试剂有限公司;5-氨基乙酰丙酸,上海阿拉丁生化科技股份有限公司;DNA提取等试剂盒,美国Omega Bio-Tek公司;限制性内切酶、DNA聚合酶等,宝日医生物技术(北京)有限公司;一步法克隆试剂盒,南京诺唯赞生物科技有限公司;三磷酸腺苷(adenosine triphosphate,ATP)检测试剂盒,普洛麦格(北京)生物技术有限公司;NADPH检测试剂盒,美国博世生物技术有限公司;人工DNA结合域ADB2和ADB3编码序列由苏州金唯智生物科技有限公司合成。
PTC-1148型聚合酶链式反应PCR仪,美国Bio-Rad公司。
1.2 菌株与质粒
本研究中使用的菌株和质粒见表1。其中E.coliDH5α用于质粒构建和复制,谷氨酸棒杆菌C.glutamicumATCC13032为出发菌株。
1.3 引物
引物由苏州金唯智生物科技有限公司合成,序列见表2。

表1 菌株和质粒Table 1 Strains and plasmids
1.4 培养基
LB培养基(g/L):蛋白胨10,酵母粉5,NaCl 10,pH 7.0~7.5。
BHIS培养基(g/L):Brain-Heart Infusion 37,山梨醇91,pH 7.0~7.2。
种子培养基(g/L):Brain-Heart Infusion 37,葡萄糖0.5,自然pH。
CGXII培养基:葡萄糖50 g/L,(NH4)2SO45 g/L,尿素1 g/L,KH2PO40.5 g/L,K2HPO40.5 g/L,MgSO40.125 g/L,3-吗啉丙磺酸42 g/L,ZnSO4·7H2O 10 mg/L,CuSO40.2 mg/L,NiCl2·6H2O 0.02 mg/L,生物素0.2 mg/L,pH 7.0~7.5。
1.5 质粒及菌株的构建
利用引物HemA-1和HemA-2扩增ADB2序列利用一步法克隆试剂盒连接至经PstI酶切的pAL4质粒;获得的重组质粒经XbaI酶切与利用引物HemL-1和HemL-2扩增的ADB3序列连接,经转化、筛选、鉴定后将重组质粒命名为pX-AL。分别将合成的ADB2结合位点B2及ADB3结合位点B3以1∶1、2∶1及1∶2比例合成连接至经BamH I酶切的pEC-XK99EΔlacIΔPtrc,经转化、筛选、鉴定后将重组质粒命名为pE11、pE21和pE12[13-14]。

表2 引物Table 2 Primers
利用基于自杀质粒pK18mobsacB的基因重组方法进行基因敲除和敲入。以敲除NCgl1221为例,分别利用引物NCgl1221-1/NCgl1221-2和NCgl1221-3/NCgl1221-4扩增NCgl1221基因上下游同源臂,再利用引物NCgl1221-1/NCgl1221-4经重叠PCR获得融合片段ΔNCgl1221,将其连接至经XbaI酶切的pK18mobsacB,获得pK18mob-ΔNCgl1221。重组质粒pK18 mob-ΔNCgl1221电转化至C.glutamicumATCC13032,经2轮筛选并鉴定后获得重组菌株C.glutamicumΔNCgl1221。利用相同的方法获得菌株ALA-5~ALA-10[15]。
1.6 摇瓶发酵实验
将菌株在LB斜面培养基活化后,挑取适量菌体至种子培养基(根据需要添加100 mg/L氨苄青霉素或/和50 mg/L卡那霉素),32 ℃、220 r/min振荡培养10 h,即为种子培养物。以10%的接种量将上述每个种子培养物分别接种至3个30 mL CGXII培养基(根据需要添加100 mg/L氨苄青霉素或/和50 mg/L卡那霉素),用氨水维持pH 7.0~7.5,于32 ℃,220 r/min振荡培养48 h。每个实验共重复3次。
1.7 检测与分析方法
菌体生物量以OD600值计。发酵结束后发酵液经13 000 r/min离心2 min后取上清液适当稀释。取 2 mL 上清液,加入0.5 mL乙酰丙酮和1 mL的乙酸钠缓冲液(1 mol/L,pH 4.6),沸水浴15 min后冷却至室温。取上述反应液2 mL与2 mL对二甲氨基苯甲醛显色剂混合,反应30 min后于554 nm下测定吸光度[15]。
2 结果与分析
2.1 敲除NCgl1221基因阻断L-谷氨酸的外排
如前所述,谷氨酸棒杆菌C.glutamicumATCC13032在天然条件下即可积累L-谷氨酸,而L-谷氨酸是5-氨基乙酰丙酸的前体物。NCgl1221编码的通道蛋白MscCG是L-谷氨酸的输出载体,可将胞内过量的L-谷氨酸分泌至胞外[16]。研究表明,敲除NCgl1221基因可阻断胞内L-谷氨酸的分泌[17]。采用重叠PCR扩增NCgl1221基因同源臂同源片段,并连接至自杀质粒pK18mobsacB,获得重组质粒pK18-ΔNCgl1221。将pK18-ΔNCgl1221转化至C.glutamicumATCC13032,经2轮重组、筛选后挑取单菌落进行菌落PCR验证。结果如图2所示,获得碱基数约为1 000 bp和2 932 bp的片段,分别与敲除和未敲除的NCgl1221一致(分别为1 009 bp和2 932 bp)。表明该基因成功敲除,将其命名为C.glutamicumΔNCgl1221。
为考察C.glutamicumΔNCgl1221的特性,对其进行摇瓶培养。与C.glutamicumATCC13032相比,C.glutamicumΔNCgl1221的生物量未见明显差异。但其谷氨酸分泌量减少到痕量(图3-a)。将克隆有hemAM和hemL(分别编码5-氨基乙酰丙酸合成关键酶谷氨酰-tRNA还原酶和谷氨酸-1-半醛氨基转移酶)的重组质粒pAL4分别转化至C.glutamicumATCC13032和C.glutamicumΔNCgl1221(分别获得菌株ALA-C和ALA-1),以考察敲除NCgl1221对其合成5-氨基乙酰丙酸的影响。结果如图3-b所示,二者生长亦无差异,但C.glutamicumΔNCgl1221的5-氨基乙酰丙酸产量达到0.62 g/L,较前者提高26.5%。上述结果表明,敲除NCgl1221基因可有效阻止胞内L-谷氨酸的外排,为5-氨基乙酰丙酸的合成提供更多前体,从而促进其合成。
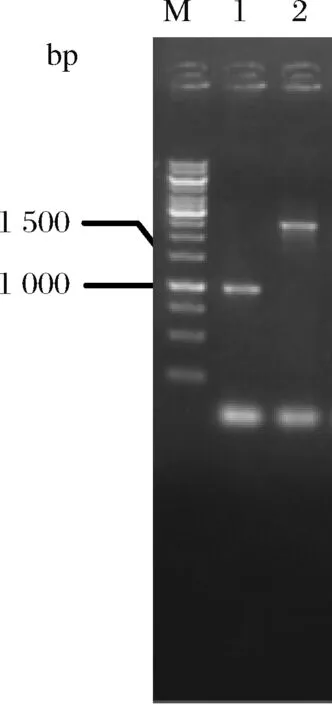
M-Marker;1-C.glutamicumΔNCgl1221;2-C.glutamicumATCC13032菌图2 C.glutamicumΔNCgl1221菌落PCR鉴定图谱Fig.2 Map for PCR identification of C.glutamicumΔNCgl1221
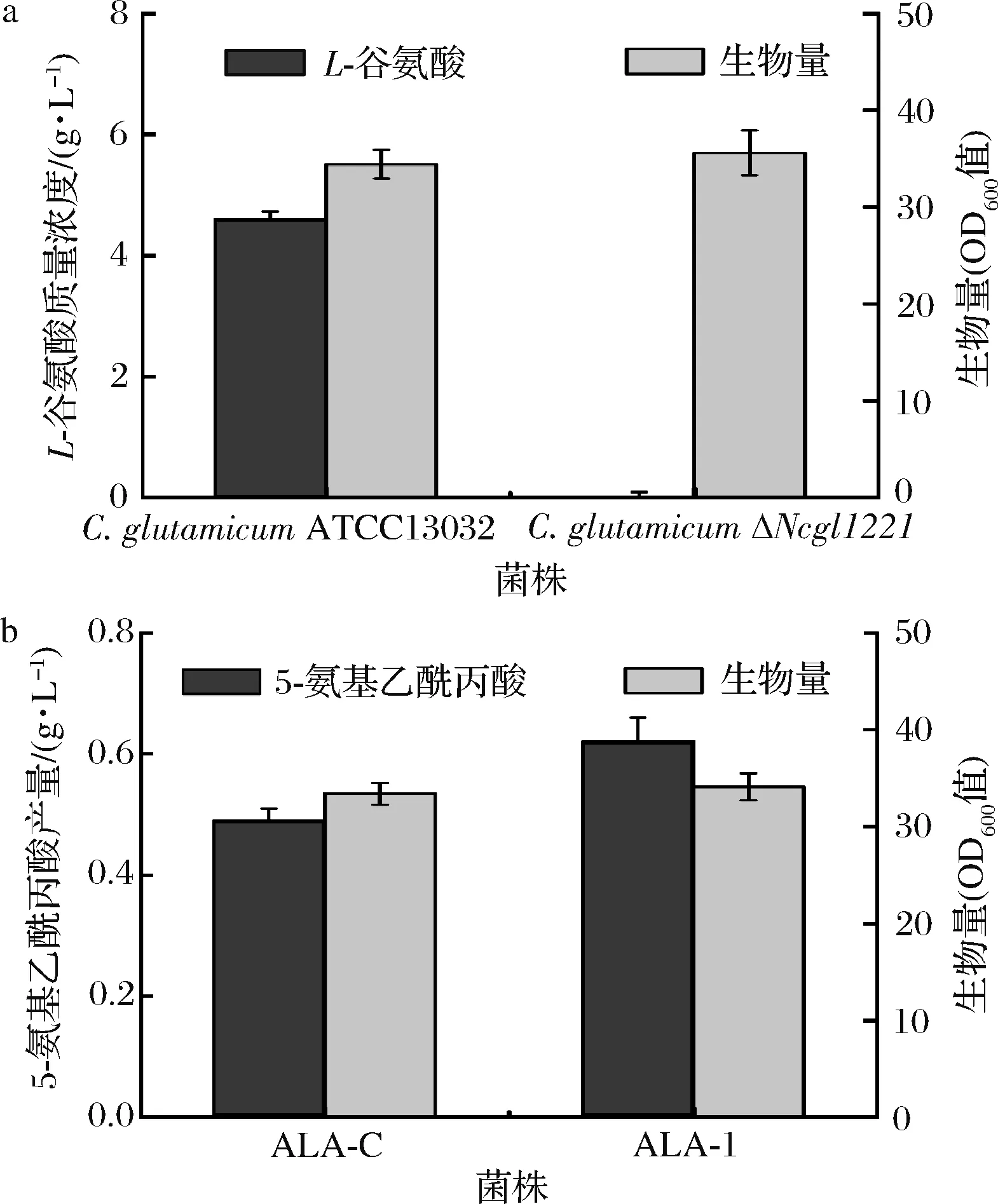
a-菌株合成L-谷氨酸的特性;b-菌株合成5-氨基乙酰丙酸的特性图3 NCgl1221敲除对工程菌株特性的影响Fig.3 Effect of NCgl1221 deletion on characteristics of engineered strains
2.2 利用DNA脚手架体系调控关键酶的表达
在微生物尤其是原核生物细胞内,合成途径中前一个酶将中间代谢产物传递给下一个酶完全依赖于该产物的自由扩散及与酶的碰撞,从而限制了反应效率[18]。此外,对细胞生长和代谢有毒害作用的中间代谢产物不能及时消耗亦会影响其代谢速率[19-20]。DNA脚手架体系可将数种酶有序组装在DNA脚手架上,减小了酶与酶之间中间代谢产物的传递难度并有效缓解其过量积累,从而提高代谢反应效率。其原理是将含有人工DNA结合域(artificial DNA binding domain,ADB)的锌指蛋白融合于关键酶的N端或C端;不同的ADB识别和结合的靶DNA序列B不同;将不同靶DNA序列按需求串联到质粒上,带有ADB的关键酶则会按顺序组装到靶DNA序列上(图4-a),从而缩小了酶与酶中间代谢产物传递的空间[21]。LIU等[22]利用该系统在枯草芽孢杆菌中组装N-乙酰氨基葡萄糖合成关键酶氨基葡萄糖-果糖-6-磷酸氨基转移酶和氨基葡萄糖-磷酸N-乙酰转移酶,最高使得N-乙酰氨基葡萄糖产量提高2.5倍。
本研究利用DNA脚手架体系组装5-氨基乙酰丙酸合成关键酶谷氨酰-tRNA还原酶和谷氨酸-1-半醛氨基转移酶,以考察其对5-氨基乙酰丙酸合成效率的影响。如图4-a所示,本研究构建了3种DNA脚手架,以获得最佳组合方式。采用摇瓶发酵实验考察菌株发酵特性,结果如图4-b所示。与对照菌株ALA-1相比,3株菌的生长未见明显差异。其中ALA-2的5-氨基乙酰丙酸产量与ALA-1接近(0.61 g/L),ALA-4的产量明显低于ALA-1,ALA-3产量达到0.84 g/L,较ALA-1提高35.5%。由此可见,以DNA脚手架B2和B3比例为2∶1时效果最佳。

a-DNA脚手架体系应用策略;b-菌株发酵特性图4 DNA脚手架体系及其对工程菌5-氨基乙酰丙酸合成的影响Fig.4 DNA scaffold systems and their effects on synthesis of 5-aminolevulinic acid of engineered strains
2.3 强化草酰乙酸供应对5-氨基乙酰丙酸合成的影响
草酰乙酸是TCA循环的重要前体物。在谷氨酸棒杆菌中,草酰乙酸主要来源于丙酮酸羧化酶(由pyc编码)和磷酸烯醇式丙酮酸羧化酶(由ppc编码)催化的回补途径(anaplerotic pathway)[23]。研究表明,二者均能增强草酰乙酸的供应并促进细胞生长。此外,有研究表明来源于曼海姆产琥珀酸菌(Mannheiemiasucciniciproducens)的磷酸烯醇式丙酮酸羧化酶(由pckA编码)在催化草酰乙酸合成的同时还可生成ATP[24]。为考察上述3种羧化酶对5-氨基乙酰丙酸合成的影响,分别采用将出发菌株ALA-3的pyc和ppc的启动子替换为强启动子Ptuf、基因组整合Ptuf-pckA的方式强化其表达。
分别将重组质粒pK18mobsacBPpyc::Ptuf、pK18mobsacBPppc::Ptuf和pK18mobsacBPtuf-pckA电转化至ALA-3,经2轮筛选后挑取单菌落进行菌落PCR验证。如图5所示,分别获得碱基数约为2 000、2 000 、3 000 bp的片段,与实际值一致(分别为2 100、2 040、2 920 bp),表明启动子替换成功,分别命名为ALA-5、ALA-6和ALA-7。

M-Marker;1-ALA-3;2-ALA-5、ALA-6或ALA-7a-ALA-5的鉴定图谱;b-ALA-6的鉴定图谱;c-ALA-7的鉴定图谱图5 菌株ALA-5、ALA-6和ALA-7菌落PCR鉴定图谱Fig.5 Map for PCR identification of ALA-5, ALA-6 and ALA-7
摇瓶发酵实验结果表明,强化丙酮酸羧化酶和磷酸烯醇式丙酮酸羧化酶催化的2条回补途径均有利于5-氨基乙酰丙酸的合成,3株菌的产量分别达到0.96、1.07、1.12 g/L,较对照菌株ALA-3提高14.2%、27.4%和33.3%(图6-a),可见过表达pckA效果最佳。推测原因是,5-氨基乙酰丙酸合成途径中谷氨酸氨酰-tRNA合成酶需要ATP,来源于M.succiniciproducens的磷酸烯醇式丙酮酸羧化酶在催化草酰乙酸合成的同时为其提供ATP。为验证该推测,测定了菌株的胞内ATP浓度,结果表明ALA-7的胞内ATP浓度显著高于ALA-3、ALA-5和ALA-6(图6-b)。由于过表达ppc基因的效果优于过表达pyc基因,故为进一步提高草酰乙酸供应,将菌株ALA-7中的ppc基因启动子替换为Ptuf,获得菌株ALA-8。发酵实验结果表明,该菌株的生长和5-氨基乙酰丙酸产量显著下降(图6-a)。推测原因是,过表达pckA后使得磷酸烯醇式丙酮酸向草酰乙酸的代谢流增强,而向丙酮酸的代谢流相对减弱;在此基础上过表达ppc使得更多的磷酸烯醇式丙酮酸用于草酰乙酸合成,而非用于丙酮酸,从而使得TCA循环代谢流减弱,影响了细胞生长和5-氨基乙酰丙酸的合成。

a-菌株发酵特性;b-胞内ATP浓度图6 增强回补途径对菌株5-氨基乙酰丙酸发酵性能的影响Fig.6 Effect of enhancing anaplerotic pathway on 5-aminolevulinic acid production of engineered strains
2.4 增强TCA循环对5-氨基乙酰丙酸合成的影响
由gltA编码的柠檬酸合成酶催化草酰乙酸和乙酰辅酶A合成柠檬酸,是TCA循环的第1个关键酶[25]。前期研究发现过表达该基因可增强TCA循环代谢流。为考察gltA过表达对5-氨基乙酰丙酸合成的影响,将其启动子替换为强启动子Ptuf。将重组质粒pK18-PgltA::Ptuf电转化至菌株ALA-7,经2轮重组、筛选后挑取单菌落进行菌落PCR验证。结果如图7-a所示,获得碱基数约为1 500 bp,与替换为Ptuf的实际值一致(1 422 bp),表明启动子替换成功,命名为ALA-9。摇瓶发酵实验结果表明,菌株ALA-9的生物量高于ALA-7;其5-氨基乙酰丙酸的产量为1.26 g/L,提高12.5%,暗示过表达gltA有利于增强TCA循环代谢流,从而为5-氨基乙酰丙酸的合成提供更多前体物L-谷氨酸。
2.5 增强NADPH供应对5-氨基乙酰丙酸合成的影响
合成L-谷氨酸的谷氨酸脱氢酶以及谷氨酰-tRNA还原酶均需NADPH为辅酶,故推测强化NADPH供应可能有利于5-氨基乙酰丙酸的合成。吡啶核苷酸转氢酶(由pntAB编码)能够催化NAD+生成NADPH,增强NADPH的供应[26]。与大肠杆菌不同,谷氨酸棒杆菌中未发现pntAB基因。异柠檬酸既可经异柠檬酸脱氢酶催化合成α-酮戊二酸,亦可经异柠檬酸裂解酶(由aceA编码)裂解为乙醛酸和琥珀酸。前期研究表明,敲除aceA基因可提高α-酮戊二酸的合成。故将来源于大肠杆菌的pntAB基因连同Ptuf整合到菌株ALA-9基因组aceA基因位点,以期增强α-酮戊二酸及NADPH供应。如图7-b所示,对重组菌株进行菌落PCR鉴定,获得碱基数约为1 500 bp的片段,与pntAB基因整合菌株的实际值一致(1 612 bp),表明pntAB基因成功整合,将其命名为ALA-10。
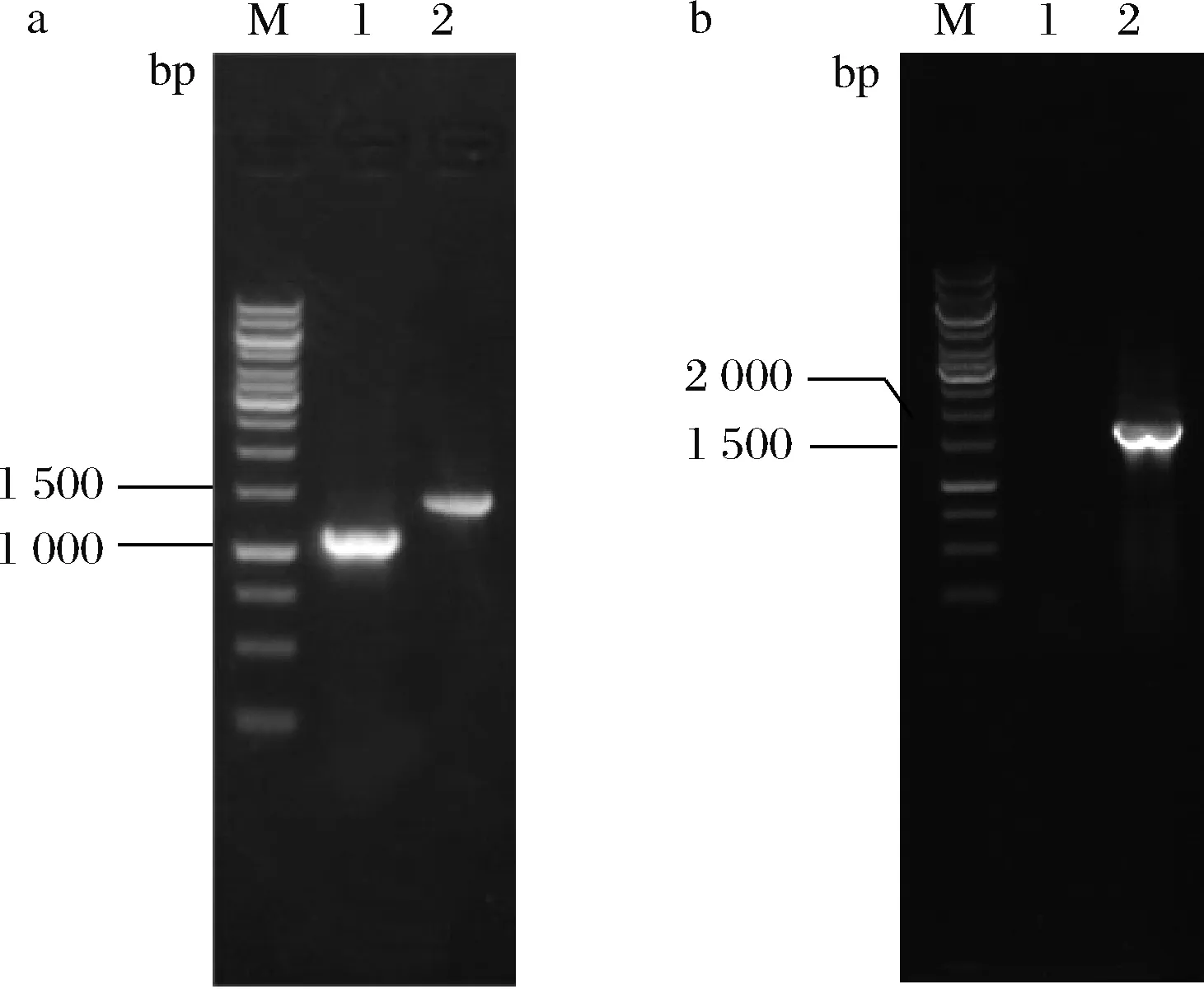
M-Marker;1-ALA-8;2-ALA-9或ALA-10a-ALA-9的鉴定图谱;b-ALA-10的鉴定图谱图7 菌株ALA-9和ALA-10菌落PCR鉴定图谱Fig.7 Map for PCR identification of ALA-9 andALA-10
摇瓶发酵实验结果表明,菌株ALA-10与出发菌株ALA-9生长无明显差异,但其5-氨基乙酰丙酸的产量提高至1.47 g/L,提升16.7%(图8)。检测了菌株ALA-10胞内NADPH浓度,发现其水平较ALA-9提高25.9%。上述结果表明,NADPH供应是5-氨基乙酰丙酸合成的瓶颈,过表达pntAB可有效提升NADPH 供应从而提高5-氨基乙酰丙酸合成效率。
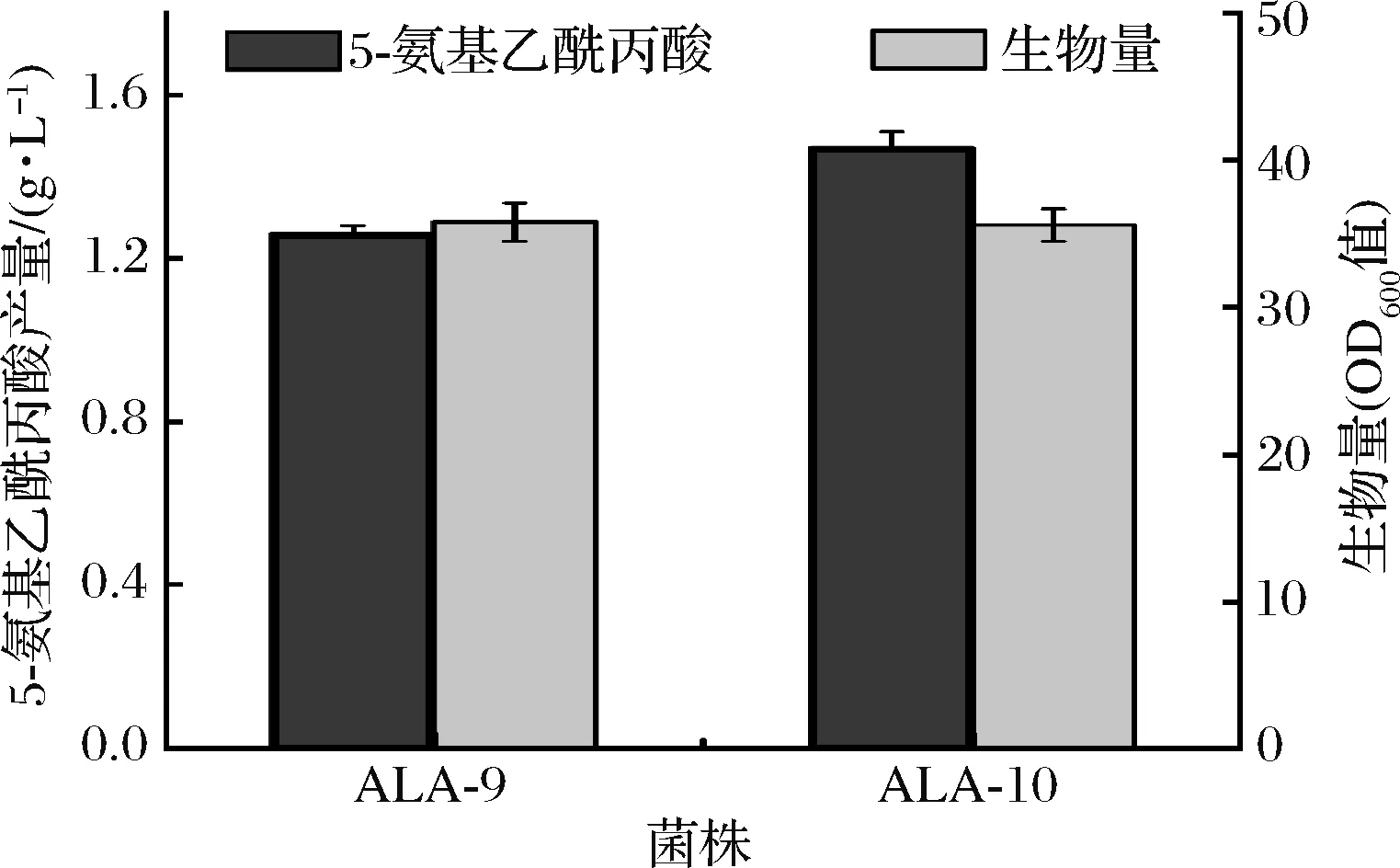
图8 ALA-9和ALA-10的生长和5-氨基乙酰丙酸生产性能Fig.8 The 5-aminolevulinic acid production and growth of ALA-9 and ALA-10
3 结论
本研究首先通过敲除L-谷氨酸转运蛋白编码基因阻断胞内L-谷氨酸的外排,为5-氨基乙酰丙酸的合成提供了前体物质。然后,将5-氨基乙酰丙酸合成关键酶谷氨酰-tRNA还原酶和谷氨酸-1-半醛氨基转移酶按比例组装至DNA脚手架上,以缩短二者之间中间代谢产物的传递空间,使得5-氨基乙酰丙酸产量提高35.3%。在此基础上,通过过表达gltA、pckA和pntAB强化TCA循环以及ATP和NADPH的供应。获得的菌株经摇瓶发酵48 h,其5-氨基乙酰丙酸产量达到1.47 g/L。上述策略可为进一步提升5-氨基乙酰丙酸的生物合成效率提供依据。
