基于miR-15a-5p/P53信号通路探讨EMT与肺癌细胞阿霉素耐药的关系
2022-08-04辛运超李彦明郝雁冰
魏 东,辛运超,刘 博,容 宇,李彦明,郝雁冰
非小细胞肺癌是全世界人类肿瘤相关死亡的主要原因,5年生存率<15%[1]。单纯化疗或联合放疗为治疗晚期肺癌的一线治疗策略[2]。然而,由于固有的或获得性的耐药性,化疗的疗效是短暂的,并且受到显著地限制,从而导致较差的生存率[3]。阿霉素(doxorubicin,DOX)已被用于肺癌的治疗。然而,DOX耐药性限制了其临床疗效[4]。更好地理解揭示化疗耐药(包括DOX耐药)的分子机制对于肺癌患者获得更好的生存率非常重要。MicroRNAs(miRNAs)是一种小的非编码RNA,通过与靶向mRNAs的3′非翻译区(3′-UTR)结合调节基因表达[5]。miRNA在肺癌进展过程中的异常表达与细胞增殖、侵袭、迁移和化疗耐药密切相关[6]。据报道,miR-15a-5p作为一种肿瘤抑制因子,在胃癌、甲状腺乳头状癌和前列腺癌中表达下调[7]。最近,miR-15a-5p被报道通过抑制组蛋白乙酰化抑制肺癌转移和脂质代谢[8]。在多发性骨髓瘤中,miR-15a-5p参与了外泌体相关miRNAs耐药性[9]。尽管miR-15a-5p参与了肿瘤生长过程中的化疗耐药,但其对肺癌DOX耐药的作用尚不清楚。该研究探讨了miR-15a-5p在肺癌细胞对DOX耐药中的作用,并阐明其与DOX耐药之间的功能和机制联系。
1 材料与方法
1.1 细胞与培养人肺癌细胞系A549购自美国ATCC公司,将细胞培养在含有10%胎牛血清(FBS,美国Hyclone公司)、100单位/ml青霉素和100 mg/ml链霉素的RPMI-1640培养基(美国Gibco公司)。A549/DOX抗性细胞(A549/D)购自武汉普诺赛生命科技有限公司。A549/D是通过在DMEM中逐渐提高DOX浓度(0.01 mg/L~1 mg/L)来筛选出具有抗药性的细胞,将A549/D细胞连续暴露于DOX(1 mg/L)下,维持细胞的耐药性。
1.2 体外转染广州锐博生物技术有限公司合成miR-15a-5p模拟物、siRNA敲低miR-15a-5p(si-miR-15a-5p)及其相应的阴性对照(NC)寡核苷酸。使用Lipofectamine 3000(美国Invitrogen公司)进行所有转染。
1.3 细胞活力分析将转染处理后的细胞(1×104个/孔)接种到96孔培养板中。孵育4 h后,向每个孔中加入10 μl MTT溶液(美国Sigma公司),继续孵育4 h。离心,吸出含有MTT的培养基,然后加入100 μl DMSO。用Mithras2LB943全功能微孔板分析仪(美国Berthold Technologies公司)在490 nm下测量每个孔的光密度。未经处理的细胞作为对照。细胞存活率(%)=吸光度处理组/吸光度对照组×100。细胞毒性表现为DOX抑制50%细胞生长的浓度(IC50)。
1.4 细胞凋亡测定收集处理后细胞并用PBS洗涤2次,使用FITC Annexin V凋亡检测试剂盒I(美国BD Biosciences公司)对细胞进行双重染色。然后,用流式细胞仪(美国BD Biosciences公司)分析标记细胞。
1.5 蛋白质印迹分析用蛋白裂解缓冲液(南京Beyotime公司)从细胞中提取总蛋白。裂解物在十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)前变性,然后转移到聚偏二氟乙烯(PVDF)膜(美国Millipore公司)。然后,在室温下用5%脱脂牛奶封闭膜1.5 h,在4 ℃下与一级抗体孵育过夜。接下来,用二级抗体(南京Beyotime公司)进一步孵育细胞膜1 h。最后用增强化学发光试剂(ECL,美国Pierce公司)观察免疫反应信号。研究中使用的主要抗体如下:抗波形蛋白(美国Abcam公司)、抗E-钙粘蛋白及抗N-钙粘蛋白(美国ThermoFisher Scientific公司)、抗P53(Abcam)和抗GAPDH(Abcam)。
1.6 实时定量PCR(RT-qPCR)分析使用RNAeasy迷你试剂盒(美国Qiagen公司)从培养细胞中提取总RNA,并使用高容量逆转录试剂盒(美国Applied Biosystems公司)进行逆转录。然后,在ABI7900HT实时PCR系统(Applied Biosystems)上使用GoTaq qPCR Master Mix(美国Promega公司)进行qPCR分析。所有结果均采用2-ΔΔCt法进行分析。miRNA表达水平标准化为U6。U6和miR-15a-5p的引物购自上海捷瑞生物工程有限公司。用于qPCR的引物序列如下:miR-15a-5p(正向)5′-ACACTCCAGCTGGGAAACCGTTACCATTAC-3′,(反向)5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAG TTGAGCTTACA-3′;U6(正向)5′-GCTTCGGCAC ATATACTA-3′,(反向)5′-AACGCTTCAATTTGC-3′。
1.7 生物信息学预测与双荧光素酶报告子分析在荧光素酶报告实验中,用PCR方法从人基因组DNA中扩增出含有miR-15a-5p结合序列的P53基因3′UTR片段的野生型(WT)。为了检测miR-15a-5p是否调控P53的表达,研究合成了含有miR-15a-5p靶结合位点的野生型P53及其突变体,并将其插入pGL3荧光素酶载体(美国Promega Corporation公司)的3′UTR中。然后用Lipofectamine 3000将WT或突变型(MT)pGL3-P53-3′UTR与miR-NC、miR-15a-5p、抗miR-NC或抗miR-15a-5p联合转染。转染后24 h收获细胞,使用双荧光素酶报告试剂盒(美国Promega Corporation公司)测量荧光素酶活性,并与Renilla荧光素酶活性进行标准化。
1.8 裸鼠移植瘤共24只雌雄各半BALA/C裸鼠(年龄4~6周;体质量:18~24 g;上海杰思捷实验动物有限公司,生产许可证:[SCXK(沪)2018-0004],小鼠左侧皮下注射A549/D细胞(5×106)。肿瘤体积达到50 mm3后,将小鼠随机分为4组:①PBS组;②DOX组(2 mg/kg,每2 d 1次);③ miR-15a-5p agomir组(小鼠2 nmol/只,每3 d 1次),或④ DOX联合miR-15a-5p agomir组。miR-15a-5p agomir由miR-15a-5p模拟物化学修饰而成。每3 d用游标卡尺测量一次肿瘤大小,用游标卡尺测量肿瘤结节最大轴径(A)和最小轴径(B),肿瘤体积(TV)=(A×B2)/2。第30天,对裸鼠进行安乐死和解剖。每组取3个肿瘤组织作石蜡切片。
1.9 免疫组织化学染色肿瘤组织用4%福尔马林固定,石蜡包埋。组织切片(4 μm厚)在二甲苯中脱蜡,在一系列分级乙醇中再水化,并通过煮沸回收抗原。用10%山羊血清(北京Solarbio公司)阻断内源性过氧化物酶活性30 min,并与兔抗鼠P53(1 ∶1 000;美国Abcam公司)在4 ℃下孵育过夜。第二天,切片在室温下与山羊抗兔IgG(1 ∶100;美国Abcam公司)孵育30 min,然后与HRP标记的链霉亲和素反应30 min。最后,用3,3′-二氨基联苯胺溶液(DAB,Solarbio)显影切片,苏木精复染后,用中性香脂密封,在光学显微镜下观察切片。
2 结果
2.1 miR-15a-5p的过度表达使肺癌细胞对DOX治疗敏感MTT分析显示,A549/D对DOX处理表现出最高的活性(IC50值:8.63±0.26 μmol/L),而A549细胞表现出最低的细胞活性(IC50值:0.77±0.08 μmol/L)(图1A)。为了探讨miR-15a-5p在肺癌细胞化疗耐药中的作用,检测了miR-15a-5p在有无耐药的肺癌细胞中的表达。如图1B所示,与A549细胞相比,A549/D细胞中miR-15a-5p的表达降低。然后,在A549/D细胞中增强miR-15a-5p的表达,并降低其在A549细胞中的表达,用RT-qPCR证实转染效率(图1C、D)。采用MTT法检测不同剂量DOX处理24 h后si-miR-15a-5p转染的A549细胞和miR-15a-5p模拟物转染的A549/D细胞的存活率情况,miR-15a-5p的敲低提高了A549细胞的细胞活力(IC50值:8.86±0.32 μmol/L),miR-15a-5p的过表达降低了A549/D细胞的细胞活力(IC50值:1.92±0.11 μmol/L)(图1E、F)。为了确定miR-15a-5p是否调节细胞凋亡,对肺癌细胞进行了流式细胞术分析。结果发现,在A549细胞中干扰miR-15a-5p表达减少凋亡(t=29.406,P<0.001),在A549/D细胞中增加miR-15a-5p表达促进凋亡(t=36.281,P<0.001)(图1G、H)。

图1 miR-15a-5p的过度表达使肺癌细胞对DOX治疗敏感
2.2 miR-15a-5p调控肺癌细胞的上皮间充质转化(Epithelialmesenchymal transition,EMT)研究进一步考察了EMT是否与肺癌细胞中miR-15a-5p调节的DOX敏感性有关。如图2A所示,DOX处理使A549细胞中的N-钙粘蛋白和波形蛋白表达水平降低,而E-钙粘蛋白上调,表明肺癌细胞中的EMT降低。同时,DOX诱导A549细胞中miR-15a-5p表达水平增加(图2B)。通过转染si-miR-15a-5p逆转了DOX对EMT的抑制作用(图2C)。
2.3 miR-15a-5p与P53结合为了探索miR-15a-5p调节A549细胞化疗敏感性的机制,利用预测算法,包括TargetScan、starbase、exiqon和miRDB来识别miR-15a-5p的潜在靶基因。生物学预测结果证明P53和miR-15a-5p之间存在特异性结合位点(图3A-B)。为了证实miR-15a-5p是否能直接靶向P53,在A549和A549/D细胞中构建了含有P53 3’UTR结合位点WT或MT的载体。如图3C和D所示,在A549细胞中,下调miR-15a-5p降低WT P53报告基因的荧光素酶活性,而在A549/D细胞中,过表达miR-15a-5p提高WT P53报告基因的荧光素酶活性。然而,在A549和A549/D细胞中,突变的MT P53组均未观察到这些作用,提示P53是miR-142-3p的靶基因。随后进行Western blot检测P53蛋白水平。如图3E和F所示,在A549细胞中干扰表达miR-15a-5p减少P53蛋白表达(P<0.001),在A549/D细胞中增加miR-15a-5p表达增加P53蛋白表达(P<0.01)。
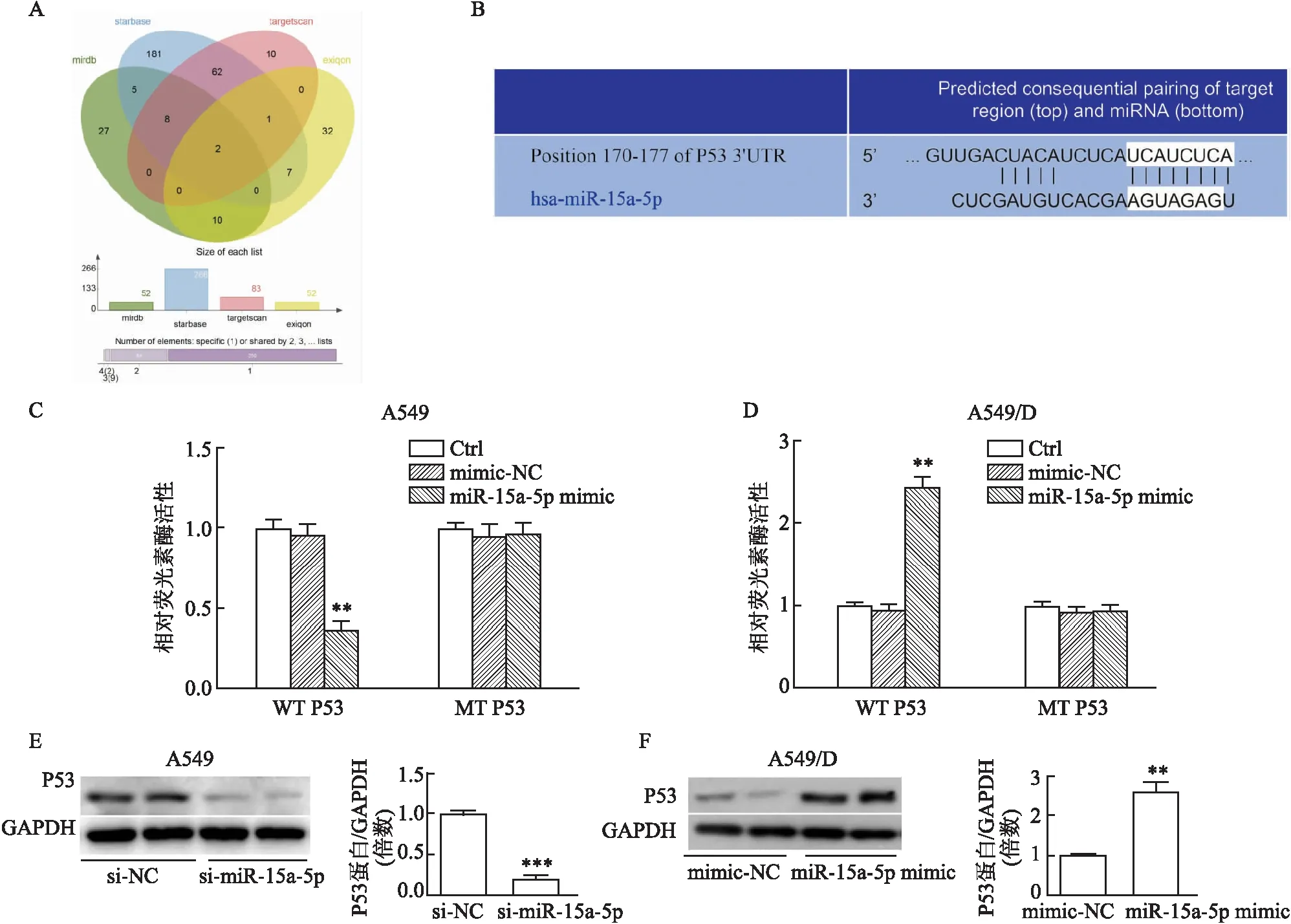
图3 miR-15a-5p通过结合P53的3’UTR促进P53表达
2.4 miR-15a-5p过表达促进DOX的体内抗肿瘤作用通过体内实验进一步研究miR-15a-5p对DOX抗性的影响。如图4A、B所示,miR-15a-5p agomir联合DOX可降低肿瘤体积。免疫组化染色显示,与miR-15a-5p agomir和DOX联合治疗的小鼠肿瘤切片中P53增加(图4C)。Western blot结果显示,DOX和miR-15a-5p agomir联合治疗降低了肿瘤样本中N-cadherin的表达水平,同时增强了P53、E-cadherin蛋白的表达水平(图4D)。总之,这些结果表明miR-15a-5p的过度表达促进了肺癌治疗的药物敏感性。

图4 miR-15a-5p的过度表达促进了DOX在体内的抗肿瘤作用(n=6)
3 讨论
尽管DOX的应用提高了肺癌患者的生存率,但其耐药性限制了其广泛应用,导致治疗失败[4]。对化疗的治疗抵抗是肺癌和其他癌症患者面临的全球性健康挑战。大量的研究工作已经被引导到寻找潜在的驱动基因和预测治疗反应和确定替代治疗。在肺癌的发展过程中,miRNA的异常表达是常见的,这也与化疗耐药有关[3]。然而,miRNAs的调控作用相当复杂,其对肺癌耐药的影响尚不清楚。miR-15a-5p被认为在不同类型的癌症中发挥抑癌作用,如前列腺癌、胃癌和黑色素瘤等[8-9]。因此,miR-15a-5p有望成为肿瘤治疗的靶点。本研究发现A549/D细胞中miR-15a-5p的表达低于A549细胞,并且miR-15a-5p增强了肺癌细胞对DOX的敏感性,减少了A549细胞的增殖,促进了A549细胞的凋亡。这些结果表明miR-15a-5p是肺癌进展过程中的关键调节因子。此外,荧光素酶活性测定显示,miR-15a-5p的过度表达通过结合与种子区互补的3′UTR基序促进P53的表达。这些发现提示miR-15a-5p可能作为一个潜在的生物标志物来预测患者对DOX化疗的反应。
越来越多的研究表明,EMT是上皮细胞向间充质细胞转化的生物学过程。EMT在调节肿瘤发病机制中起着重要作用[10]。EMT激活在包括肺癌在内的各种类型肿瘤的进展过程发挥重要作用[10]。异常EMT促使癌细胞具有高度恶性的特性,包括侵袭、迁移以及远处转移[10]。此外,大量研究表明,EMT有助于肿瘤细胞化疗耐药的发展[11]。最近的证据表明,miR-200a、miR-200b、miR-429、miR-200c和miR-141等miRNAs可以抑制ZEB1/2和β-catenin来中断EMT信号[12]。相反,miR-221和miR-222靶向TRPS1,导致E-钙粘蛋白表达减少,从而促进EMT[13]。在本研究中,miR-15a-5p的过表达降低了波形蛋白和N-钙粘蛋白的表达,增加了E-钙粘蛋白的表达,提示miR-15a-5p通过介导EMT抑制肺癌细胞的DOX抵抗。
生物信息学分析证实P53是肺癌细胞中miR-15a-5p的一个靶基因。研究结果表明miR-15a-5p敲除导致肺癌细胞P53减少,而miR-15a-5p过表达导致P53增加。肿瘤蛋白P53是目前研究最多的抑癌基因之一。P53通过诱导细胞周期阻滞、DNA修复或凋亡来抑制肿瘤的形成并保护DNA免受损伤[14]。P53的抑制被证明与肺癌患者的耐药性和预后有关,增加P53表达可提高肺癌细胞对顺铂治疗的敏感性[14]。因此,P53是调控肺癌细胞化疗耐药的关键分子。最近的研究表明,miR-125b、miR-504、miR-25和miR-30d等miRNAs可以调节P53的丰度和活性,并对P53产生负性调节[15]。因此,推测P53可能参与miR-15a-5p介导的DOX耐药。为此,研究首先检测了miR-15a-5p对A549和A549/D细胞P53表达的影响。结果显示,在A549细胞中阻断miR-15a-5p减少P53蛋白表达,A549/D细胞中miR-15a-5p过表达增加了P53蛋白水平。此外,通过体内实验证实P53是miR-15a-5p的一个功能性靶基因,参与调控肺癌的DOX抗性。这些发现支持miR-15a-5p在肺癌化疗耐药中调节P53通路的主要作用。
