HB-EGF和uPAR在子痫前期中发病的联系
2022-08-04谢丝雨
陈 繁,张 英,谢丝雨
子痫前期(preeclampsia,PE)是妊娠所特有的疾病,若进一步发展为子痫,可引起孕产妇抽搐,对心脏、肝脏、肾脏等各重要器官造成不可逆的功能损害。同时子痫前期孕妇宫内环境较差,引起胎儿慢性缺氧,导致胎盘早剥,造成胎死宫内等不良妊娠结局[1]。一项荟萃实验表明,患有子痫前期的孕妇,以后患高血压的概率是正常人4倍,患心脏病的概率比正常人高两倍[2]。目前有证据支持胎盘在疾病的发生中起着重要的作用,终止妊娠娩出胎盘才能阻止疾病的发展。滋养细胞异常浸润导致螺旋动脉的重铸缺陷、内皮细胞功能障碍是目前的共识[3]。本研究主要探究肝素结合型表皮生长因子(hepafin-binding epidermal growth factor-like growth factor,HB-EGF)和尿激酶型纤溶酶原激活剂受体(urokinase-type plasminogen activator receptor,uPAR)是否与子痫前期的发病相关。
1 材料与方法
1.1 病例资料首先选择2018—2020年安徽医科大学第一附属医院产科住院分娩孕妇80例,其中30例正常足月妊娠,50例子痫前期病例,随机选取其中4例子痫前期患者以及3例正常足月妊娠患者的血清进行蛋白芯片技术筛选差异性蛋白。其子痫前期组纳入标准参照美国妇产科医师协会(ASOG)于2020年发布的对于子痫前期的诊断[4],纳入标准:① 妊娠20 周后出现收缩压≥140 mmHg和/或舒张压≥90 mmHg,伴尿蛋白阳性;② 无蛋白尿但合并以下任何一项者:血小板减少;肝功能异常;肾功能损害;肺水肿;新发的中枢神经系统异常或视觉障碍。排除标准:① 既往患高血压;② 糖尿病;③ 甲状腺功能异常;④ 妊娠期肝内胆汁瘀积症;⑤ 肝脏以及肾脏疾病等合并症的孕妇。研究对象均无吸烟史以及长期服药史。所有参与患者均为剖宫产方式终止妊娠并均签署知情同意书,本研究获得安徽医科大学附属第一医院伦理委员会批准(批号:P2020-12-22)。
1.2 标本保存和试剂于孕妇手术当天空腹采取静脉血2~3 ml,室温25 ℃静置30 min,2 h后离心(3 000 r/min,10 min),收取上清液,分装后置于-80 ℃冰箱中保存。术中收集胎盘组织浸泡于5倍体积的RNAlater液中,4 ℃过夜,转移至-80 ℃冰箱保存。样本使用时在常温融化后研磨提取RNA。酶联免疫吸附法(ELISA)试剂盒购自美国R&D system公司;抗体购自美国GeneTex公司;GSH-CAA-400试剂盒购自美国RayBiotech公司;组织RNAFixer储存液购自北京普鲁顿生物科技有限公司;TRIzol试剂购自美国Invitrogen生物有限公司,引物由上海生工生物工程有限公司设计,并购自该公司。
1.3 抗体芯片技术从患者获得的血清用于鉴定基因通过人类细胞因子抗体阵列显示子痫前期患者中的差异表达。实验步骤按照GSH-CAA-400试剂盒说明书严格进行。具体步骤如下:将样品稀释液与玻片芯片室温反应1 h后,抽去稀释液后,加入样品4 ℃孵育过夜,在用专用洗涤液充分洗涤,洗去非特异性结合物,加入检测抗体,室温摇床孵育2 h,再次充分洗涤后,加入Cy3-链霉亲和素后,室温避光摇床孵育1 h后,运用InnoScan 300微阵列扫描仪,使用RayBiotech分析工具对数据进行标准化。再将原始数据进行归一化处理,运用Normalization 数据来做分析并进行组间比较。
1.4 ELISA采用ELISA试剂盒检测血清中HB-EGF、uPAR中的浓度。ELISA实验前,将所收集的样本置入冰上解冻,涡旋混匀。HB-EGF血清样本未进行稀释,uPAR血清样品运用样品稀释液稀释5倍,涡旋进行混匀。每个孔加入100 μl的RD1W分析稀释液后,标准孔加入50 μl标准品,实验孔加入50 μl的稀释后的血清样本,室温孵育2 h,充分洗涤,向每孔加入200 μl的uPAR结合物或者HB-EGF结合物,室温孵育2 h,再次进行充分洗涤,向每孔加入200 μl提前配好显色剂避光孵育30 min,每孔加入50 μl终止液,在30 min内放上酶标仪上测定450 nm处的吸光度值。根据标准孔计算标准曲线,根据标准曲线计算每个孔对应的浓度值。
1.5 实时荧光定量PCR将胎盘组织进行剪碎,加入1 ml TRIzol,用匀浆仪进行匀浆处理,室温静置30 min,取澄清的匀浆液,加入200 μl三氯甲烷,剧烈震荡后室温放置30 min,4 ℃ 、10 000 r/min离心15 min,把水相转移到新EP管中,加入异丙醇500 μl沉淀水相中的RNA,室温放置60 min。4 ℃、10 000 r/min离心10 min,去上清,用含DEPC的70%乙醇洗涤,4 ℃、7 500 r/min离心10 min,弃上清,用DEPC水溶解RNA沉淀,测定RNA浓度和纯度。按照试剂盒说明书严格操作将RNA逆转录合成cDNA。引物序列(5′-3′)分别为uPAR 上游:5′-GGTGAAGAAGGGCGAAAGG-3′,下游:5′-CCAGAGTAGCGTTCGAGTG-3′; HB-EGF上游:5′-TTATCCTCCAAGCCACAAGCACTG-3′,下游:5′-GATGACCAGCAGACAGACAGATGAC-3′;内参β-actin 上游:5′-GTGGCCGAGGACTTTGATTG-3′,下游:5′-CCTGTAACAACGCATCTCATATT-3′。PCR反应体系为20 μl,反应条件95 ℃、30 s,95℃、5 s,60 ℃、34 s,40个循环。同时每个样本设置复孔,采用2-△△ct计算uPAR和HB-EGF的表达水平,其中ct值为循环阈值。
1.6 免疫组化采用免疫组化SP法检测蛋白表达水平。组织标本切片置于65 ℃烤箱中烘烤60 min后,立即置于二甲苯中15 min,梯度乙醇脱水,水平摇床上用PBS液浸洗3遍,室温下将切片置于0.3% Triton X-100中30 min,枸橼酸盐缓冲液中高压修复,自然冷却,切片浸于PBS液浸洗3遍;山羊血清37 ℃封闭1 h,轻轻甩去血清,一抗HB-EGF按1 ∶50稀释,uPAR按1:700稀释,阴性对照采用PBS代替一抗,4 ℃过夜,PBS浸洗3次,二抗37 ℃孵育30 min后DBA显色,将片子从温箱中取出, 放入PBS中洗3次,每次5 min,擦干组织周围的PBS后加上显色剂。将显色后的片子用清水冲洗复染。结果判定由本院病理科医生阅片后判定。以细胞膜出现黄色或棕褐色颗粒者为阳性细胞,根据每份标本中的阳性细胞染色强度所占百分比进行评定,采用Image J进行平均吸光密度值分析。
1.7 统计方法应用SPSS 21.0软件进行统计学分析。先判断计量资料是否符合正态分布,若计量资料符合正态分布,则以进行描述,并且两组数据运用t检验的方式,若计量资料不符合正态分布,数据运用中位(四分位间距)进行描述,运用非参数检验等统计学方法进行分析,以P<0.05为差异有统计学意义。
2 结果
2.1 样本临床数据对纳入研究的孕妇年龄、体质指数(body mass index,BMI)、孕周、收缩压、舒张压、新生儿出生体质量、Aparg评分、NICU住院时间等临床信息进行统计,见表1。子痫前期组与正常孕妇相比,年龄和BMI (P>0.05),终止妊娠孕周(P<0.05),收缩压、舒张压、新生儿出生体质量、1和5 minApgar评分比较(P<0.01)。

表1 样本临床信息
2.2 差异表达蛋白筛选使用RayBiotech分析工具对抗体芯片筛查原始数据用软件归一化后,选择Normalization数据来做分析。采用P值和Foldchange对差异蛋白进行筛选,P<0.05且Foldchange < 0.83 或者>1.2,在筛选出的12个差异蛋白中有10个蛋白在子痫前期中上调,IL-2Ra、IL-23、VEGFR1、Nidogen-1、Thrombomodulin、Transferrin、IP-10、Insulin、IL-10、uPAR;2个蛋白在子痫前期中下调,CEACAM-1及HB-EGF。见表2。

表2 抗体芯片技术筛选子痫前期与正常孕妇的差异蛋白
2.3 子痫前期组和对照组血清中HB-EGF与uPAR的浓度本次研究共筛选了12个蛋白指标,通过大量阅读文献,选取其中2个差异蛋白,即 HB-EGF和uPAR。HB-EGF的ELISA结果的数据资料显示其为偏态分布,子痫前期组为43.19(61.18) ng/L,对照组65.82(21.85) ng/L,子痫前期患者血清中的HB-EGF的浓度是低于正常孕妇组,P=0.043,两组差异有统计学意义。见图1A。uPAR的ELISA实验结果的数据资料显示其呈现正态分布,子痫前期组为(2 143.65±810.97) ng/L,对照组为(1315.11±191.35)ng/L,子痫前期患者血清中uPAR的浓度是高于正常孕妇组,差异具有统计学意义(t=2.907,P=0.006)。见图1 B。见图1B。

图1 HBF、uPAR在各组血清中的浓度分布
2.4 子痫前期组和对照组胎盘uPAR及HB-EGF的表达应用 qRT-PCR技术测定胎盘中uPAR mRNA及HB-EGF mRNA的表达,其结果显示,不论是正常胎盘还是子痫前期胎盘中uPAR的表达量极低,甚至不表达(结果未显示),子痫前期组胎盘中HB-EGF mRNA表达量(0.74±0.17),正常对照组(0.29±0.19),差异有统计学意义(t=3.764,P=0.006)。进一步采用免疫组织化学的方法比较子痫前期患者和正常妊娠对照组胎盘中uPAR及HB-EGF的蛋白表达。uPAR在正常孕妇及子痫前期患者胎盘呈阳性表达(图2A、B),在子痫前期患者胎盘中的表达低于正常孕妇,正常孕妇吸光度值中位数10.367(5.61),子痫前期孕妇组平均吸光度值中位数6.01(7.61),运用非参数检验,P=0.037,差异有统计学意义。HB-EGF在正常妊娠中呈阳性表达,在子痫前期组表达量极低,甚至不表达(图2C、D),通过测量平均光密度,数据资料呈正态分布,在正常孕妇组平均光密度值(7.91±1.66),子痫前期组平均光密度值(3.91±2.67),差异有统计学意义(t=3.004,P=0.009)。
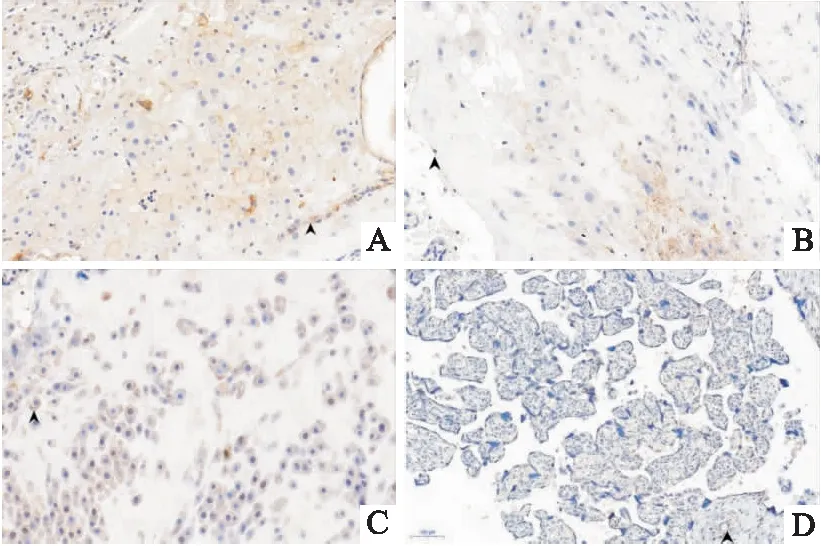
图2 胎盘HB-EGF及uPAR在子痫前期及对照组中的免疫组化 ×400
3 讨论
本研究通过蛋白质芯片技术对子痫前期孕妇和正常孕妇血清中440种细胞因子进行分析,筛选出了12个差异蛋白。这些差异蛋白在炎症反应、细胞分化及迁移、凝血酶异常等方面具有关键作用,为子痫前期发病机制的深入研究提供了方向及依据。HB-EGF和uPAR与滋养细胞的侵袭能力有关,在胚胎着床中起着关键作用,并且目前对于这两种蛋白的研究较少。
HB-EGF可激活表皮生长因子家族中ERBB/HER酪氨酸激酶受体,将生长因子的信号传导到细胞内,调节细胞对外界的刺激反应、细胞增殖、存活、黏附、迁移和分化等,对于胚胎发育是必需的[5]。它处于与子痫前期相关的病理生理异常的交汇点,即它的活性调节着滋养细胞浸润或滋养细胞细胞凋亡[6]。子痫前期患者的胎盘显示滋养细胞凋亡增加,而HB-EGF的外源性应用可防止细胞凋亡及缺血再灌注损伤,HB-EGF的下降可以导致保护细胞免受氧化应激和内皮功能障碍的细胞系统失衡,尤其在妊娠早期,HB-EGF的缺乏可以阻碍细胞滋养层干细胞向绒毛外表型转化构成了先兆子痫的关键因素[7]。uPA系统在细胞侵袭、黏附和迁移中起着关键作用[8]。uPA可与uPAR结合,促进基质金属蛋白酶(MMPs)的分泌。MMPs能够降解细胞外基质中的成分,从而促进细胞入侵,MMPs的降低已证明与子痫前期有关[9]。
该研究通过比较子痫前期患者和正常妊娠对照组血清及胎盘中uPAR和HB-EGF的表达量,结果表明uPAR在子痫前期患者血清中表达升高,胎盘中表达失衡,mRNA表达水平极低甚至无表达,蛋白表达水平低于正常孕妇组。HB-EGF在子痫前期组血清中表达降低,胎盘中mRNA水平表达量降低,蛋白水平表达量降低,甚至无表达,由此推测它们在子痫前期的发病中起保护性作用,相关的发病机制涉及滋养细胞的迁移侵袭以及血管内皮功能失调。
目前的实验设计在选择临床样本时只考虑了子痫前期这一影响因素,忽略了孕周对于胎盘蛋白的表达可能存在的潜在影响,所以标本的收集存在对照组及子痫前期组孕周不匹配的情况,接下来会进一步选取孕周匹配的对照组进行研究,同时也会将分组细化到孕周,了解不同孕周uPAR及HB-EGF的表达是否有差异,从而为子痫前期发病机制的研究以及临床预测治疗提供更多有效的线索。
