脂肪酶Rhizopus chinensis催化水解大豆粉末磷脂制备L-α-甘油磷脂酰乙醇胺
2022-08-04李子怡张丽霞张康逸申瑞玲
李 红,李子怡,张丽霞,张康逸,申瑞玲,魏 涛
(1.郑州轻工业大学 食品与生物工程学院,郑州 450000; 2.河南省农业科学院 农副产品加工研究中心,郑州 450002)
L-α-甘油磷脂酰乙醇胺(L-α-GPE)是生物膜主要组分脑磷脂(PE)、磷脂酰胆碱等的前体物质[1-2],主要存在于猪、兔、牛等动物的肝、脾、肾和脑中[3-4],在磷脂的生物合成和乙醇胺的释放中起重要作用。已有研究证明,L-α-GPE对治疗老年性脑病变、退化性和脑瓣膜功能不全等病症(如精神活动减慢、记忆力减退、情绪低落等)具有一定疗效[5-7],这促使人们探索其作为医药和食品添加剂的可行性。
目前,L-α-GPE主要通过从生物组织器官中提取[8]、水解缩醛磷脂[9]、化学合成[10]和醇解蛋黄磷脂或大豆粉末磷脂[11]等方法制备。然而,使用这些方法制得的L-α-GPE在产品纯度、比旋光度和环境污染等方面都存在一定问题。如:从生物组织器官中提取受原料的限制,难以工业化生产;缩醛磷脂在水解过程中由于使用一定配比的醋酸、盐酸和氯化汞作为酸性催化剂会引起设备腐蚀和重金属污染问题[9];醇解蛋黄磷脂或大豆粉末磷脂的L-α-GPE得率、纯度相对较低。脂肪酶催化水解磷脂制备L-α-GPE具有催化效率高、反应条件温和、设备要求不高、生产成本低等优势,备受关注。本课题组曾以脂肪酶Thermo4S-3为催化剂,研究了水相体系中水解大豆粉末磷脂制备L-α-GPE,得率达93.6%[12]。脂肪酶Rhizopuschinensis(三酰甘油酰水解酶,E.C.3.1.1.3)作为催化剂,在结构脂的制备中得到广泛应用[13]。然而,脂肪酶Rhizopuschinensis水解大豆粉末磷脂制备L-α-GPE的研究未见报道。基于此,本文采用脂肪酶Rhizopuschinensis催化水解大豆粉末磷脂制备L-α-GPE,通过单因素实验优化了脂肪酶Rhizopuschinensis催化制备L-α-GPE的工艺条件,并对其进行分离纯化和结构鉴定,以期为工业制备L-α-GPE提供一种新的方法。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
大豆粉末磷脂(食品级,磷脂含量96%,主要成分为15%磷脂酰胆碱、20%磷脂酰乙醇胺、20%磷脂酰肌醇、5%磷脂酸),天津博帅工业贸易有限公司;PE和L-α-GPE标准品、色谱级氯仿和甲醇,Sigma公司;脂肪酶Rhizopuschinensis(酶活力9 000 U/g),江南大学生物工程实验室赠送;离子交换树脂,苏青集团;柱层析用硅胶〔0.075~0.150 mm(100~200目),含水量3%〕,青岛海阳化工有限公司;其他试剂均为分析纯。
1.1.2 仪器与设备
RE-52 旋转蒸发仪,JJ-1B 强力恒速电力搅拌器,HH-4 数显恒温水浴锅,AR2140 电子精密天平,Waters 1525 HPLC,Waters 2424 ELSD 检测器,470 Nicolet ATR-FTIR傅里叶变换衰减全反射红外光谱仪,Waters Synapt Q-TOF超高效液相色谱电喷雾四极杆飞行时间质谱(UPLC-Q-TOF-MS)仪。
1.2 实验方法
1.2.1 脂肪酶Rhizopuschinensis催化水解大豆粉末磷脂制备L-α-GPE
称取一定量大豆粉末磷脂于50 mL 三颈圆底烧瓶,加入10 mL一定pH的磷酸盐缓冲溶液,在一定温度、450 r/min转速下磁力搅拌20 min制成大豆粉末磷脂溶液,再添加一定量的无水CaCl2和脂肪酶Rhizopuschinensis进行水解反应15 h。反应完成后,水解液于80℃下真空浓缩后得到浓缩液。将浓缩液溶于相同体积氯仿-甲醇(体积比2∶1)溶液中,10 000 r/min 离心5 min,取上清液测定L-α-GPE纯度,并参照文献[12]计算L-α-GPE得率。
1.2.2L-α-GPE纯度的测定
采用HPLC-ELSD测定L-α-GPE的纯度。HPLC-ELSD 条件:Lichrospher Si column硅胶柱(25 cm×0.46 cm, 5 μm) ,柱温 35℃;进样量5 μL;流速 0.97 mL /min;采用二元梯度洗脱,流动相 A为甲醇,流动相 B 为甲醇-水(体积比8∶1);梯度洗脱程序为0~10 min 40%B增加到60%B,10~15 min 60%B,15~18 min 60%B降低到40%B。
1.2.3 结构鉴定
1.2.3.1 红外光谱分析
参照文献[14]方法对按1.2.1方法得到的浓缩液进行分离纯化后,采用傅里叶变换红外光谱进行结构分析。
傅里叶变换红外光谱分析条件:样品经KBr压片,波数范围250~4 000 cm-1。
1.2.3.2 UPLC-Q-TOF-MS分析
将1.2.3.1得到的纯化的L-α-GPE用色谱纯甲醇溶解后进行UPLC-Q-TOF-MS分析。
UPLC条件:ACQUITY UPLC BEH HILIC分析柱(2.1 mm×100 mm,填料粒径1.7 μm),柱温35℃;流动相A为100%乙腈,流动相B为20 mmol/L醋酸氨,流速0.3 mL/min,等度洗脱。
MS条件:Waters Synapt Q-TOF系统,电喷雾离子源(ESI),正离子扫描模式,离子源温度120℃,毛细管电压3 000 V,锥孔电压30 V,锥孔气流量50 L/h,雾化器温度420℃,雾化气流量500 L/h,质量扫描范围(m/z) 50~1 000。
2 结果与讨论
2.1 单因素实验
2.1.1 pH 对L-α-GPE得率的影响
酶的稳定性是决定反应得率的重要因素,而pH显著影响酶的稳定性,因此不同pH会对酶催化水解反应产生较大影响。在大豆粉末磷脂质量浓度10 mg/mL、反应温度55℃、CaCl2质量浓度3.33 mg/mL(在体系中的终质量浓度,下同)和Rhizopuschinensis浓度63.3 U/mL(在体系中的终浓度,下同)条件下,反应15 h,测定不同pH下L-α-GPE得率,结果见图1。

图1 pH对L-α-GPE得率的影响
由图1 可看出:随着pH的升高,L-α-GPE得率逐渐升高;在pH为7时,L-α-GPE得率最高,这可能与脂肪酶Rhizopuschinensis在此pH下活性最高,其活性部位易与PE结合[15],易于L-α-GPE的生成有关;继续升高pH,L-α-GPE得率降低。因此,选择最适pH为7。
2.1.2 大豆粉末磷脂质量浓度对L-α-GPE得率的影响
在pH 为7,大豆粉末磷脂质量浓度分别为2.5、3.75、5、7.5、10、15、30 mg/mL,反应温度为55℃,CaCl2质量浓度为3.33 mg/mL和Rhizopuschinensis浓度为63.3 U/mL条件下,反应15 h,测定不同大豆粉末磷脂质量浓度下L-α-GPE得率,结果见图2。
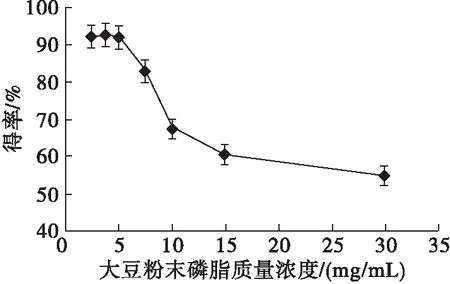
图2 大豆粉末磷脂质量浓度对L-α-GPE得率的影响
由图2 可看出,在大豆粉末磷脂质量浓度低于5 mg/mL时,L-α-GPE得率较高,在大豆粉末磷脂质量浓度高于5 mg/mL时,L-α-GPE得率随大豆粉末磷脂质量浓度增大显著降低。磷脂结构中的亲水基团和疏水基团使其在水中的溶解度很低,只能以胶束形式存在;浓度较低时,磷脂以单分子或小聚集体的形式分散于缓冲溶液中,磷脂液滴的界面面积较大,易与酶结合而被水解;然而,当磷脂浓度超过临界胶束浓度时,磷脂分子逐渐聚集,界面面积减小,磷脂的水解速率降低[16]。图2显示大豆粉末磷脂质量浓度超过5 mg/mL时,L-α-GPE得率出现明显转折,推测该浓度可能接近磷脂的临界浓度,因此选择大豆粉末磷脂质量浓度为5 mg/mL。
2.1.3 反应温度对L-α-GPE得率的影响
在pH为7、大豆粉末磷脂质量浓度为5 mg/mL、CaCl2质量浓度为3.33 mg/mL和Rhizopuschinensis浓度为63.3 U/mL条件下,反应15 h,测定不同反应温度下L-α-GPE得率,结果见图3。
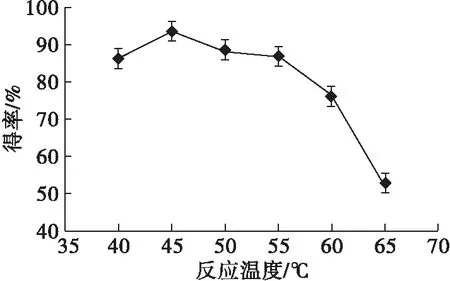
图3 反应温度对L-α-GPE得率的影响
由图3可知,随着反应温度的升高,L-α-GPE得率增加,45℃时L-α-GPE得率达到最大值,继续升高反应温度,L-α-GPE得率反而下降,这可能与温度升高会引起酶构象和稳定性发生变化有关[17]。因此,选择最适反应温度为45℃。
2.1.4 CaCl2质量浓度对L-α-GPE得率的影响
在pH为7、大豆粉末磷脂质量浓度为5 mg/mL、反应温度为45℃、Rhizopuschinensis浓度为63.3 U/mL条件下,反应15 h,测定不同CaCl2质量浓度(0.33、0.67、2.00、3.33、5.33、6.67 mg/mL)下L-α-GPE得率,结果见图4。

图4 CaCl2质量浓度对L-α-GPE得率的影响
脂肪酶Rhizopuschinensis的活性部位通常被包裹在螺旋结构内部,Ca2+能与酶发生配位作用,使酶的C端螺旋结构伸展[18],从而可以提高脂肪酶Rhizopuschinensis的催化活性,因此CaCl2浓度会对L-α-GPE得率产生一定的影响。
由图4可看出,CaCl2质量浓度由0.33 mg/mL增大到2 mg/mL时,L-α-GPE得率显著增加,继续增加CaCl2的质量浓度,L-α-GPE得率趋于平稳,可能因为CaCl2质量浓度为2 mg/mL时即与酶完全配位,因此选择CaCl2质量浓度为2 mg/mL。
2.1.5 酶浓度对L-α-GPE得率的影响
在pH 为7、大豆粉末磷脂质量浓度为5 mg/mL、反应温度为45℃、CaCl2质量浓度为2 mg/mL条件下,反应15 h,测定不同Rhizopuschinensis浓度下L-α-GPE得率,结果见图5。

图5 酶浓度对L-α-GPE得率的影响
由图5可看出,脂肪酶Rhizopuschinensis在0~30 U/mL浓度范围内,L-α-GPE得率增加,继续增加酶浓度,L-α-GPE得率基本保持不变。酶浓度升高,酶的活性中心增加,底物与活性中心结合的概率增大,酶反应速度越快;但酶的活性中心相对于底物接近饱和时,继续增加酶浓度,产物得率基本不变。因此,选择最适酶浓度为30 U/mL。
2.1.6 最优条件验证
根据单因素实验结果确定了脂肪酶Rhizopuschinensis催化水解大豆粉末磷脂制备L-α-GPE的最佳工艺条件为pH 7、大豆粉末磷脂质量浓度5 mg/mL、反应温度45℃、CaCl2质量浓度2 mg/mL、酶浓度30 U/mL,在此条件进行3次验证实验,L-α-GPE得率分别为94.5%、93.3%和93.7%,平均为93.8%。与脂肪酶Thermo4S-3催化水解大豆粉末磷脂相比[12],脂肪酶Rhizopuschinensis需要反应更长时间(反应15 h)才能达到与Thermo4S-3(反应6 h)相当的L-α-GPE得率,说明在大豆粉末磷脂水解反应中,脂肪酶Rhizopuschinensis催化活性不如Thermo4S-3高。
2.2 L-α-GPE的纯度
经分离纯化后的L-α-GPE为浅黄色黏稠状液体,经HPLC-ELSD分析,其纯度为99.2%。
2.3 L-α-GPE的结构表征
脂肪酶Rhizopuschinensis催化制备的L-α-GPE的红外光谱及质谱图分别见图6、图7。

图6 L-α-GPE的红外光谱图

图7 L-α-GPE的质谱图

由图7可看出,m/z216和431分别为L-α-GPE的[MH]+和[2m+H]+分子离子峰。
综上,说明产品为L-α-GPE。
3 结 论
通过单因素实验确定了脂肪酶Rhizopuschinensis催化大豆粉末磷脂水解制备L-α-GPE的最佳反应条件为:pH 7,大豆粉末磷脂质量浓度5 mg/mL,CaCl2质量浓度2 mg/mL,酶浓度30 U/mL,反应温度45℃。在最佳条件下反应15 h,制备的L-α-GPE得率为93.8%,经分离纯化产品纯度为99.2%。
