羽衣甘蓝BoMAPK4原核表达、抗体制备及蛋白表达分析
2022-08-04栗赫铭秦洪涛魏德强蓝兴国
栗赫铭 秦洪涛 魏德强 李 旭 蓝兴国
(东北盐碱植被恢复与重建教育部重点实验室,东北林业大学,哈尔滨 150040)
丝裂原活化蛋白激酶(MAPK)级联通路是真核生物中保守的信号转导途径,典型的MAPK信号网络由3种特定的蛋白激酶组成,即MAPK激酶激酶(MAPKKKs)、MAPK 激酶(MKKs)和MAPKs,其在保守的激活位点被磷酸化依次激活。MAPK在植物的生物和非生物胁迫反应以及生长发育过程中发挥重要作用,其转录水平通常受生长、发育和胁迫信号的调控。MAPK 信号级联能够导致细胞骨架蛋白、磷脂酶和微管相关蛋白的激活,参与植物各种生理、发育和植物激素应答反应。
目前,植物MAPK 信号通路的研究集中在MAPK3/6 和MAPK4 上,通过与上下游蛋白组分相互作用,调节多种生理及发育反应。MAPK4 在甘蓝型油菜()生长发育过程具有重要调节作用。MAPK4 控制拟南芥()花粉及花药的发育,并且MAPK3/4是授粉反应所必需的,这两个蛋白的丢失会导致花粉萌发和花粉管生长严重减少。MKK6-MAPK4/11 通路能够直接调节胞质分裂和有丝分裂,促进细胞板扩张和雄性特异性减数分裂。MAPK4 可引发细胞凋亡,MAPK4 的下游底物MAP56 通过参与Cd诱导的根细胞凋亡的方式参与控制细胞分裂和根系的生长。体外磷酸化位点试验中发现MAPK4/6具有调节植物生长素的运输以及调节植物器官生长情况的功能。MAPK4 可以通过影响花青素积累及生长发育过程中碳的分配进而影响发育过程。在的RNAi植株中发现,提高了种子的产量。这些结果表明MAPK4 在植物生长发育过程中发挥重要作用。
本研究以北方重要的耐寒观赏性植物羽衣甘蓝(var.)为材料,分离柱头中基因,进行序列分析;通过原核表达纯化BoMAPK4 重组蛋白,制备MAPK4 多克隆抗体;利用免疫印迹技术分析MAPK4 在花各组织中的蛋白表达情况,为MAPK4 的生物学功能研究提供更多线索。
1 材料与方法
1.1羽衣甘蓝BoMAPK4基因分离及序列分析
通过前期蛋白质组学的研究获得了羽衣甘蓝BoMAPK4 的氨基酸序列,并参考从甘蓝基因组(LOC106335943)中的序列,设计特异性上游引物MAPK4-RT-For 和下游引物MAPK4-RT-Rev(见表1)。通过E.Z.N.A.Plant RNA Kit(Omega公司)提取羽衣甘蓝自交不亲和系(S S)柱头总RNA,用TranScriptOne-Step gDNA Removal and cDNA Synthesis SuperMix(全式金公司)反转录试剂盒获得羽衣甘蓝柱头cDNA。以cDNA为模板进行PCR扩增,反应条件设置如下:94 ℃2 min;94 ℃30 s,60 ℃30 s,72 ℃1.5 min,32 个循环;72 ℃5 min。分离纯化PCR 后,与pGEM-T 载体连接,转化到DH5α菌株中,用蓝白斑筛选法挑选阳性克隆。重组质粒进行PCR鉴定,进行测序分析。
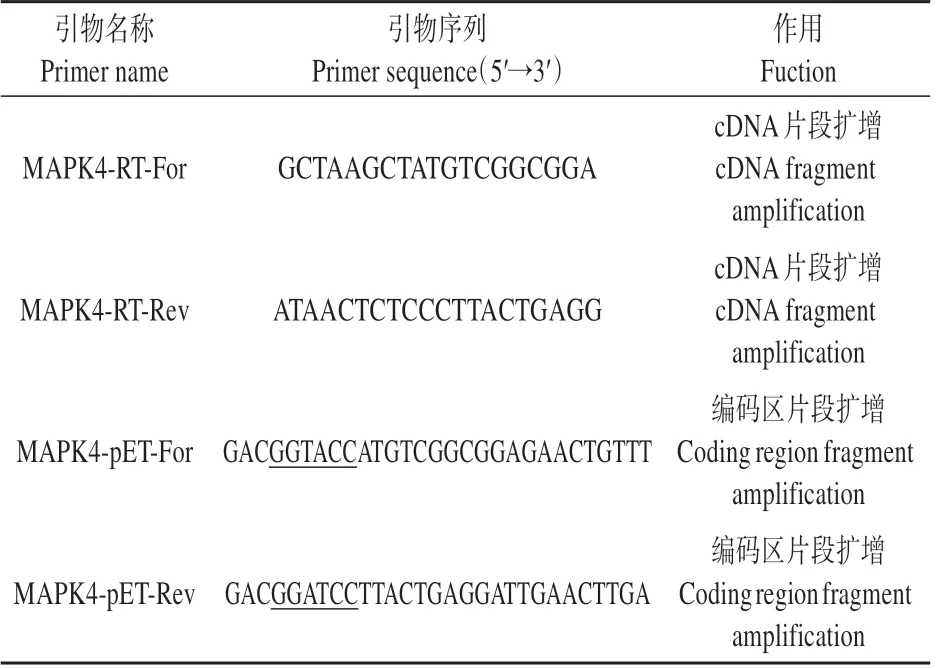
表1 BoMAPK4基因克隆及原核表达引物Table 1 Cloning and prokaryotic expression primers of BoMAPK4
1.2羽衣甘蓝BoMAPK4的生物信息学分析
参照文献[24-25]提供的生物信息分析方法,对BoMAPK4 氨基酸序列及保守结构域进行预测分析,通过网站ProtParam(http://www.expasy.org)预测编码蛋白的分子量及理论等电点等。通过SMART 网 站(https://smart.embl-heidelberg.de)进行活性结构类型、跨膜结构及信号肽分布预测,通过SWISSMODEL 软 件(https://swissmodel.expasy.org/)预测蛋白活性基序位置。使用ClustalW 与NCBI数据库的油菜BnMAPK4(NP_001303145.1)、芜菁()BrMAPK4(XP_009134529.1)和拟南芥AtMAPK4(NP_192046.1)进行同源性分析比对。
1.3原核表达质粒pET-14b-MAPK4的构建
设 计 引 物MAPK4-pET-For(5′-GACGGTAC‑CATGTCGGCGGAGAACTGTTT-3′)及MAPK4-pETRev (5′-GACGGATCCTTACTGAGGATTGAACTT‑GA-3′)(见表1)进行PCR。反应条件:98 ℃,5 min;98 ℃,10 s,60 ℃,10 s,72 ℃10 s,32 个循环;72 ℃5 min。PCR 产物纯化回收后与pET-14b 载体进行连接,构建pET-14b-BoMAPK4 载体,转化DH5α 大肠杆菌()感受态细胞,重组质粒进行PCR 鉴定、酶切条带鉴定以及测序分析。
1.4羽衣甘蓝BoMAPK4的原核表达及纯化
参考李阳等的方法进行纯化。提取质粒转化到BL21(DE3)大肠杆菌表达菌株中进行诱导,37 ℃培养至对数中期OD=0.6,加入异丙基--硫代半乳糖苷(IPTG)至终浓度为1 mmol·L。37 ℃诱导4 h 后少量菌液(500 μL)样品离心收集菌体,进行12%的SDS-PAGE 电泳,经考马斯亮蓝染色后观察蛋白表达情况。大量菌液(100 mL)经过4 ℃6 000 r·min离心收集菌体,用5 mL bind‑ing buffer(30 mmol·LNaCl;10 mmol·L咪唑;20 mmol·LTris-base;pH=8.0)重悬菌体,于冰上进行超声破碎,4 ℃12 000 r·min离心20 min 收集上清液。取用Binding buffer 新平衡后层析柱,加入100 μL Ni-NTA Agarose(Novagen 公司),室温结合2 h 后,采用washing buffer(20、30、40 mmol·L咪唑含量binding buffer,pH=8.0)依顺序进行柱洗脱。最终采用250 mmol·L咪唑收集液(pH=8.0)进行洗脱收集流出液。向Amicon Ultra-4(3000)透析柱中加入PBS缓冲液(2.68 mmol·LKCl,1.46 mmol·LKHPO,137 mmol·LNaCl,8.1 mmol·LNaHPO,pH=7.4)在4 ℃下对收集的融合蛋白进行透析,经PierceBCA Protein Assay Kit 试剂盒(Thermo 公司)定量分装于冰箱中-20 ℃保存。
1.5羽衣甘蓝BoMAPK4多克隆抗体的制备及检测
多克隆抗体制备方法参照Li等的文献。将获得蛋白通过弗氏完全佐剂(Freund’s Adjuvant)乳化后免疫6~8 周雄性Balb/C 小鼠,进行3 次后间隔3 d,第4次加强免疫无弗氏完全佐剂,直接注射小鼠腹腔,共4次免疫。3 d后处死小鼠取血,室温静置离心后获得anti-BoMAPK4 血清多克隆抗体,混合等量100%甘油后,-80 ℃保存。分别对pET-14b 载体和BoMAPK4-pET-14b 重组载体转化的BL21(DE3)菌株进行诱导表达,通过SDS-PAGE以及免疫印迹鉴定抗体特异性。
1.6羽衣甘蓝BoMAPK4的表达分析
收集羽衣甘蓝自交不亲和系(S S)萼片、花瓣、花药、柱头、花柱和子房。参考Lan等的方法分别进行花的各组织总蛋白提取及定量。将材料充分研磨,加入总蛋白提取缓冲液(50 mmol·LHepes,pH=7.5;5 mmol·LEDTA;10 mmol·LDTT;1 mmol·LPMSF;10%甘油;Cocktail tablet)分别进行提取。按照BSA 终浓度从0~100 mg·L含量以PBS 缓冲液稀释,每孔加入考马斯亮蓝染色液及样品。结合5 min 后,在SPARK 酶标仪(Tekan)595 nm 下测定并绘制标准曲线,对蛋白样品进行定量。取各组织定量后样品10 μg,进行12% SDS-PAGE 电泳。通过湿转印法(280 V,1 h)将蛋白转移到PVDF 膜中,在室温下,用含有5%牛 血 清 白 蛋 白 的TBST(137 mmol·LNaCl,20 mmol·LTris base,0.1%Tween-20)封闭1 h。以制备的BoMAPK4 多克隆抗体作为一抗,以山羊抗鼠抗体IgG 抗体(HRP)(亚科因公司)作为二抗进行孵育,通过ECLPrime Western Blotting Detection Reagents(Cytiva公司)在Tanon 2000仪器下观察进行化学发光检测。
2 结果与分析
2.1羽衣甘蓝MAPK4基因的克隆及生物信息学分析
以羽衣甘蓝柱头总cDNA 为模板,通过RTPCR 的方法获得了长度为1 193 bp 的cDNA 序列,将其命名为BoMAPK4(见图1)。BoMAPK4 中含有一个长度为1 122 bp 的开放阅读框(open read‑ing frame,ORF),编码373 个氨基酸(见图2)。BoMAPK4 的分子量约42.5 kDa,等电点为5.85。在结构上含有一个287 个氨基酸长度的丝氨酸/苏氨酸蛋白激酶结构域,位于43~329 的氨基酸序列,无跨膜区和信号肽,MAPK 活化环序列位于197~204位置,201-203为TEY基序(见图3)。
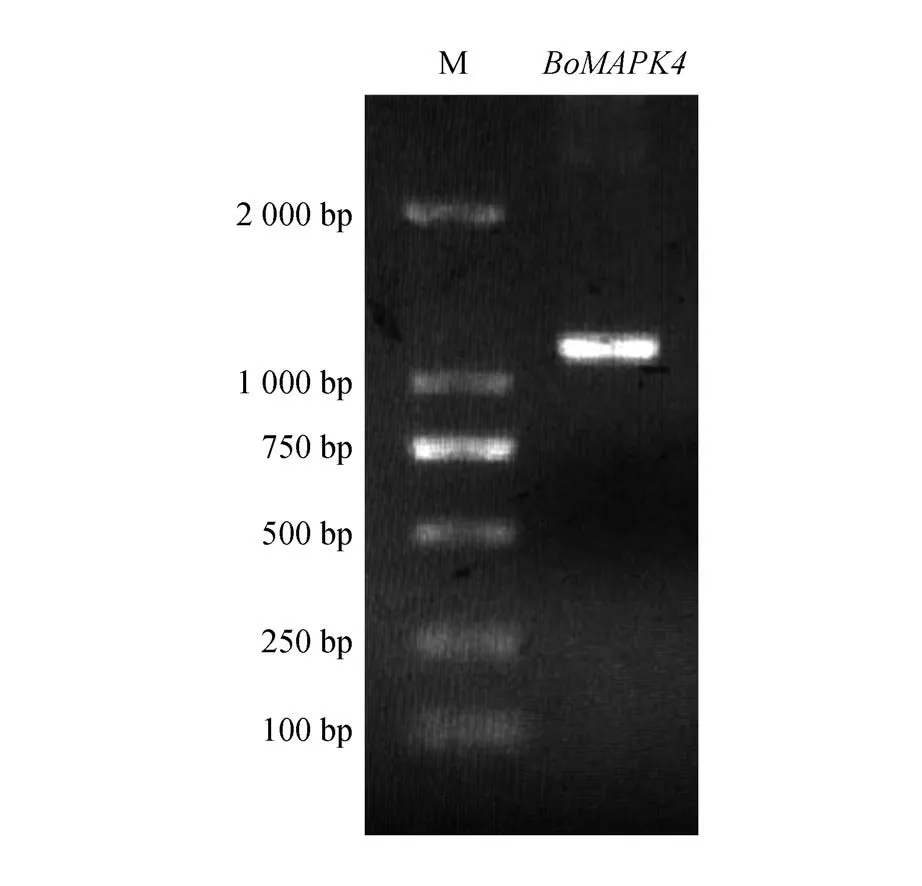
图1 羽衣甘蓝BoMAPK4的RT-PCR扩增结果Fig.1 The amplification products of ornamental kale BoMAPK4 gene by RT-PCR

图2 BoMAPK4全长cDNA核苷酸序列及推测氨基酸序列Fig.2 Full-length cDNA sequence of BoMAPK4 and putative amino acid sequence
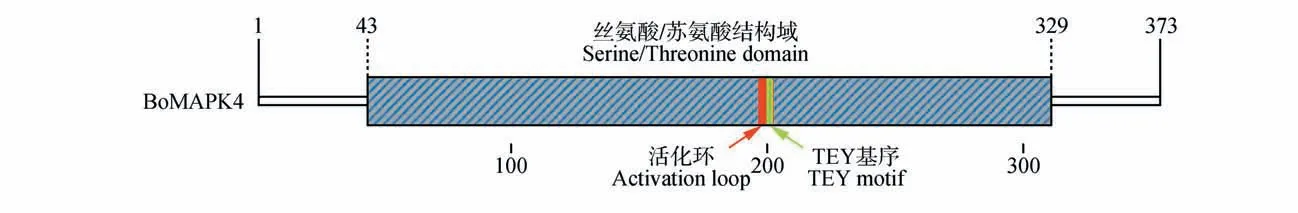
图3 BoMAPK4蛋白功能结构域及位置预测蓝色条纹处代表从氨基酸序列43~329位置为丝氨酸/苏氨酸结构域;红色代表活化环位置,其上绿色代表TEY基序Fig.3 Prediction of BoMAPK4 protein functional domain and siteThe blue stripe represents the serine/threonine domain from positions 43~329 in the amino acid sequence;The red color represents the position of the activation loop,and the green color above it represents the TEY motif
氨基酸序列比对分析表明,BoMAPK4 与油菜BnMAPK4 具有99.7%的一致性,与芜菁BrMAPK4具有99.5%的一致性,与拟南芥AtMAPK4 具有95.4%的一致性(见图4)。这说明MAPK4 蛋白在十字花科(Brassicaceae)植物中高度保守。

图4 羽衣甘蓝BoMAPK4与油菜BnMAPK4、芜菁BrMAPK4、拟南芥AtMAPK4氨基酸序列比对Fig.4 Comparison of amino acid sequences of BoMAPK4 with BnMAPK4,BrMAPK4 and AtMAPK4
2.2羽衣甘蓝MAPK4原核表达及多克隆抗体制备
通过构建的pET-14b-BoMAPK4质粒转化大肠杆菌BL21(DE3)菌株,对BoMAPK4 蛋白进行诱导。SDS-PAGE电泳结果表明在45 kDa左右有蛋白条带特异性的诱导。考虑载体的His标签具有2 kDa分子量,因此特异诱导表达的蛋白与预期的重组BoMAPK4大小相符。通过亲和纯化后,SDS-PAGE结果获得的重组BoMAPK4蛋白的条带单一,纯度较好(见图5)。

图5 BoMAPK4原核表达及纯化的结果将诱导前细菌蛋白、诱导后细菌蛋白和通过Ni2+-NTA 树脂纯化后的蛋白进行SDS-PAGE,考马斯亮蓝染色Fig.5 The prokaryotic expression and purification of BoMAPK4SDS-PAGE was performed on the bacterial protein before induction,the bacterial protein after induction,and the protein purified by Ni2+-NTA Agarose,the result was stained with Coomassie Brilliant blue
利用获得重组BoMAPK4 免疫小鼠,获得BoMAPK4 的多克隆抗体。为了检测获得的抗体特异性,分别将通过IPTG 诱导前和诱导后的pET-14b空载体以及BoMAPK4转化的BL21(DE3)菌液进行免疫印记分析。结果表明在45 kDa处空载体以及未IPTG 诱导pET-14b-BoMAPK4 转化菌液没有条带,而诱导后BoMAPK4 菌液有目标条带(见图6)。这说明该多克隆抗体能特异性结合BoMAPK4,具有良好的特异性。
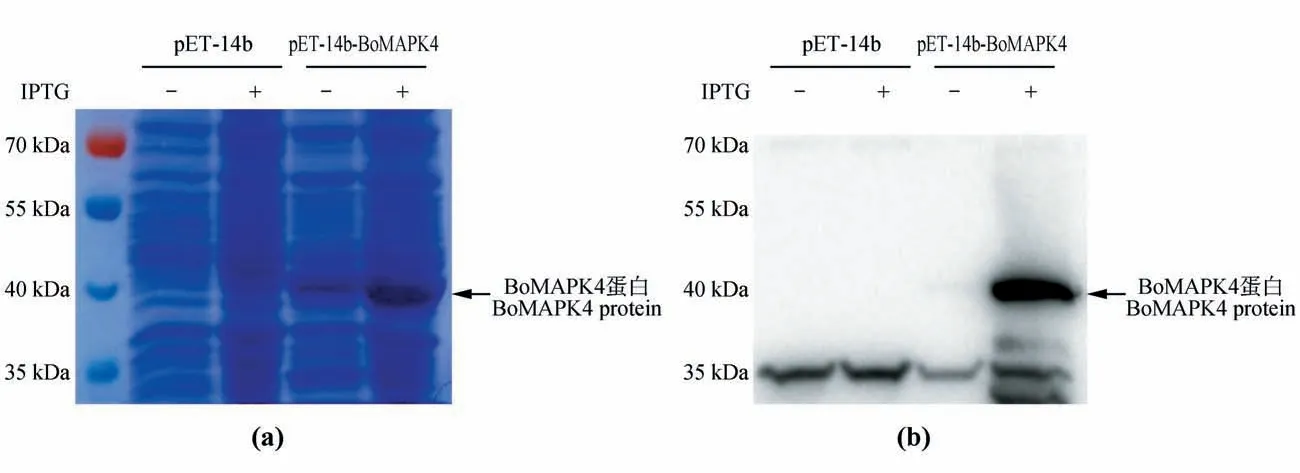
图6 免疫印迹分析BoMAPK4多克隆抗体特异性a.SDS-PAGE 的考马斯亮蓝染色;b.使用抗BoMAPK4抗体进行蛋白印迹;空pET-14b载体及构建的pET-14b-BoMAPK4用于转化大肠杆菌BL21细胞,IPTG诱导融合蛋白表达;每个泳道中加入来自IPTG诱导蛋白质之前(-)或之后(+)的菌液Fig.6 Western blotting analysis to detect the specificity of BoMAPK4 polyclonal antibodya.Coomassie brilliant blue staining of SDS-PAGE;b.Western blotting with BoMAPK4 antibody;The empty pET-14b vector or the construct pET-14b-BoMAPK4 was used to transform E.coli BL21 cells,and expression of the fusion protein was induced by IPTG;Bacteria cell extracts from be‑fore(-)or afte(r+)IPTG induction of protein synthesis were loaded in each lane
2.3免疫印迹分析BoMAPK4在羽衣甘蓝各组织中的表达
提取羽衣甘蓝萼片、花瓣、花药、柱头、花柱和子房的总蛋白质,利用制备的BoMAPK4 的抗体对BoMAPK4 蛋白进行组织特异性蛋白表达分析。免疫印迹的结果表明,在检测的蛋白样品中,在分子量大约43 kDa 处有特异条带表达,这与预期的BoMAPK4 的大小相符;BoMAPK4 在花瓣、花药和子房中表达的较少,萼片和花柱中表达的较多,在柱头中的表达量最高(见图7)。

图7 BoMAPK4免疫印迹分析通过BoMAPK4抗体对羽衣甘蓝萼片、花瓣、花药、柱头、花柱和子房的总蛋白进行免疫印迹检测;通过考马斯亮蓝(CBB)对膜进行染色Fig.7 Western blotting analysis of BoMAPK4Western blotting detection of BoMAPK4 using sepal,petal,anther,stigma,style and ovary of ornamental kale by the polyclonal antibody against BoMAPK4;The membrane was stained with Coomassie Brilliant Blue(CBB)
3 讨论
在本研究中,通过分离羽衣甘蓝的基因序列,对其进行氨基酸序列分析及结构分析,对BoMAPK4 蛋白的基础特征进行展现,发现BoMAPK4具有丝氨酸/苏氨酸结构域,具有磷酸化下游蛋白底物的功能。 TEY 基序证明了BoMAPK4蛋白具有B 类MAPK 家族蛋白的活性特征。进行蛋白序列比对发现,BoMAPK4 与油菜、芜菁、拟南芥的序列相似度较高,氨基酸序列差异的数量和位置也基本相似,这说明MAPK4 在十字花科植物进化中高度保守,并在十字花科植物中MAPK4 因结构相似可能存在部分类似功能。BoMAPK4 原核表达纯化结果在45 kDa 处得到被诱导的蛋白;采用亲和层析方式可以得到纯度较高的BoMAPK4 蛋白。使用该蛋白进行小鼠免疫获得多克隆抗体,检测结果表示抗体特异性较好。利用制备的BoMAPK4 多克隆抗体,发现BoMAPK4在花各组织中均有表达,而且BoMAPK4在柱头中表达量最高。
MAPK 级联通路是真核生物中常见的信号转导途径,参与植物多种生理、发育和植物激素反应。其中MAPK3/6 是研究最多的A 类MAPK,而MAPK4 是B 类MAPK 蛋白的研究热点。YDAMAPKK4/MAPKK5-MAPK3/6 级联能通过磷酸化来控制气孔的发育及闭合和植物花器官发育。此外,MAPK3 调节根的数量,参与芽形成;MAPK6调节根的长度和强壮情况,控制水稻()的谷物粒大小。而MAPK4在调节植物器官生长功能表现为调节植物生长素的运输。并且参与有丝分裂/胞质分裂和微管组织的动态变化,以及影响根细胞凋亡。通过磷酸化MYB75 底物方式参与光诱导花青素的合成,进一步影响碳的分配,从而对营养生长正调控。在拟南芥中MAPK4 影响花粉及花药的发育,拟南芥柱头特异性抑制突变体表现出柱头花粉附着和萌发的严重减少,结果表明为授粉必需,且这一MAPK 途径集中于。本研究从羽衣甘蓝自交不亲和系S S中分离基因,制备多克隆抗体及免疫印迹对BoMAPK4 进行组织特异性蛋白表达分析,明确BoMAPK4 为柱头表达丰富蛋白,表明BoMAPK4可能在柱头授粉中具有功能。在未来的研究中,我们将进一步解析BoMAPK4 在羽衣甘蓝柱头中的具体功能,为MAPK 家族的生物学功能提供更多线索。
