青藏高原岷县龙胆的遗传分化与种群动态历史分析
2022-08-04付鹏程韦秋前史明艳
付鹏程 韦秋前 史明艳
(洛阳师范学院生命科学学院,洛阳 471934)
青藏高原地区是全球生物多样性热点地区之一,是研究植物遗传分化与适应性进化的热点地区。大量的生物地理学研究和谱系地理学研究均表明,青藏高原地区植物遗传分化受到了造山运动和冰川运动引发的环境与气候变化的深刻影响。然而,不同物种对环境与气候变化的响应模式存在较大的差异,例如植物具有多种不同类型的冰期避难所与扩张模式,高山植物对全球气候变化的响应也与低海拔植物存在显著不同。因此,进一步探讨青藏高原地区植物的遗传分化及其对过去环境与气候变化的响应模式,可以为更好地理解全球气候变化背景下的植物进化与多样性形成机制提供参考。
龙胆属()以青藏高原及其周边地区为分布中心和分化中心,是我国植物多样性的重要组成部分,很多物种具有很高的药用和观赏价值。岷县龙胆(var.(Mar‑quand)T. N. Ho)是龙胆属高山组中的常见物种,多年生草本,是青藏高原特有植物。岷县龙胆不仅是高山灌丛和草甸的重要组成部分之一,还具有较高的药用价值,可用于藏药。岷县龙胆在《》中被处理为一个独立的种(Marquand);但在随后出版的龙胆属专著中作为一个变种,仅分布在青海、西藏、四川和甘肃四省,其原变种(var.)则广布欧洲、美洲和亚洲的部分高山地区。虽然物种龙胆属已开展大量的进化研究,但目前的系统发育关系、叶绿体基因组进化和遗传分化等研究中均未包含岷县龙胆,其遗传分化历史及其与青藏高原地质与气候变化的影响模式有待研究。
本研究以青藏高原地区的15个岷县龙胆种群为研究对象,通过母系遗传和双亲遗传的分子标记探讨岷县龙胆的遗传分化和种群动态历史,研究结果将为龙胆属以及其他高山植物的进化研究提供参考。
1 材料与方法
1.1样品采集
在青藏高原地区采集15 个岷县龙胆种群共119个个体,这些种群覆盖了岷县龙胆在中国现今的所有分布范围。在种群内采样时,每个个体间距至少10 m。选取幼嫩的叶子用干燥硅胶快速干燥,密封保存于-20 ℃中。凭证标本存于洛阳师范学院标本馆。详细的采样信息见表1。

表1 本研究中岷县龙胆的样品信息与遗传多样性指数Table 1 Sample information and genetic diversity index of G.algida var.purdomii in this study
1.2 DNA 提取与PCR扩增
用CTAB 法提取总DNA,用1%琼脂糖凝胶电 泳 检 测。选 用ITS1a/ITS4 引 物和 叶 绿 体rpl32-L 引物进行PCR 扩增,扩增体系和扩增反应参 见Taberlet 等。将PCR 产物纯化后用ABI 3730xl(Applied Biosystems,USA)进行测序。
1.3遗传分化与种群动态分析
使用软件Geneious Pro 3.5.6查看测序结果,并进行序列比对。在软件DnaSP 5.1中统计单倍型个数,对于有杂合位点的ITS 序列,用PHASE按默认参数进行基因分型。在Arlequin 3.5中计算基因多态性()与核苷酸多态性(),并通过分子变异分析(AMOVA)检测遗传变异在居群内和居群间的分布情况。用PERMUT计算居群遗传分化系数和,并对算得的和做1 000次重复的置换检验,以检测单倍型的分布是否具有显著的地理结构。在Arlequin 3.5进行歧点分布(mismatch distribution)分析和中性检测分析,计算Fu’s和Tajima’s值。
采用最大似然法,在IQ-TREE中基于单倍型构建系统发育树,核苷酸替换模型由IQ-TREE自动计算,设置bootstrap 为1 000。用最大简约法在软件Network 4.6中构建单倍型的中央网络连接图。
基于贝叶斯马尔科夫链蒙特卡洛链方法(Bayesian MCMC),用软件BEAST 1.7.5估算岷县龙胆各支系的分化时间。选用Yule process、严格分子钟模型进行计算。由于龙胆属已发现的化石非常少,加之本研究中未包含龙胆属全部主要类群,因此采用2 种方法对分化时间估算进行校正。首先,选用龙胆属仅有的秦艽()化石来标定外类群的共同祖先时间;其次,依据Favre等的结果,约束龙胆属冠群时间的中位数为29.76 个百万年。分析时做3 次独立运算,每次运算10 000 000 代,每隔1 000 代取一棵树,去掉前20%的预热树(Burn-in)。用Tracer 1.5(http://tree.bio.ed.ac.uk/software/tracer/)查看有效采样规模(effective sample size,ESS),保证所有指
标均大于200。采用TreeAnnotator 1.7.5基于有效树产生1棵分支分化时间树。
1.4物种分布模型
从GBIF(Global Biodiversity Information Facili‑ty)中下载岷县龙胆的分布记录,去掉引种驯化产生的记录点,结合本研究记录的物种分布记录,在ArcGIS 10.2 中移除间距小于10 km 的分布点。从WorldClim 下载目前、中全新世(mid-Holocene,约6 kya)、末次盛冰期(LGM,约22 kya)和末次间冰期(LIG,约120~140 kya)的19 个生物气候因子。为了避免多重共线性的影响,在SPSS 2.0 中计算生物气候因子间的皮尔森相关系数,去掉皮尔森相关系数显著大于0.9 的生物气候因子。用软件MaxEnt 3.4.1预测岷县龙胆在不同时期的物种分布范围。将75%分布数据用作训练集,余下的25%用作测试集,用AUC值对模型进行评估。
2 结果与分析
2.1遗传分化与遗传结构
叶绿体分子标记在岷县龙胆中共有11处碱基替换和6 处缺失/插入,共鉴定11 种单倍型(cP1-cP11)。大多数种群固定了1 种以上的单倍型(见表1,图1)。核分子标记在岷县龙胆中共有14 处碱基替换和1 处缺失/插入,共鉴定25 种基因型(P1~P25),其中大部分为单个种群所独有(见表1,图1)。基于叶绿体数据计算得到的和分别是0.705 和0.512(>0.05),基于核基因数据算得的和分别是0.036 和0.023(>0.05)。叶绿体数据的分子变异分析的结果表明,发生在种群内的遗传变异(54.84%)略高于发在在种群间的变异(45.16%);ITS 数据表明,发生在种群内的遗传变异占比高达97.73%(见表2)。基于叶绿体数据和ITS数据的分别为0.452和0.022。

表2 岷县龙胆种群分子变异分析Table 2 AMOVA result of G.algida var.purdomii
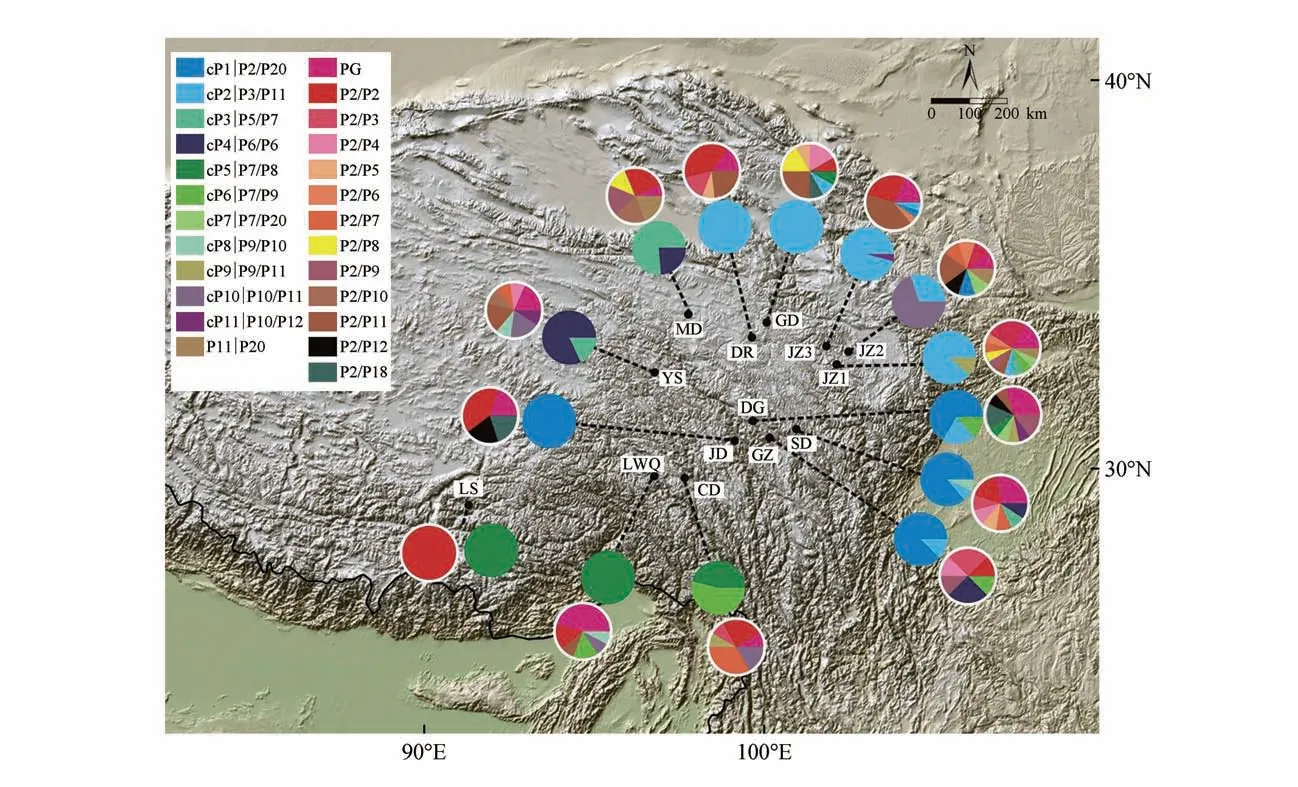
图1 岷县龙胆单倍型/基因型的地理分布式样PG.私有基因型;饼图为不同采样点中各单倍型的频率(地图来自星球研究所)Fig.1 Geographical distribution and phylogenetic relationship of 20 chloroplast haplotypes identified in G. algida var.purdomii.PG.Private genotypes;Pie charts display haplotype frequencies in each locality(the map is from Institute of Planet)
叶绿体数据的系统发育关系分析表明,单倍型cP11 位于系统树基础,与其他类群的分化时间为3.71个百万年(95%置信区间:1.92~5.75个百万年),单倍型cP1 和cP2 与姊妹类群的分化时间为2.68 个百万年(95%置信区间:1.32~4.05 个百万年)(见图2B)。中央网络连接图表明单倍型cP2位于网络中央(见图2A)。

图2 基于叶绿体数据的岷县龙胆单倍型中央网络连接图(A)与分化时间(B)A.饼图大小表示单倍型数量;B.枝上数值表示贝叶斯后验概率;主要节点的分化时间用箭头表示,灰条表示95%的置信区间Fig.2 Results of divergence time and median-joining network among chloroplast haplotypes in G.algida var.purdomiiA.Pie charts display number of each haplotype;B.Numbers on the branches indicate Bayesian posterior probabilities;Node age estimates are marked with black arrows,grey bars represent 95%highest posterior densities.
2.2种群动态历史与物种历史分布范围
基于叶绿体和ITS数据的分析结果表明,岷县龙胆的歧点分布均为单峰曲线(见图3),说明种群大小近期发生过扩张。基于叶绿体数据的中性检验结果显示,Fu’s为1.339(=0.722),Tajima’s为-0.543(=0.312);ITS 数据显示Fu’s为-10.401(=0.007),Tajima’s为-0.131(=0.504)。

图3 岷县龙胆歧点分布分析曲线A.叶绿体数据;B.核基因数据Fig.3 Result of mismatch distribution analysis of G.algida var.purdomiiA.cpDNA dada;B.nrITS data
通过泊松相关性分析,保留了9个生物气候因子(bio1-bio4,bio7,bio12-bio15)用于岷县龙胆的历史分布区重建。结果表明,岷县龙胆从末次间冰期到现在的历史分布范围总体比较稳定,末次盛冰期在阿里地区和喜马拉雅地区有明显收缩,末次盛冰期后经过小幅扩张形成现今的分布范围(见图4)。
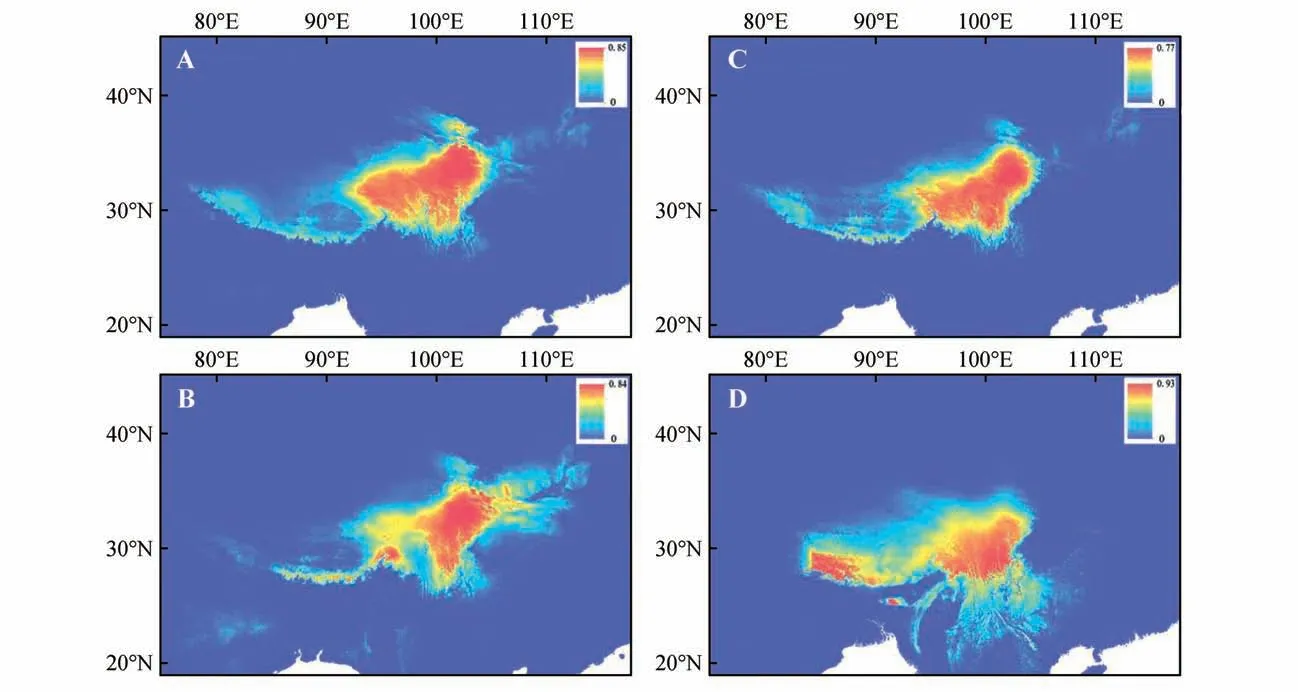
图4 基于物种分布模型模拟岷县龙胆现在(A)、末次盛冰期(B)、中全新世(C)和末次间冰期(D)的潜在适宜分布区Fig.4 Result of species distribution model in G.algida var.purdomii(A.current;B.Last glacial maximum(LGM);C.Mid holecene;LIG.Last interglacial)
3 讨论
本研究表明,岷县龙胆近期经历了种内遗传分化,遗传多样性较高。岷县龙胆的在叶绿体数据中为0.452,高于龙胆属高山组其他物种,如阿 墩 子 龙 胆(W. W. Smith,=0.232,AFLP 数据)和多花龙胆(T. N.Ho,=0.226,AFLP 数据)),也高于龙胆属其他多年生植物如何氏秦艽(P. C. Fu & S. L.Chen,=0.185,叶绿 体 数 据;=0.423,ITS 数据)。在岷县龙胆的分布范围内,由于没有一个地区的遗传多样性和特有单倍型明显高于其他地区,因而无法确定一个冰期避难所,这与高山植物绵参(Benth.)、石砾唐松草等(Lecoy.)相似。考虑到岷县龙胆分布地区内山脉众多,岷县龙胆在冰期可能存在多个微型避难所,如高山植物西川红景天((Frod.)S.H.Fu)等。种群进化历史分析结果表明岷县龙胆种群大小发生了近期扩张,与之相一致,物种分布模型的结果也表明末次盛冰期以来岷县龙胆的分布范围有小幅扩张。然而,岷县龙胆在末次间冰期时在阿里地区有大量潜在适生区,但随后发生明显的收缩;而阿里地区现今气候干燥,岷县龙胆在这些地区没有分布记录。这些结果均表明岷县龙胆的遗传分化和种群动态均受到了气候变化的显著影响。
以下两个因素可能促进了岷县龙胆的种内遗传分化。第一,第四纪的气候波动。分化时间估算结果表明,岷县龙胆种内的遗传分化主要发生在上新世晚期和更新世,此时青藏高原整体隆升已基本结束,冰川作用盛行,气候波动大。青藏高原地区众多植物类群的遗传分化均受到了第四纪气候波动的显著影响。第二,高山峡谷地貌的地理隔离作用。岷县龙胆分布的地区多为山脉峡谷地貌,易于形成片段化的生境,尤其是高山植物在应对环境与气候变化过程中会形成天空岛效应(sky island),起到了降低居群间基因流的作用,从而促进了种内的遗传分化的积累。已有研究表明,青藏高原地区植物种内的遗传分化程度普遍较高,如星叶草(Max‑im.)不同支系间的达到了0.89。
基于核基因数据,本研究在岷县龙胆中检测到了很高的遗传多样性,但其遗传分化程度很低。ITS 序列在岷县龙胆中的杂合度较高,通过基因分型,共检测到25种基因型,但种群间共享的单倍型仅有P2 一种,仅为0.022。但基于叶绿体数据的分析表明,岷县龙胆种内的遗传分化程度较高。比较分析两套不同遗传方式的数据,推测岷县龙胆中ITS数据体现的低遗传分化可能有两个原因。第一,种内基因交流频繁。岷县龙胆的花朵大,长3.0~4.5 cm,筒状钟形或漏斗形,笔者野外考察中发现熊蜂是其传粉者之一,因此种内可能存在较强的花粉流;加之岷县龙胆种子细小,可借风力传播,可能存在一定的种子流。第二,ITS 序列的分辨率不足。ITS 序列是系统发育关系重建的常用分子标记之一,但常常无法区分近缘物种。在龙胆属中,ITS 序列能很好的区分不同的组,但在种水平的分辨率一般,尤其是经历了快速的类群如小龙胆组等。龙胆属高山组和多枝组的物种分化研究表明,即便是在形态和遗传上均可以被区分的物种对,种间的遗传分化程度不高,种内的遗传分化程度更低,因此低分辨率的分子标记不足以检测到种内的遗传分化。
