肝脏血管周上皮样细胞瘤的临床诊疗分析:附17例报告
2022-08-03包远鹏唐祖雄童星平小夏孙鼎薛小峰杨小华秦磊钱海鑫
包远鹏,唐祖雄,童星,平小夏,孙鼎,薛小峰,杨小华,秦磊,钱海鑫
(苏州大学附属第一医院1.普通外科2.病理科3.影像科,江苏苏州 215006)
血管周上皮样细胞瘤(perivascular epithelioid cell neoplasms,PEComa)是一种来源于上皮样间叶的肿瘤,PEComa 家族包括了血管平滑肌脂肪瘤(angiomyolipoma,AML)、肺透明细胞糖瘤(clear cell sugar tumor, CCST)、 淋巴管平滑肌瘤病(lymphangioleiomyomatosis,LAM) 以及镰状韧带透明细胞肌黑色素瘤等,可发生在全身多个器官,其中以肾脏最为常见,其次则为肝脏[1]。肝脏PEComa 大多为良性肿瘤,恶性罕见,可发生于任何年龄段,多见于中年女性;临床上患者多为体检时偶然发现,也有少数患者出现腹部疼痛或不适、发热乏力或体质量下降、消瘦等症状[2]。由于其缺乏特异性的症状和影像学表现,所以临床上较易发生误诊并影响治疗。因此,笔者收集苏州大学附属第一医院普通外科收治的17 例肝脏PEComa 的临床资料进行回顾性分析,旨在进一步提高对该类疾病的诊治水平。
1 资料与方法
1.1 一般资料
苏州大学附属第一医院普外科2014年1月—2021年10月共诊治肝脏PEComa 患者17 例。其中男6 例,女11 例,男女比例为1∶1.8;年龄25.0~68.0 岁,平均(45.7±13.7)岁。所有患者临床资料完整,17 例患者中3 例患者主诉右上腹不适,其余均无明显临床症状;术前检查包括了常规血液生化检查、肿瘤标志物检查、肝炎病毒学检查及腹部影像学检查等,所有患者肝脏肿瘤均为单发,血、尿粪常规及肿瘤标志物甲胎蛋白(AFP)均未见异常,肝功能Child 分级均为A 级,4 例患者合并乙肝病毒感染;17 例患者术前影像学诊断分别为肝脏PEComa 1 例,肝脏占位性病变2 例,肝癌9例,肝血管瘤1 例,肝脏局灶性结节增生1 例,肝腺瘤2 例,肝错构瘤1 例,均未见主要脉管被肿瘤侵犯;1 例患者行术前穿刺活检,病理结果为倾向为肝脏PEComa。
1.2 治疗方法
所有患者均接受手术治疗,手术方式包括了开腹或腹腔镜手术,开腹手术常规选择右上腹反“L”切口,腹腔镜手术则采用主刀右侧位,“V”字形5 个Trocar 布局,标本选取延长观察孔切口5 cm 取出。由于该疾病术前准确诊断率较低,手术切除方式往往需要结合术中探查,一般可见肿瘤色泽红润,质地较软,边界清晰,故大多病例选择较为保守的局部切除;当遇到肿瘤紧贴主要脉管时可选择“0”切缘完成肿瘤切除。切肝方式采用超声刀、单、双极电凝、钳夹法联合切肝,术中一般需要阻断第一肝门1~2 个循环(每个循环阻断15 min,开放5 min)。切除标本后可行快速病理定性检验手术方式正确与否,但笔者的经验是术中依靠冷冻切片明确诊断仍有较大难度,一般需待术后常规病理HE 染色,免疫学病理检查能更好地帮助诊断。
1.3 随访
所有患者术后规律随访,术后第1年每3 个月门诊随访,复查内容为肝胆胰脾彩超、肝功能,必要时复查腹部增强CT 或MR,了解肿瘤有无复发或转移;随后1年2 次的门诊或电话、网络(疫情期间)随访,随访检查内容同前。常规随访时间规定为5年,有恶性倾向[肿瘤直径>5 cm;呈浸润性生长;高级别核级和细胞高度密集;核分裂象>1/50 高倍镜视野(HPF);凝固性坏死;血管侵犯]的患者则进行长期随访,本研究病例随访截止时间为2021年11月。
2 结 果
2.1 治疗结果
手术治疗方面,腹腔镜手术为7 例,其中3 例行腹腔镜左外叶切除术,2 例行腹腔镜肝段切除术(1 例S5,1 例S7),2 例行腹腔镜肝肿瘤局部切除术;10 例开腹手术中,1 例左外叶切除术,1 例左内叶切除术,1 例肝段切除术(S5),其余7 例均为局部切除; 手术时间50.0~250.0 min, 平均(133.6±52.8)min,术中出血量50.0~400.0 mL,平均(138.2±116.6) mL。 全组病例中围手术期Clavien-Dindo 术后并发症分级均为I 级,无二次手术、无死亡病例,均在术后1 d 下床,术后出现胆汁漏1 例,通过恢复饮食、保持引流通畅自行恢复,出现肠梗阻1 例,经过禁食、补液保守治疗后好转,术后住院3.0~11.0 d,平均(6.1±2.4) d。17 例肿瘤均为类圆形结节,质软(图1A),切面多呈灰黄或灰红色(图1B),最大直径为1.5~9.0 cm,平均(4.0±2.4)cm。术后常规病理证实均为PEComa(图1C),其中15 例患者完成免疫组化,所检测抗体因病例而异,其中黑色素瘤抗体HMB45 阳性率93.3%(14/15)(图1D),Melan A 阳性率90.0%(9/10)(图1E),平滑肌肌动蛋白SMA阳性率92.9%(13/14)(图1F),S100 蛋白阳性率为35.7% (5/14),CD34 阳性率为57.1% (8/14),Ki-67 指数为2.0%~12.0%(表1)。
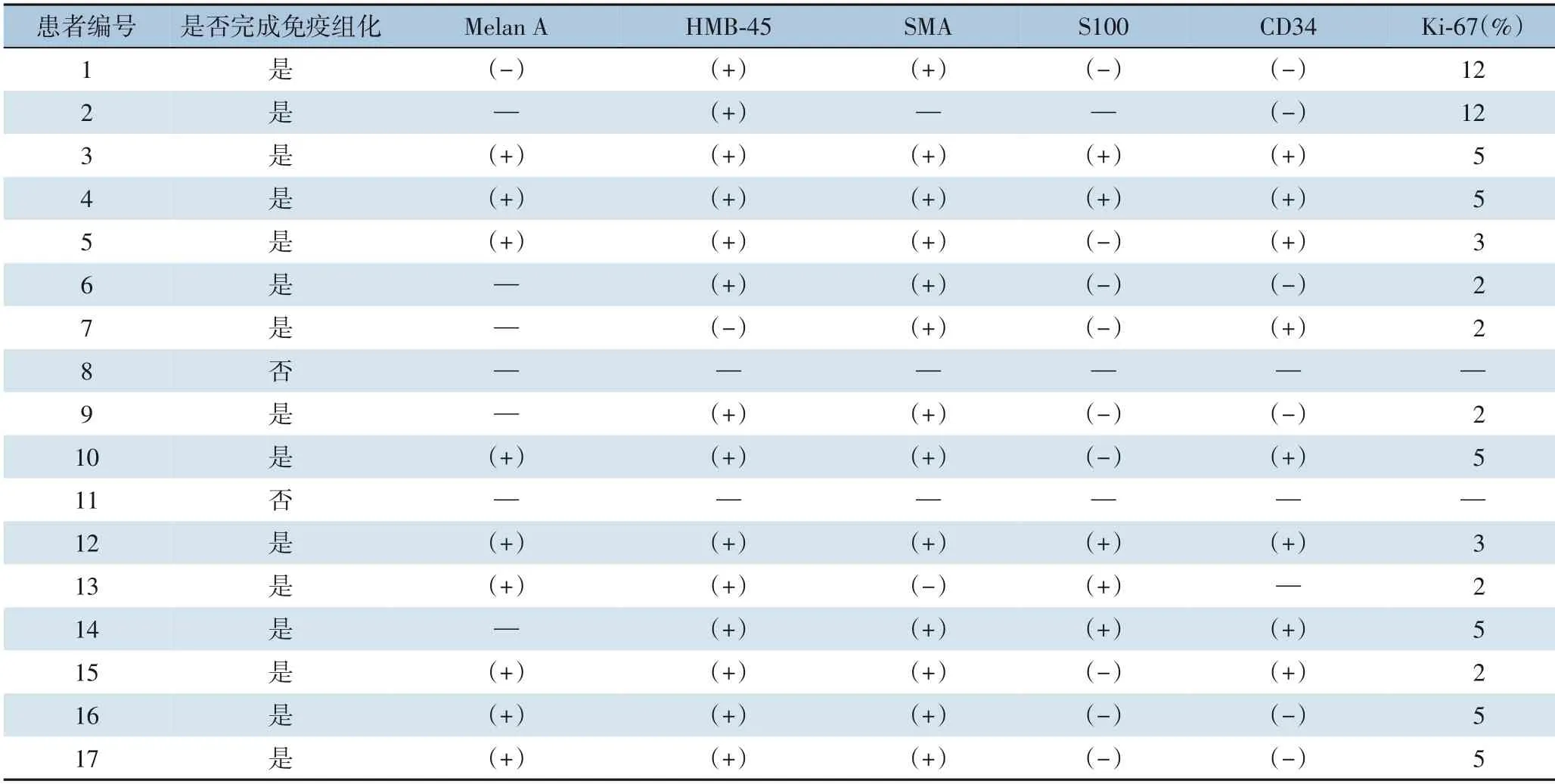
表1 17例肝脏PEComa患者免疫组化资料
2.2 随访结果
17 例患者中,1 例因术后新发胃癌另行手术及化疗,1 例失访,其余15 例术后均未行放化疗等辅助治疗,随访时间1.0~91.0 个月,平均(46.0±28.1)个月。随访至今,1 例已完成随访,另1 例失访,其余15 例患者均在进行规律随访中,未见肝脏PEComa 复发或远处转移病例,无死亡病例。
3 讨 论
3.1 肝脏PEComa的影像学表现
由于肝脏PEComa 临床表现无特异性,故大多通过超声检查首次发现,其病灶通常为圆形或类圆形,界限清楚,呈高回声或混合回声,注射造影剂后,动脉期较周围肝实质高增强,门脉期及延迟期则呈低、等或高增强[3]。在进一步的影像学检查中可发现肿瘤含脂肪成分较明显时CT 平扫可显示病灶内脂肪密度影(图2A),但多数瘤体内混合含有脂肪、出血、坏死等与其他实质部分分界不清,故呈混杂表现,而钙化则较为罕见[4];门脉期由于PEComa 血窦丰富,且实性成分以平滑肌细胞或上皮样细胞为主[5],因此可表现为持续强化(图2B-C);而MRI 平扫对于肝脏PEComa 中的脂肪成分更为敏感,含少量脂肪时即可通过同反相位见信号减低(图3A-B)。注射造影剂后,CT 与MRI 的强化方式类似,脂肪成分表现为轻中度不均匀强化,实质部分表现为动脉期明显不均匀强化,提示肿瘤富含血供。但也有病灶表现为门脉期强化减退,即类似于肝癌的“快进快出”式强化(图3C-F)[6],本研究中有9 例患者的肿瘤在影像学上出现上述影像学表现,虽然术前AFP 检查在正常范围内,但术前均被诊断为肝细胞癌,故选择手术治疗。由此可见肝脏PEComa 虽通过影像学检查可总结出一些特点,但由于不同组织学类型的肝脏PEComa 中构成肿瘤的组织比例不同,生物学行为也不完全相同,影像学的表现与其他肝肿瘤容易混淆,这给术前准确诊断带来一定困难[7-8],此次回顾性分析的病例中术前影像学诊断准确率仅为5.9%,故笔者认为术前影像学并不是肝脏PEComa 诊断的主要手段。
3.2 肝脏PEComa的病理学诊断
由于上述影像学诊断的不确定性,因此,在确诊肝脏PEComa 的过程中更倚重于术后的病理学检查。通过术中探查肿瘤及术后解剖标本可以发现,肝脏PEComa 多呈圆形或类圆形肿块,质软,色暗红,标本切开后呈鱼肉状,切面以灰黄、灰红居多;在组织学特点方面,可见肝脏PEComa 由平滑肌、脂肪组织和厚壁不规则血管以不同比例混合而成,部分血管壁透明变性,可见呈席纹状排列的上皮样细胞,或呈成束的梭形细胞,其中脂肪组织多见于AML,而上皮样组织多见于除AML 以外的PEComa[9];在免疫学表型方面,肝脏PEComa 特异性表达黑色素细胞标志物(HMB45、Melan-A、S-100 蛋白),肌源性标志物(SMA、肌凝蛋白和钙结合蛋白) 以及血管源性标记物(CD34)[10]。本研究中,SMA、HMB45、Melan-A 阳性率较高,均在90%以上。通过免疫表型的不同表现,还可以有助于PEComa 的鉴别诊断,如透明细胞肝癌通常不表达HMB45、Melan-A、SMA;神经内分泌肿瘤不表达HMB45、SMA;恶性黑色素瘤不表达SMA。有研究[11]表明,Ki-67 指数在肝良性肿瘤中一直很低,所以它是评价高分化肝恶性肿瘤的潜在辅助标志物;一般认为,当Ki-67>10%时提示肿瘤可能产生恶性生物学行为[12]。本研究中13 例患者进行了Ki-67 检查,其阳性指数介于2%~12%之间,也侧面证实了肝脏PEComa 呈惰性生长。
3.3 良恶性判断及预后
虽然肝脏PEComa 绝大多为良性肿瘤,但自从Damme 等[13]在2000年发现了首例恶性肝PEComa后,陆续有恶性病例被报道[14-17],于是2005年Folpe 等[1]根据肝脏PEComa 的恶性潜能进行了分级,当肿瘤不具备以下特征时,可以被认为是良性的或恶性风险较低:肿瘤直径>5 cm;呈浸润性生长;高级别核级和细胞高度密集;核分裂象>1/50 HPF;凝固性坏死;血管侵犯。而对于恶性肝脏PEComa 的转移风险,根据世界卫生组织对消化系统肿瘤的分类,与胃肠道间质瘤一样,其转移风险的主要预测因素包括:显著的核异型性,弥漫性多形性以及核分裂像>1/mm2[4]。根据上述规定,在本研究17 例肝脏PEComa 中,有潜在恶性的病例共8 例,目前随访情况来看愈后均良好,未发现恶性PEComa;同时笔者复习既往近20年国内外的肝脏PEComa 案例报道,共计176 例,术后随访中除5 例失访,复发患者仅2 例[18-28],结合上述笔者认为恶性肝脏PEComa 极为罕见。
3.4 肝脏PEComa的治疗方案
目前对于肝脏PEComa 的治疗方面,无论肿瘤的良恶性,手术切除仍是首选方案[29],笔者认为扩大范围的肝切除似乎对此类疾病暂无明确优势疗效,而术后规律随访则是此类疾病治疗方案的模块之一,特别是一些出现了临床症状,肿瘤体积较大或存在潜在恶性风险的患者,应延长随访时间。随着对肝脏解剖的再认识[30]、腔镜技术经验积累及手术设备的不断发展,微创肝切除已逐步成为此类疾患的主要手术方式,本次研究的后期6 例患者均接受了微创手术治疗。有研究[31]表明微创肝切除术具有术中失血量减少、恢复快的优势,且围术期并发症的发生率及远期预后无显著差异。除手术切除外,其他治疗方法如射频消融、动脉栓塞[26,32]等也偶有报道;另外从病因学的角度出发,肝脏PEComa 的病因可能与结节性硬化的肿瘤抑制基因(TSC1、TSC2)缺失突变有关[33],故也有报道[34]表明西罗莫司和依维莫司等mTOR 抑制剂可用于治疗PEComa。
综上所述,笔者认为肝脏PEComa 是一种临床上较为罕见的肝肿瘤,一般无特殊的临床表现,由于影像学诊断率较低,术前较易与肝癌混淆,故发现后如有临床症状或良恶性难以辨别时建议尽早手术切除治疗,术后病理学是其诊断的金标准,术后应进行长期规律随访,总体预后良好。
利益冲突:所有作者均声明不存在利益冲突。
