术中超声及术中超声造影在巨大肝恶性肿瘤手术治疗中的应用(附视频)
2022-08-03王子承段文斌魏荣光杨建辉段小辉毛先海刘昌军龚伟智
王子承,段文斌,魏荣光,杨建辉,段小辉,毛先海,刘昌军,龚伟智
(湖南省人民医院/湖南师范大学附属第一医院肝脏外二科,湖南长沙 410002)
巨大肝恶性肿瘤大多分化程度较差,常伴血管侵犯。近年来,随着对解剖的深入认识,新技术的应用,以及恶性肿瘤全身性综合治疗的蓬勃发展,部分巨大肝恶性肿瘤患者经过治疗后仍能获得令人满意的长期生存[1]。手术切除是巨大肝恶性肿瘤的重要治疗方法之一[2]。经过手术治疗,大肿瘤可以获得与小肿瘤相当的治疗效果[3]。巨大肝恶性肿瘤常占据多个肝段,部分患者还伴有子灶及肝内远处转移灶,为保证足够切缘和残肝体积,常使得肝脏切面不规则。其中巨块型肝细胞癌,往往合并肝硬化,导致手术时间延长及出血增多,巨大瘤体常压迫肝内脉管致使其移位,或形成脉管癌栓,手术难度增大。术中超声(intraoperative ultrasound, IOUS) 及术中超声造影(contrastenhanced intraoperative ultrasound,CEIOUS) 技术可探查肿瘤边界及子灶,判断肿瘤与脉管的位置关系,已广泛应用于临床[4]。现将湖南省人民医院2019年1月—2021年8月收治的28 例术中运用IOUS 及CEIOUS 指导手术治疗巨大肝恶性肿瘤的患者资料总结分析,以评价IOUS 及CEIOUS 在巨大肝恶性肿瘤手术治疗中的应用价值。
1 资料与方法
1.1 一般资料
28 例患者中,男性25 例,女性3 例;年龄19~76 岁,平均年龄(54.57±13.17)岁;术前体力活动状态(performance status, PS) 评分0~1 分,Child-Pugh 评分5~6 分,吲哚菁绿15 min 滞留率(ICG-R15)均<10%。依据影像学检查(B 超、CT、MRI)明确诊断,并在术前经过详细的临床分期评估,3D 成像及体积计算(标准残肝体积比均>46%)。
1.2 手术方法
1.2.1 切口选择 切口采用反“L”形切口,“鱼钩” 形切口及胸腹联合切口3 种切口方式(表1)。
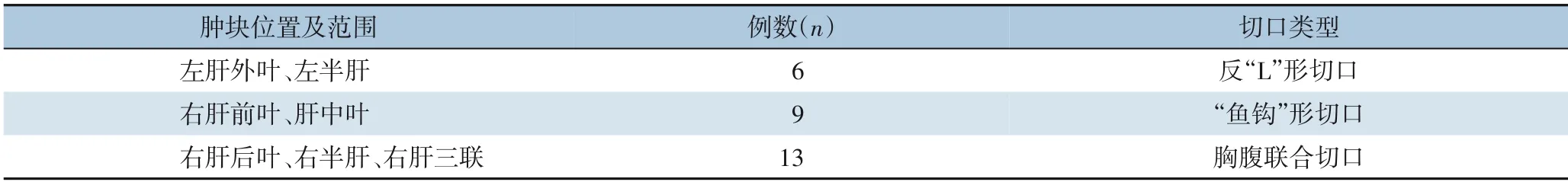
表1 切口方式的选择Table 1 Selection of incisions
1.2.2 手术要点 探查:明确腹腔内无转移病灶后,患者均使用日立阿洛卡交响60 (HITACHI ALOKA ARIETTA 60) 超声系统,选择MAKUUCHI探头(指间探头),中心频率调至5 MHz 或7.5 MHz,进行全肝的扫查,结合术前影像学检查,评估肿瘤体积,位置,边界,与Glisson 鞘及肝静脉关系,是否有子灶及肝内转移灶,是否有血管癌栓等情况,如在扫查过程中发现有可疑结节,再使用通用(GE)医疗的注射用全氟丁烷微球(Sonazoid,示卓安) 超声造影剂(0.12 µL/kg) 经静脉注射,同时在双幅造影模式下,对比观察可疑结节在动脉期,门脉期,延迟期以及Kupffer 期的变化,进一步明确结节性质,然后制定具体手术方案。游离切肝:充分游离目标肝段,对于肿块较大,位置相对固定,无法充分游离的病灶,IOUS 在肝脏表面标记目标Glisson 鞘的位置,切缘脉管的位置及走行,或满足切缘要求的不规则切面的走行,前入路肝实质优先途径离断目标Glisson 鞘,继续沿缺血分界线,切缘脉管或不规则切面离断肝实质,切肝时肝门间隔阻断每次15 min[5]。肝内转移灶的处理:对于IOUS 及CEIOUS 发现的肝内转移灶,行切除或微波消融后,IOUS 及CEIOUS 再次评估切肝范围或消融范围。癌栓的处理:IOUS 充分评估门静脉或下腔静脉癌栓的位置,边界,血管壁受侵范围,门静脉钳于超声探查边界位置以远阻断脉管,完整取出癌栓,肝素生理盐水冲洗血管内壁,5-0 或6-0 Prolene 缝线连续缝合管壁,松开门脉钳,观察有无出血。IOUS 及CEIOUS 在手术中的应用的相关图片及视频见图1 与视频1。
扫描至移动设备观看手术视频:
1.3 观察指标
统计分析患者的病理结果、手术方式、肿瘤大小、癌栓及肝内转移灶的情况、手术时间、术中出血量及输血量、术后住院时间及术后并发症等数据。
1.4 统计学处理
使用SPSS 21.0 软件包及GraphPad Prism 对数据进行分析。符合正态分布的计量资料以均数±标准差(±s)表示,不符合正态分布的计量资料以中位数(四分位间距)[M(IQR)]表示;计数资料采用例(百分数)[n(%)]表示。
2 结 果
2.1 手术方式及病理结果
手术切除范围涉及全部肝段(表2)。联合切除的脏器包括:胆囊切除20 例(71.43%),膈肌切除1 例(3.57%),胆囊合并部分膈肌切除3 例(10.71%),胆囊合并右肾上腺切除3 例(10.71%)及胆囊合并部分胃切除3 例(10.71%)。
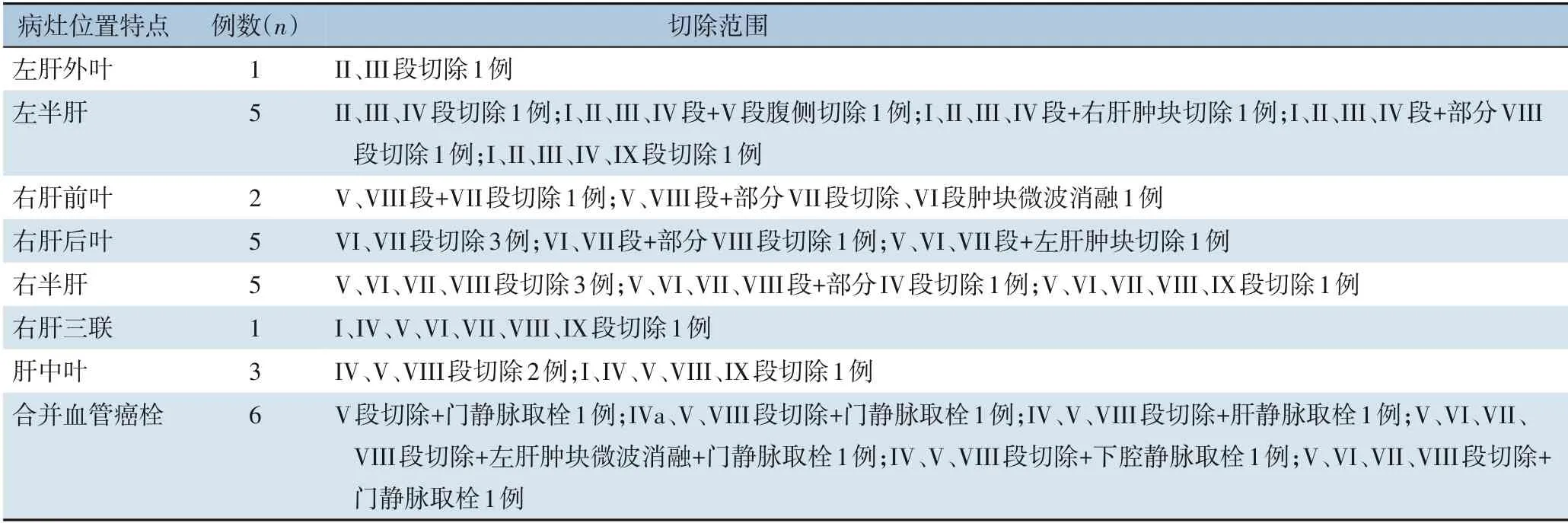
表2 巨大肝恶性肿瘤切除范围Table 2 Resection scope of giant hepatic malignant tumor
肿瘤最大径10~22 cm,平均最大径(13.07±3.57)cm。根据术后解剖标本及病理结果统计,其中,合并微血管癌栓(MVI)24 例(85.71%),合并肉眼可见血管癌栓11 例(39.29%); 肉眼可见癌栓患者中,肝细胞癌9 例(81.82%),胆管细胞癌1 例(9.09%),肝细胞癌合并胆管分化1 例(9.09%)。结合术前影像学(CT 或MRI)检查及IOUS,5 例肉眼癌栓合并瘤体整体切除;其余6 例需行血管切开取栓,其中4 例位于门静脉,1 例位于下腔静脉,1 例位于肝静脉,经IOUS 全部得到证实,定位并指导切开血管,完整取出癌栓。经术前阅片及IOUS,统计得出存在位于切缘附近的或影响手术方案的子灶及肝内远处转移灶者11 例,并记录位置及个数,其中9 例术前影像学结果与IOUS 结果一致;此外,IOUS 及CEIOUS 尚发现术前MRI 及CT 未显示的子灶及肝内远处转移灶3 例(表3),1 例行微波消融,2 例行切除,病理结果均为肝细胞癌。
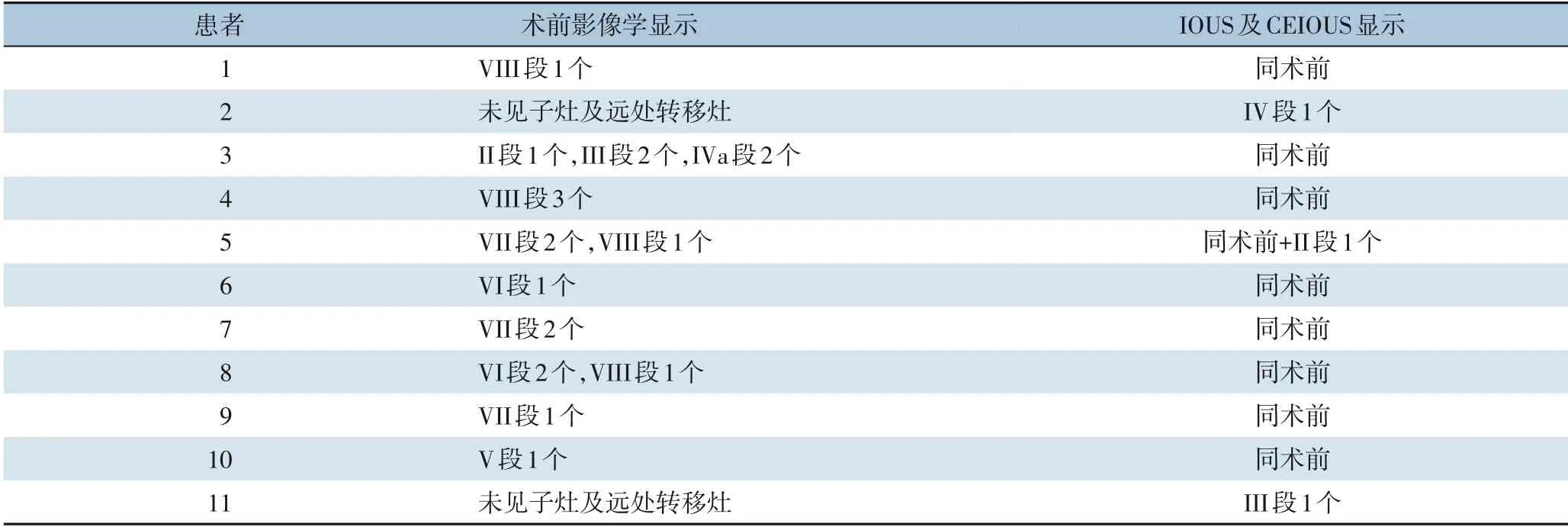
表3 子灶及肝内远处转移灶观察对比Table 3 Comparison of observation results of metastatic lesions and distant intrahepatic metastases
2.2 术中数据统计
手术时间 190~560 min, 平均 (365.18±110.45) min; 出血量 100~1 800 mL, 平均(598.21±414.43) mL;7 例术中输浓缩红细胞,输注量400~1 300 mL,平均(714.29±328.78)mL;其中6 例术中输新鲜冷冻血浆,输注量150~400 mL,平均(325.00±117.26)mL;肝门间隔阻断1~12 次,平均(4.82±2.36)次。
2.3 术后情况
术后住院时间8~28 d,平均(14.71±4.84)d。术后并发症 Clavien 分级统计: I 级 23 例(82.14%), II 级1 例 (3.57%), IIIa 级4 例(14.29%)。II 级1 例为术后第8 天复查CT 出现残余肝组织多发低密度灶表现(图2A),考虑灌注异常或病毒复制导致小范围肝组织斑片状坏死可能,予护肝及抗病毒治疗后好转。IIIa 级中3 例患者行胸腔穿刺引流,均未出现严重的肺部及胸腔感染(图2B);1 例患者术后51 d 于院外复查MRI 出现肝断面胆汁瘤(图2C),行B 超引导下胆汁瘤穿刺引流。
3 讨 论
巨大肝恶性肿瘤手术难点在于:⑴巨大肝恶性肿瘤常导致肝脏形态比例失调,旋转移位,尤其位于右半肝或右肝后叶的巨大瘤体,常难以充分暴露目标肝段;⑵肿块体积较大导致肝脏卡压于季肋区,操作空间小,且供操作把持的肝表面积较小;⑶肿块包膜张力高,挤压易破裂;⑷肿块挤压导致Glisson 系统及肝静脉系统紧贴肿块并发生位移,辨别游离困难,易误伤重要脉管;⑸合并门静脉,肝静脉或腔静脉癌栓时,难以明确癌栓的位置及范围,易造成癌栓挤压脱落,影响预后,甚至造成致命性栓塞性疾病;⑹因术前影像学检查的局限性导致部分子灶及肝内远处转移灶未发现,导致遗漏,影响预后。
对于巨大肝恶性肿瘤开腹手术,切口选择尤为重要。好的术野应满足以下条件:⑴便于游离肝脏;⑵充分显露目标肝段及重要脉管结构;⑶满足切肝入路和切面方向多变的要求。笔者认为,切口经牵拉后,上缘应尽可能与第二肝门位于同一垂直平面,下缘拐角处与脐的距离应以瘤体下缘为参考,切口右缘以瘤体右缘为参考,即:⑴瘤体位于肝中静脉左侧,如行左肝外叶,左半肝切除等,可选择反“L”形切口,由切口下缘拐角处向右或向第11 浮肋方向切开至腋前线或腋中线;⑵瘤体向右超过肝中静脉,但位于肝右静脉左侧,如行肝中叶切除,右肝前叶切除等,可选择“鱼钩”形切口,由切口下缘拐角处向第9 肋间方向切开至肋弓;⑶瘤体向右超过肝右静脉,如行右肝后叶切除,右半肝切除,右三联切除等,可选择胸腹联合切口,在“鱼钩”形切口基础上切断肋弓,继续切开第9 肋间肌,必要时切开膈肌暴露胸腔。本组根据肿块位置运用了以上3 种不同切口,显露效果满意。
游离及显露的困难使得解剖并阻断目标肝段的出入肝血流的难度增大,本组中部分患者因右肝肿块体积巨大,导致第一肝门游离困难,无法行区域性血流阻断[6]及肝短静脉的离断。对于此类患者,在常规行Pringle 阻断后,IOUS 可定位目标肝段供血支,标定肝表面投影位置,肝实质优先途径[7]套扎离断目标肝蒂[8],获得目标肝段切缘。尤其位于VII 段,VIII 段的肿瘤,其肝蒂位置较深在,IOUS 可降低切肝盲目性,减少出血及胆汁漏的发生,更符合解剖性肝切除要求。
解剖性肝切除可以为患者带来更好的围手术期和肿瘤学疗效[9-16]。而肝脏切面的把控是解剖性肝脏切除的关键,良好的肝脏切面应保证:⑴足够的切缘;⑵尽可能显露切缘脉管,减少切面分支脉管的离断,减少术后出血胆汁漏的发生;⑶当残肝体积位于临界范围时,尽可能减少正常肝组织的丧失。尤其当合并肝硬化时,肝再生往往较慢且不完全[17],残肝体积的保护就更加重要。目前术中确定切肝平面较为常用的技术是区域性血流阻断技术[18],缺血分界线确定切肝平面,但在离断肝实质过程中,缺少肝实质内部解剖标志,常导致切肝过程中指向性较差,甚至误伤保留侧肝组织的Glisson 蒂及回流静脉,损失残余肝体积,或因肝内潜在通路开放[19]导致的缺血分界线与Couinaud 分段不相符,即时缺血区与延迟缺血区不相符等情况[20],导致切肝平面更加难以把控。其他技术包括吲哚菁绿显影技术[21-24],美蓝染色技术等,此类方法要求术者具备熟练的超声引导穿刺技术,而且因染色剂向肝门方向逆流或肿瘤有多支门静脉供血等情况,常使得染色范围出现严重偏差。IOUS 可在术中进一步探查肿瘤与肝内主要血管位置关系,当肝脏翻动造成距离角度改变时,IOUS 可做到边探边切,不断修正切肝方向和深度,既保证切缘,又保证足够残余肝体积;还可多角度观察肿块与脉管的关系,并有助于发现肿瘤血管交通支,动静脉瘘,异位Glisson 蒂等,及时规避和处理,减少出血胆汁漏及感染的风险,更加精准地沿解剖标志推进。本组术后未出现致命性大出血,严重感染及肝功能衰竭,院内无胆汁漏发生。1 例患者于术后51 d 复查发现肝断面胆汁瘤形成,行腹腔穿刺引流后未见胆汁漏。
血管侵犯是影响肝细胞癌预后的危险因素[25-26],其中,合并门静脉癌栓发生率为44%~62.2%[27], 合并肝静脉癌栓发生率约为1.4%~4.9%[28]。对于此类患者,手术治疗仍为许多外科医生推荐[29-30],治疗效果优于非手术治疗[31-33]。完整取出癌栓是提高治疗效果的保证。IOUS 可精确定位癌栓部位及范围,术者可根据IOUS 决定癌栓处理方案。本组1 例患者下腔静脉癌栓靠近膈肌水平,此患者手术愿望强烈,经术前充分评估,有联合开胸可能,后经IOUS 定位,明确癌栓近心端未超出膈肌水平,未进入胸腔,且留有足够阻断空间,IOUS 指引下门静脉钳阻断癌栓近心及远心端,完整取出癌栓,减少患者手术创伤。
近年来,超声造影(contrast-enhanced ultrasound,CEU)技术已经成为肝细胞癌诊断中常用的影像学方法[34],可提高诊断的特异性[35]。同时有研究[36]显示,CT、MRI 及IOUS 对原发性肝癌的诊断敏感度分别为90.9%、93.0%和99.3%。肝细胞癌超声造影动脉期明显强化[37],CEIOUS 利用全氟丁烷微球造影剂可获得Kupffer 成像期,显影时间长,便于切肝过程中反复扫查,帮助鉴别诊断巨块型肝细胞癌子灶,并即时调整切缘,达到Enblock 切除;还可以发现术前影像学检查未发现的肝内远处转移灶,指导手术方案的调整,减少残余肝体积不足和术后肝功能衰竭的发生,同时提高远期疗效。本组3 例患者术前磁共振结果显示位于右肝的巨块型肝癌,余肝未报转移灶,IOUS 及CEIOUS 发现位于左肝内的远处转移灶,行转移灶消融及切除术;其中1 例术前拟行右半肝切除,IOUS 及CEIOUS 发现III 段直径约1 cm 转移灶,并呈典型“快进快出”表现,延迟相回声较肝实质明显降低;如按原手术方案行右半肝切除,再行左肝肿块切除,会增加术后小肝综合征发生的风险,遂决定改行V、VI、VII 段切除,III 段部分切除,保留VIII 段。术后恢复顺利。左肝外叶肿块行术中快速病理检查及术后病理检查均回报为肝细胞癌。
胸腔积液是肝切除术后常见的并发症,其发生是多种因素导致的[38]。IOUS 指导巨块型肝恶性肿瘤切除,有利于减少术中过度的翻动游离和不必要的损伤,有利于减少胸水的形成。少量胸腔积液可通过口服利尿药,限制输液量促进其吸收。本组患者因胸腔积液行胸腔穿刺引流3 例(11.7%)。无1 例患者出现严重的肺部及胸腔感染。
综上所述,经术前充分评估,对于可切除的巨大肝恶性肿瘤患者,IOUS 及CEIOUS 可优化手术流程,修正手术方案,对于保障术中安全,术后恢复及远期治疗效果有重要意义。
利益冲突:所有作者均声明不存在利益冲突。
