SII、proGRP、GPS、mGPS与小细胞肺癌一线化疗疗效及无进展生存期关系
2022-08-03张涛涛吴月敏刘黎明
张涛涛,吴月敏,刘黎明
(蚌埠医学院第一附属医院呼吸与危重症医学科,安徽 蚌埠 233000)
肺癌根据组织病理学诊断主要分为非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC),其中SCLC以增殖快速、恶性程度较高、早期广泛转移为特征,初次确诊时有60%~88%已有脑、肝、骨、肾上腺转移,由于早期诊断不足,SCLC患者的生存期较短,大部分患者明确诊断6个月后即出现进展,预后不佳[1-2]。通过临床实践发现,即使SCLC患者处于相同的临床分期,治疗模式相同,SCLC患者的生存期也存在差异。因此,需要探索一种可以大致区分这些不同生存期的SCLC患者的指标。目前有研究提示系统免疫炎症指数(SII)、格拉斯哥预后评分(GPS)、改良GPS(mGPS)、胃泌素释放肽前体(proGRP)与SCLC的预后相关[3],并在临床普遍应用。研究报道,在SCLC患者中,proGRP没有预后价值[4],而另有研究发现,proGRP水平升高导致生存期显著缩短[5]。这些结果可能是由不同研究中使用的不同肿瘤标记物阈值水平引起的。因此,应继续研究proGRP与SCLC预后的关系。目前上述指标在应用单纯化疗后出现进展的SCLC中的研究尚少[6-9]。本研究旨在探讨SII、proGRP、GPS、mGPS和SCLC单纯应用EP方案化疗疗效及无进展生存期(PFS)的关系,寻求可作为评估SCLC一线化疗疗效的指标,为后续的临床研究提供线索。
1 资料与方法
1.1 一般资料 选择2013年11月至2018年11月我院收治的102例SCLC患者为研究对象,均经纤维支气管镜或B超、CT引导下经皮肺穿刺获取肿瘤组织,经病理组织学确诊,其中男81例,女21例;年龄35~84岁,中位年龄59岁;有吸烟史69例;体力状况评分(PS评分,ZPS法)0分49例,1分53例;临床分期广泛期61例,局限期41例。
1.2 纳入和排除标准 纳入标准:(1)通过纤维支气管镜活检或经皮肺穿刺活检获取肿瘤组织,经病理组织学检测证实为SCLC的患者;(2)PS评分为0~1分;有完整的病历资料;(3)至少接受连续2个周期的EP方案化疗,且初次化疗前1周内均接受血常规、生化常规(包含血清C反应蛋白检查项目)及proGRP的检测;(4)仅接受单纯EP方案化疗后出现进展的SCLC患者。排除标准:(1)合并其他原发恶性肿瘤者;(2)严重肝肾功能不全、入院前有感染证据的患者,如肺部感染、泌尿系统感染等;(3)入院前有血液系统及免疫系统疾病的患者;(4)近期应用了影响白细胞数量的药物患者;(5)接受了单纯EP方案化疗以外的治疗模式后出现进展的SCLC患者,如同步放化疗、化疗续贯胸部放疗、预防性颅脑照射、免疫治疗等;(6)临床资料不全患者。
1.3 化疗方案 依托泊苷0.1 g/d,d1~d5;顺铂总量为120 mg,d1~d4。所有患者初次及进展前均接受上述静脉化疗方案。21 d为1个周期,至少接受2个周期的化疗。
1.4 观察指标 (1)收集患者的临床资料及初次化疗前1周的外周血炎性因子(血小板计数、中性粒细胞计数、CRP)及血清白蛋白(ALB)、proGRP数据,计算出系统免疫炎症指数SⅡ(SⅡ=外周血小板计数×外周血中性粒细胞计数/外周血淋巴细胞计数),根据GPS及mGPS标准[10-11]对每例患者评分。通过建立受试者工作特征(ROC)曲线,确定首次化疗前外周血proGRP预测患者进展的最佳截点值为2 977.40 pg/L,SII预测患者进展的最佳截点值为1 173.97。根据截点值将患者分为高 proGRP组 (proGRPS≥2 977.40 pg/L)、低proGRP组(proGRPS<2 977.40 pg/L)以及高SⅡ组(SⅡ≥1 173.97)、低SⅡ(SⅡ<1 173.97)组。根据GPS评分及mGPS评分标准分为GPS评分0分组、GPS评分1~2分组和mGPS评分0分组、mGPS评分1~2分组。
1.5 疗效评价方法 SCLC患者每2个化疗周期结束后完善胸部CT平扫进行疗效评价,按照RECIST1.1标准[12],化疗疗效分为完全缓解(CR)、部分缓解 (PR)、稳定 (SD)、进展(PD)。PFS是指肿瘤患者从治疗开始到出现疾病进展或因任何原因死亡的这段时间。客观缓解率(ORR)=(CR人数+PR人数)/总人数×100%,疾病控制率(DCR)=(CR人数+PR人数+SD人数)/总人数×100%。在随访截止时依然没有出现疾病进展或死亡的均以末次疗效评价的日期作为标准。
1.6 统计学方法 采用SPSS 24.0软件进行统计学分析,计数资料比较采用χ2检验,如果理论频数小于5,采用Fisher确切概率法计算。PFS运用Kaplan-Meier法进行分析,并进行Log-rank检验。采用Cox回归模型进行PFS的影响因素分析。P<0.05为差异有统计学意义。
2 结果
2.1 不同临床特征SCLC患者在不同水平的GPS、mGPS及SII、proGRP间的比较 SCLC患者初次化疗前外周血高proGRP水平组和低proGRP水平组在临床分期上比较差异有统计学意义(P<0.01);其余比较差异无统计学意义(P>0.05)。见表1、2。

表1 GPS、mGPS与SCLC患者一般临床特征的关系[n(%)]
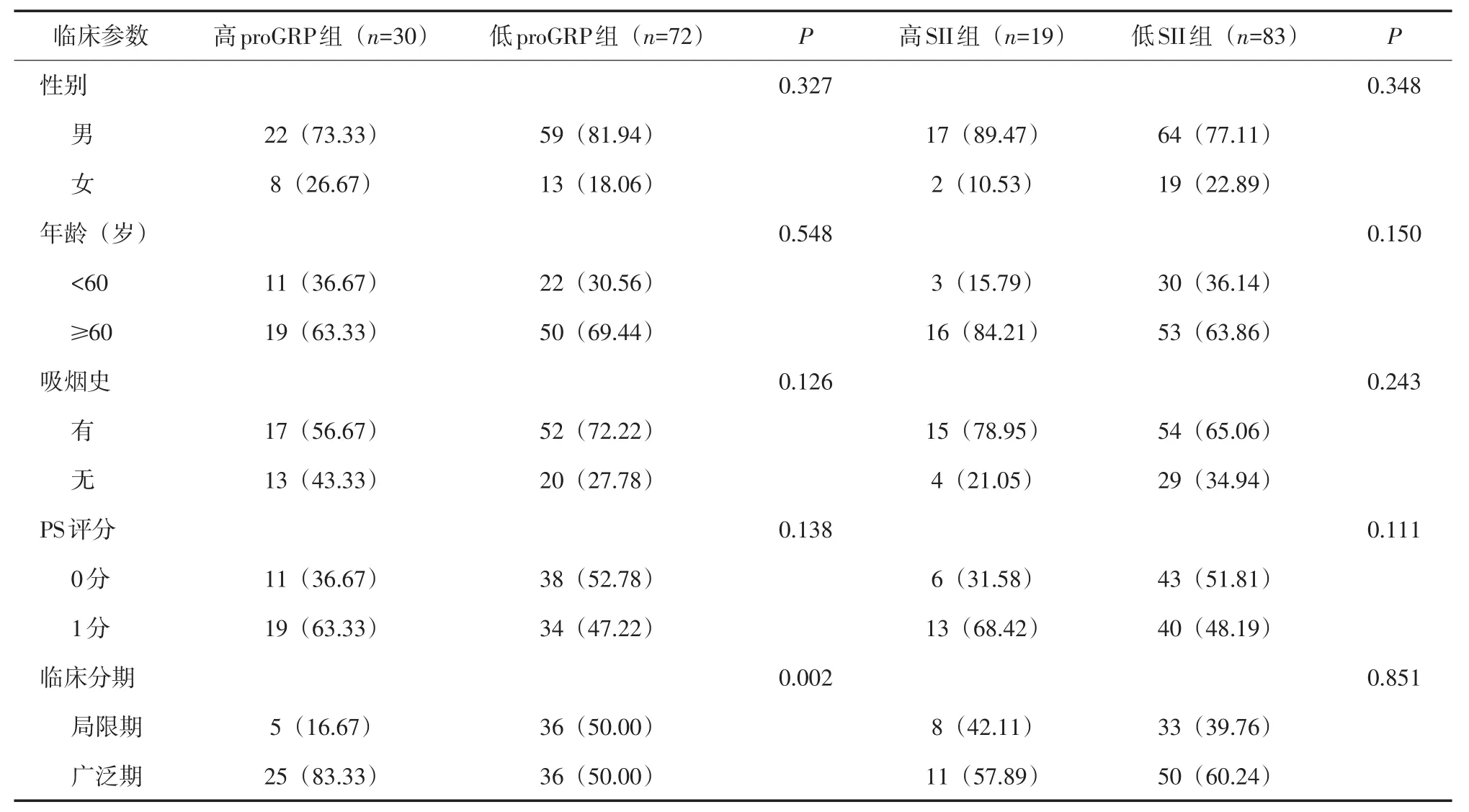
表2 SII、proGRP水平与SCLC患者一般临床特征的关系[n(%)]
2.2 GPS、mGPS及不同SII水平、proGRP水平与近期化疗疗效的关系 102例SCLC患者在连续化疗2个周期后,进行胸部CT平扫,进行初次疗效评估,PR 73例,CR 5例,SD 20例,PD 4例,总体ORR为76.47%,总体DCR为96.08%。其中低proGRP组患者ORR显著高于高proGRP组,高SII组患者ORR显著高于低SII组,差异均有统计学意义(P<0.05);其余不同分组ORR、DCR比较差异均无统计学意义(P>0.05)。见表3。
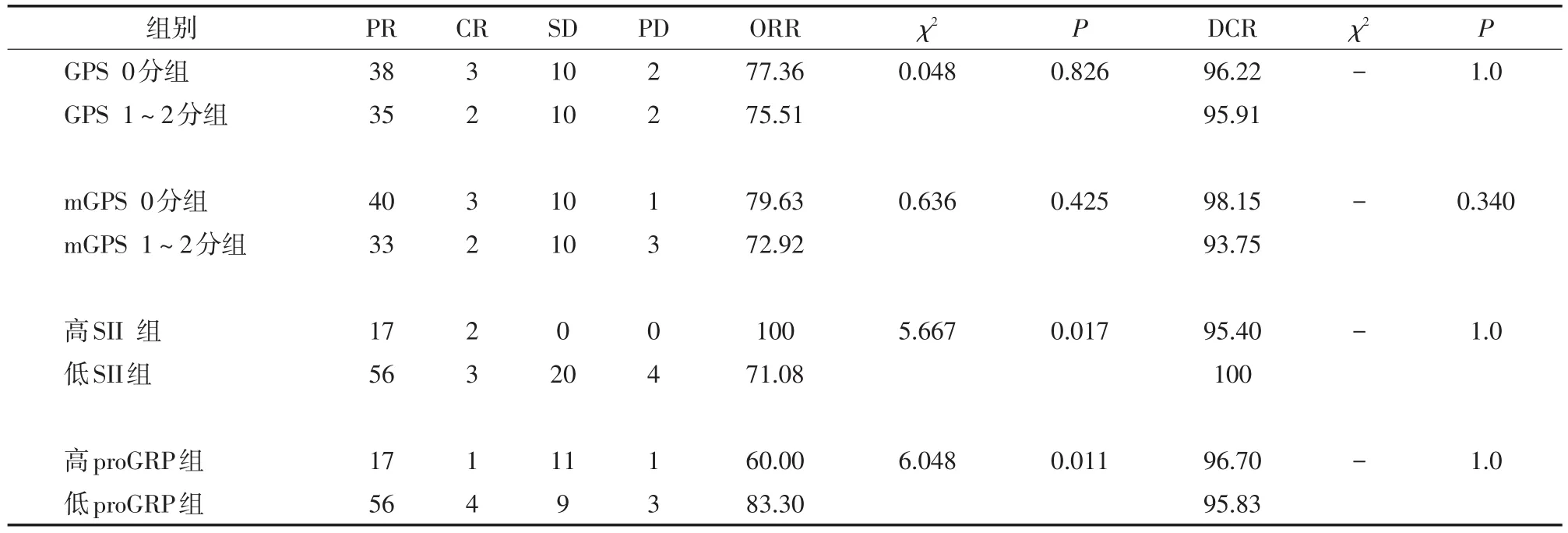
表3 GPS、mGPS及不同SⅡ水平、proGRP水平与近期化疗疗效的关系
2.3 GPS、mGPS及不同SII水平、proGRP水平与PFS的关系 应用Kaplan-Meier方法进行PFS单因素分析,并绘制生存曲线,采用Log-rank检验进行组间比较,结果显示,临床分期、proGRP与PFS均相关,差异有统计学意义(P<0.05)。性别、年龄、吸烟史、PS评分、GPS、mGPS、SII与PFS无关,差异无统计学意义(P>0.05)。见表4。
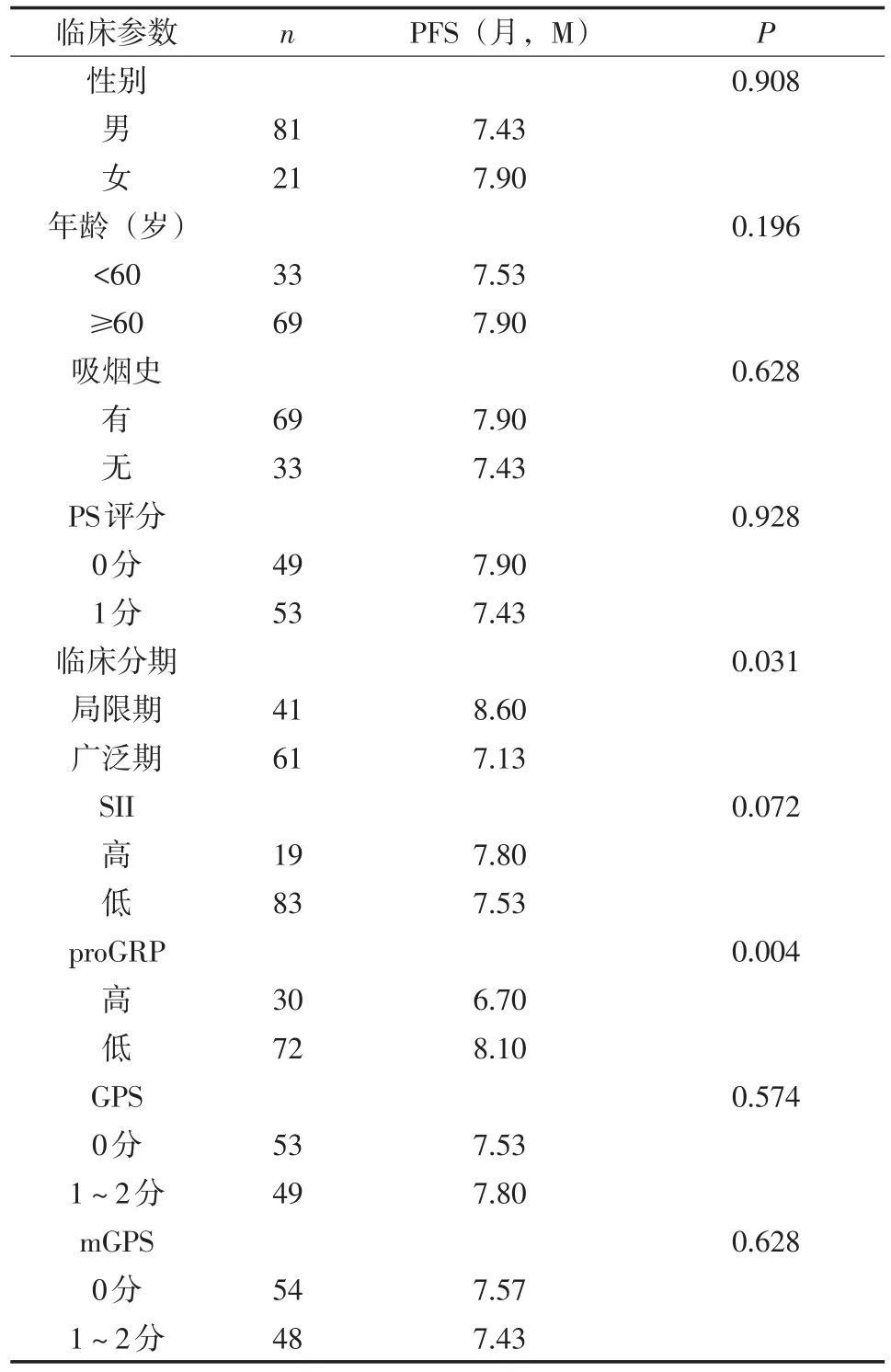
表4 影响SCLC患者PFS单因素分析
2.4 PFS多因素分析 采用COX比例风险回归模型进行PFS多因素分析,将单因素分析有统计学意义的因素纳入多因素分析,结果显示,proGRP水平与PFS相关(HR=1.739,95%CI=1.090~2.773,P<0.05),是PFS独立的预后因素,SII水平、GPS、mGPS、临床分期与PFS无关。
3 讨论
本研究以疾病出现进展为研究终点,研究对象为接受单纯EP方案化疗后出现进展的SCLC患者。在PFS单因素分析中,初次化疗前外周血高proGRP水平的患者较低proGRP水平的患者PFS短(6.7个月与8.1个月,P=0.004),本文结果与目前文献研究结果[13-14]一致;连续化疗2个周期后进行疗效评价,本研究表明初次化疗前低proGRP组患者ORR优于高proGRP组患者(83.30%与60.00%,P=0.001)。尽管高proGRP的水平是预测SCLC预后的有用标志物,但SCLC患者若存在肾功能不全,proGRP也可明显升高[15]。在健康成人受试者中,proGRP水平有随年龄增长而增加的趋势,表现为女性的浓度略高于男性,吸烟者的浓度更高,身体较高的个体的浓度更高。proGRP主要由肾脏代谢,尤其是慢性肾功能衰竭患者,血清proGRP水平更高。因此,建议在检测proGRP同时进行肌酐测定。所以,如果使用proGRP预测SCLC患者的PFS、评估疗效、辅助临床分期时,应首先明确患者是否有肾功能不全。疗效评价的结果中,高SII组患者SD、PD人数均为零可能是因为为样本量太少的原因。本研究中GPS、mGPS、SII和SCLC患者PFS关系的研究与目前国内外文献存在差异,原因可能如下,大部分SCLC患者入院前存在咳嗽、咳痰症状,外院往往先按照肺炎给予抗感染治疗,该治疗过程是否会对入院初次化疗前的中性粒细胞、淋巴细胞、血小板以及CRP产生影响,从而对SII、GPS、mGPS产生影响;SII的阈值水平也可能对结果产生影响。本研究为回顾性研究且样本量太少,仅有102例,属于单中心研究,非随机对照研究,纳入的患者数量以及样本量有限,其次proGRP的阈值水平也可能对结果产生影响。必需进一步研究,以便得到稳定的结果。
综上所述,接受单纯EP方案化疗后出现进展的SCLC患者,初次化疗前proGRP水平可作为一线化疗疗效的预测指标,且可以作为SCLC患者PFS的独立影响因素。
