结核分枝杆菌Rv1729c基因编码的S-腺苷甲硫氨酸依赖性甲基转移酶的表达及生物信息学分析
2022-08-03陶香林吴欢孙恩涛叶长江文育锋
陶香林,吴欢,孙恩涛,叶长江,文育锋
(1.皖南医学院检验学院,安徽 芜湖 241002;2.皖南医学院公共卫生学院)
结核分枝杆菌耐药已成为结核病防控的重大挑战[1]。因结核分枝杆菌的细胞壁的多肽多糖层周围有大量的分枝菌酸,不仅阻止抗菌药物等进入结核分枝杆菌内,还能帮助结核分枝杆菌逃避宿主免疫系统的识别[2-3]。因此,参与合成分枝菌酸的酶已成为治疗耐药性结核病的有效药物靶点。在这些酶中,S-腺苷蛋氨酸依赖甲基转移酶(SAM-MTs)被证明对分枝菌酸的合成和化学修饰起重要作用[4-5]。SAM-MTs是甲基转移酶家族的一种[6],参与细胞壁内氨基酸、脂肪等物质的形成和转化。有研究表明,SAM-MTs能在分枝菌酸的特定位置引入关键的化学修饰,这对结核分枝杆菌的毒力和细胞壁通透性至关重要。编码SAM-MTs中间体的基因失活会抑制分枝菌酸的合成[7-8]。根据GenBank数据库,在结核分枝杆菌H37Rv株中至少有12个基因编码SAM-MTs,Rv1729c基因是其中之一。此外,已有研究表明Rv1729c基因可能与异烟肼耐药相关[9],但其具体机制和功能仍未明确。本研究对Rv1729c基因的生物学功能进行了初步研究,以探索结核分枝杆菌耐药的潜在靶点。扩增、克隆并表达Rv1729c基因,并利用生物信息学工具对Rv1729c基因的生物学特性进行预测和分析。
1 材料与方法
1.1 菌株和载体 结核分枝杆菌H37Rv菌株由江苏省疾病控制中心慢性传染病防治所惠赠。感受态的大肠杆菌DH5α和BL21购自天根生物科技(北京)有限公司,pET28a和pMD-19T质粒购自宝生物工程(大连)有限公司。
1.2 主要试剂 2×Taq Master Mix、质粒抽提试剂盒、胶回收试剂盒购自天根生物科技(北京)有限公司。
1.3 结核分枝杆菌基因组DNA的提取 用接种环刮取少量H37Rv菌株培养菌苔,在磨菌管中将其磨碎,加入500 μl STE(0.1 mol/L NaCl,10 mmol/L Tris,1 mmol/L EDTA,pH 8.0)溶液重悬菌液。100℃煮沸30 min灭活菌体。12 000 r/min离心20 min,沉淀重悬于 500 μl TE缓冲液(10 mmol/L Tris,1 mmol/L EDTA,pH 8.0)中。加入蛋白酶K至终浓度0.5 mg/ml,10%SDS溶液至终浓度0.5%,56℃孵育1 h。加入等体积的Tris-Cl饱和酚,轻轻上下颠倒混匀约5 min,以使蛋白充分变性,12 000 r/min离心5 min,取上清。小心吸取上清至另一干净1.5 ml离心管,加入等体积的氯仿∶异戊醇(24∶1),12 000 r/min离心5 min,取上清。重复本步骤,直至分界面几乎看不到白色的蛋白层为止。小心吸取上清至另一干净1.5 ml离心管,加入2倍体积的无水乙醇、1/10倍体积的3mmol/LNaAC(pH5.2)溶液,充分混匀,于-20℃放置约1~2 h沉淀DNA,12 000 r/min离心20 min。小心倒弃上清,沉淀用500 μl 70%乙醇离心洗涤2次,置于超净台上室温吹干,最后将其溶解于200 μl含有RNA酶的TE缓冲液中,-20℃保存备用[10]。
1.4 引物设计与合成 根据Genbank中H37Rv的Rv1729c基因编码序列,长度为939 bp。用Primer 5.0软件设计引物,上游引物5′-ATTCTCGAGCGGTGAAATGGAAGAGTG-3′,下 游 引 物 :5′-ATAGAATTCGACGACGACAACTGGGAT-3′,分别插入Xho Ⅰ和EcoR Ⅰ的酶切位点。引物由上海生工生物工程技术服务有限公司合成。
1.5 目的基因PCR扩增 以H37Rv基因组DNA作为模板进行PCR反应。PCR扩增体系(50 μl):无菌双蒸水 22 μl,2×Taq Master Mix 25 μl,上、下游引物各1 μl,DNA模板1 μl。PCR反应条件:95℃预变性5 min,95℃变性30 s,60℃退火30 s,72℃延伸60 s,共35个循环;72℃延伸10 min。PCR扩增产物经1%琼脂糖凝胶电泳鉴定。
1.6 克隆载体的构建 将PCR产物纯化回收与克隆载体pMD-19T经Xho Ⅰ和EcoR Ⅰ双酶切,然后将酶切产物在1.2%的琼脂糖凝胶电泳后切胶回收。按照1∶3的比例用T4连接酶16℃过夜连接,并设立对照组。转化大肠杆菌DH5α后,采用质粒的快速抽提方法及酶切筛选鉴定重组子。挑取单克隆送宝生物工程(大连)有限公司公司测序,通过NCBI上的Blast进行比对分析。
1.7 Rv1729c基因的表达和纯化 重组质粒pET-28a-Rv1729c转化大肠杆菌BL21感受态细胞。重组体在含50 μg/ml卡那霉素的LB琼脂平板上筛选。采用不同浓度的IPTG(0.2、0.4、0.6、0.8、1.0、1.2、1.4 mmol/L)、不同诱导时间 (1、2、3、4、5、6、7、8 h)和不同温度(20、24、28、32、36、40、44℃)诱导表达重组蛋白。提取蛋白进行12%SDS-PAGE电泳分析,考马斯亮蓝染色后观察蛋白条带。
细胞裂解液过HisPur™Ni-NTA柱,蛋白用15 ml洗脱液洗脱(50 mmol Tris,200 mmol NaCl,500 mmol咪唑),小心吸取上清液进行12%SDS-PAGE电泳检测。
1.8 Rv1729c基因编码SAM-MTs的生物信息学分析 用蛋白质分析系统Expasy中的在线工具Protparam对蛋白质的一级结构及氨基酸组成、相对分子质量、理论等电点、分子式、半衰期、不稳定系数、脂肪系数等理化性质进行分析;用ProtScale对分析蛋白的亲(疏)水性。用Signal P 4.1 Server信号肽分析服务器预测信号肽及位置;应用TMHMM Server v.2.0分析蛋白跨膜区螺旋;用SSPro:Secondary Structure服务器预测蛋白质二级结构。利用Motif Scan分析蛋白的翻译后修饰位点。将蛋白序列提交至蛋白质分析系统EXPASYP Proteomic三级结构模型组装软件SWISS-MODEL模拟蛋白的三级结构[11-14]。利用ABCpred预测SAM-MTs蛋白的B细胞抗原表位;HLA-A*0201限制性CTL细胞表位采用IEDB和NetMHC 4.0 Server来预测[15-16]。
2 结果
2.1 Rv1729c基因的扩增、克隆及序列分析Rv1729c基因经PCR扩增,产物大小与预计相符,约923 bp(图1A)。将PCR产物克隆于pMD-19T中(图1B)和pET-28a质粒中(图1C),挑选经酶切鉴定正确的克隆,经正反向全自动序列分析显示,Rv1729c基因的GC含量为62.73%,起始密码子和终止密码子分别为GTG和UGA,所得序列结果通过NCBI的Blast进行比对分析,与MTB标准株核苷酸同源性为100.00%,在结核分枝杆菌H37Rv株全基因组中位于1954631~1955569。
2.2 Rv1729c基因编码的SAM-MTs蛋白的表达 重组质粒pET-28a-Rv1729c转化大肠杆菌BL21感受态细胞并诱导表达蛋白。SDS-PAGE显示SAMMTs蛋白成功表达,分子量约35 kDa。在不同的诱导时间、不同的IPTG浓度和不同的温度下诱导蛋白,确定最佳诱导条件:IPTG的浓度为0.4 mmol/L,时间为7 h,温度为20℃,见图2、3、4。
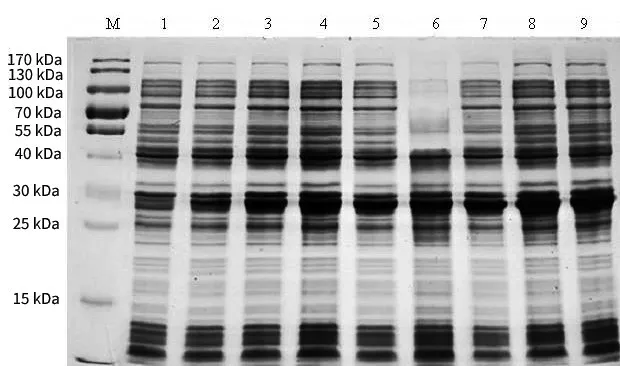
图3 不同的诱导时间下SAM-MTs(Rv1729c)蛋白表达情况
2.3 SAM-MTs(Rv1729c)蛋白用Ni-NTA树脂亲和层析成功纯化 纯化结果显示目的蛋白为分子量约35 kDa的可溶性蛋白(图5A)。在NC膜上检测到一条35 kDa分子量的强条带,对相同样品进行Western blot分析,证实所观察到的蛋白条带与特异性抗体发生了反应(图5B)。
2.4 Rv1729c基因编码SAM-MTs的生物信息学分析
2.4.1 SAM-MTs的理化性质 Rv1729c基因编码SAM-MTs由312个氨基酸组成,其中含量最多的氨基酸为Ala和Leu,分别占13.8%和9.6%。该蛋白理论相对分子量为33 654(33.654 ku),原子总数4 722,分子式为C1496H2352N408O457S9,理论等电点4.75,带负电荷氨基酸残基(Ala+Glu)总数为39,带正电荷氨基酸残基(Arg+Lys)总数为28,脂溶性系数91.41,半衰期30 h。不稳定指数31.41,低于阈值40,分类为稳定蛋白。利用ProtScale对蛋白的亲疏水性进行预测,疏水性平均得分-0.006(正值和负值分别代表疏水性和亲水性)(图6),为亲水性蛋白。利用在线软件SignaIP 4.1预测氨基酸的序列中无信号肽。运用TMHMM server v.2.0软件分析SAM-MTs位于细胞膜表面,不是跨膜蛋白。
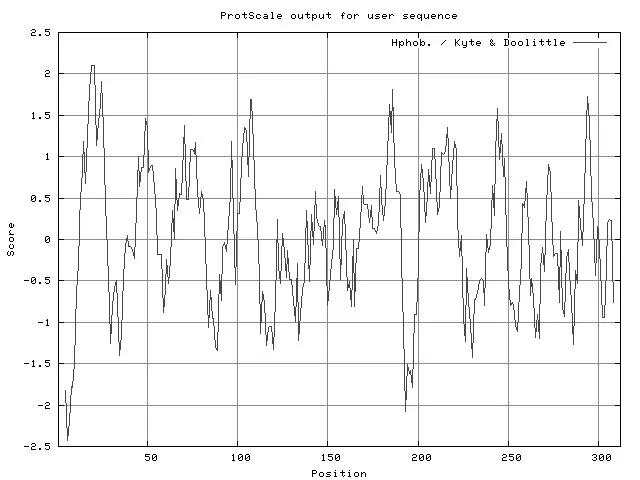
图6 Rv1729c基因编码的SAM-MTs蛋白的亲(疏)水性
2.4.2 SAM-MTs的二级结构 利用在线分析软件,在线提交Rv1729c基因编码SAM-MTs的氨基酸序列后,分析得到蛋白质二级结构,其中无规则卷曲(C)148个(占47.4%),α螺旋(H)127个(占40.7%),β折叠(E)37个(占11.9%)(图7),提示该蛋白和螺旋无规则卷曲含量高,结构较松散。

图7 Rv1729c基因编码SAM-MT的二级结构
2.4.3 SAM-MTs的翻译后修饰位点 经Motif Scan分析,Rv1729c基因编码的SAM-MTs共有2个N-糖基化位点(95~98、01~204),6个酪蛋白激酶Ⅱ磷酸化位点(4~7、66~69、109~112、141~144、271~274、279~282),4个酰基化位点(16~21、146~151、209~214、269~274)。
2.4.4 SAM-MTs的三级结构 利用SWISS-MODEL模拟Rv1729c基因编码SAM-MTs的三级结构,9~297为氨基酸序列与putative S-adenosyl-l-methionine-dependent methyltransferase ML2640能够进行同源建模。
2.4.5 B细胞抗原表位 通过ABCpred server预测SAM-MTs的B细胞抗原表位为18~33、24~39、34~49、 55~70、 116~131、 126~141、 149~164、228~243、 245~260、 268~283、 283~298 和 290~305等,其中最具优势的5个抗原表位(临界值为0.85),见表1。
2.4.6 T细胞抗原表位 通过NetMHC和IEDB在线的HLA-A*0201对SAM-MTs蛋白预测分析,得到限制性CTL细胞8个优势表位(百分比排名>90%) 为 32~40、 94~102、 122~130、 136~144、149~157、224~232、258~266和272~280,见表2。
3 讨论
Rv1729c是编码SAM-MTs的基因之一,参与了分枝菌酸修饰,但其具体功能和机制尚未被研究。有研究表明,敲除SAM-MTs编码基因可抑制分枝菌酸的合成,从而降低细胞壁对药物的通透性[4,17]。此外,Rv1729c基因被认为与结核分枝杆菌耐异烟肼有关[7,9]。
本研究成功扩增H37Rv标准菌株Rv1729c基因并克隆表达。该蛋白诱导表达IPTG的最佳浓度为0.4 mmol/L,最佳表达时间为7 h,温度为20℃。Western blot鉴定表达蛋白分子量为35 kDa。
本研究表明SAM-MTs是一种稳定的、疏水的、非跨膜的、结构松散的蛋白,其理论等电点为4.75。亲水性分析表明,SAM-MTs的亲水性位点与SAM-MTs的抗原位点高度相关。在结核分枝杆菌中识别SAM-MTs的B细胞表位和T细胞表位可激发特异性免疫反应,包括了解其发病机制、开发诊断方法、设计基于肽基的疫苗以预防感染[18]。本研究通过在SAM-MTs中发现具有潜在优势的B细胞和T细胞表位,探讨SAM-MTs在耐药中的作用。此外,抗原表位赋予了抗原特异性,抗原表位可以通过蛋白二级结构分析预测[19]。结果表明,SAM-MTs是一个结构松散的蛋白,具有47.4%的无规卷曲,11.9%的β-转角二级结构。二级结构表面的无序卷曲和β-转角有利于抗原与抗体的结合,成为抗原表位的首选。三级结构同源性建模显示SAM-MTs与假定的S-腺苷甲硫氨酸依赖甲基转移酶ML2640具有高度相似的序列。这一发现提供了更多SAM-MTs的立体构象信息,对研究SAM-MTs的结构与功能关系具有重要意义。在SAM-MTs中有2个N-糖基化位点、6个酪蛋白激酶Ⅱ磷酸化位点和4个酰化位点,这些位点对SAM-MTs的加工、成熟和生物调控至关重要[20]。
