头颈鳞癌与中心碳代谢通路研究
2022-08-02黄鑫闫申阮宏莹
黄鑫,闫申,阮宏莹,3
(1.天津医科大学一中心临床学院,天津 300192;2.天津医科大学口腔医学院,天津 300070;3.中南大学湘雅医学院附属海口医院耳鼻咽喉头颈外科,海口 570000)
头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)是一种死亡率较高的恶性肿瘤,目前的治疗方法以手术治疗为主,严重损害患者外观和功能(呼吸、发音和吞咽)[1]。由于诊断不够及时和治疗的困难性,HNSCC 患者的5 年生存率并不理想[1]。近年来,高通量和质谱技术不断应用在肿瘤研究中,转录组学、蛋白质组学和代谢组学促进了肿瘤的精准治疗。多组学整合分析提高了对复杂癌变过程的全面认识,弥补了单一组学的不足。平行反应监测(parallel reaction monitoring,PRM)应用于定量蛋白质组学,具有良好的敏感性、特异性和对背景肽段的抗干扰性[2]。代谢重编程被认为是肿瘤标志之一[3],其产生的酸性缺氧的肿瘤微环境能够促进肿瘤转移[4]。肿瘤有突出的代谢适应性,能够不利用氧迅速提供能量,从而促进肿瘤进展[5]。因此研究头颈鳞癌的代谢改变对HNSCC 患者的治疗具有重要意义。
本研究首次通过转录组学、蛋白质组学和代谢组学探讨了HNSCC 的代谢重编程。通过多组学和PRM 的共同研究,证实了肿瘤中心碳代谢通路以及相关蛋白表皮生长因子受体(EGFR)、磷酸甘油酸酯变位酶1(PGAM1)、乳酸脱氢酶A(LDHA)、己糖激酶3(HK3)、磷酸果糖激酶(PFKP)在头颈鳞癌中的作用。本研究为探索HNSCC 的诊断和治疗提供了新的方向。
1 材料与方法
1.1 临床样品采集 组织样本取自天津市第一中心医院确诊并手术的10 例头颈鳞癌患者,每例患者术中切除了肿瘤组织和癌旁组织,直接放入液氮中,并储存于-80℃。本项研究获得了天津市第一中心医院伦理委员会的批准(2019N182KY),所有患者均知情同意。
1.2 转录组学研究 Trizol 法提取样本总RNA,使用NanoPhotometer®分光光度计(IMPLEN,美国)检测A260/A280、A260/A230。使用Bioanalyzer 2100 系统(Agilent,美国)评估RNA 完整性。样品检测合格后,用带有Oligo(dT)的磁珠富集真核生物的mRNA。合成cDNA,纯化,末端修复、加A 尾并连接测序接头,然后用AMPure XP beads 进行片段大小选择,最后进行PCR 富集得到最终的cDNA 文库。文库构建完成后,对文库的插入片段长度和有效浓度进行检测,以保证文库质量。文库质控合格后在Illumina HiSeq 平台(Illumina,美国)上测序[6]。
1.3 代谢组学研究样本于4℃下缓慢溶解后,使用甲醇/乙腈/水溶液(2:2:1)处理后取上清液进样分析。样品采用Agilent 1290 Infinity LC 超高压液相色谱仪(Agilent,美国)及其色谱柱进行分离,整个分析过程中样品置于4℃自动进样器中样本队列中并插入QC 样品,采用Triple TOF 6600 质谱仪(SCIEX,美国)在正负离子模式下进行样本一级、二级谱图的采集[7]。
1.3 蛋白质组学研究 用SDT(4%SDS,100 mmol/L Tris-HCl,1 mmol/L DTT)缓冲液提取蛋白,并用BCA蛋白检测试剂盒(Bio-Rad,美国)进行定量。胰蛋白酶用于消化蛋白质,遵循过滤器辅助样品制备(filter-aided sample preparation,FASP)程序。消化后的肽段经脱盐、冻干、用40 μL 0.1%甲酸重新溶解后定量。蛋白质使用串联质谱(tandem mass tags,TMT)试剂(Thermo Fisher Scientific,美国)进行标记,并使用AKTA 净化器系统(GE Healthcare)通过强阳离子交换(strong cation exchange,SCX)色谱进行分离。Q Exactive 质谱仪(Thermo Fisher Scientific,美国)耦联Easy-nlc 1000(Thermo Fisher Scientific,美国)进行液相色谱串联质谱法(liquid chromatography tandem mass spectrometry,LC-MS/MS)分析[8]。
1.4 PRM 样本蛋白质提取后酶解,对鉴定到的目标蛋白的目标肽段进行PRM 定量分析,将适合PRM 分析的肽段信息Xcalibur2.2 软件中进行PRM方法设置。采用HPLC 系统(Agilent,美国)进行色谱分离,高效液相色谱分离后的样品用Q-Exactive HF质谱仪(Thermo Fisher Scientific,美国)进行PRM质谱分析[9]。
1.5 生物信息学分析 采用Cluster 3.0[10]和Java Treeview 3.0[11]进行层次聚类分析,CELLO 2.5[12-13]预测蛋白质亚细胞定位。选取差异表达蛋白的蛋白序列,使用NCBI BLAST+和InterProScan 5[14]进行局部搜索,然后用Blast2GO 6.0 软件[15]进行基因本体(GO)注释,从参与的生物过程(BP)、分子功能(MF)和细胞组分(CC)3 个方面描述基因和基因产物的属性。对基因和蛋白质在京都基因和基因组百科全书(KEGG)在线数据库上进行blast,以检索其KEGG同源性鉴定,并映射KEGG 通路。富集分析采用Fisher 精确检验,P 值采用Benjamini- Hochberg 校正,P <0.05 为差异有统计学意义。
转录组与蛋白质组关联分析,有转录组表达信息且被鉴定到的蛋白即为关联结果,寻找在两个组学中差异表达基因和蛋白均注释到的功能条目,并统计在该功能条目中蛋白、基因的数量以及蛋白和基因关联到的数量,按照差异蛋白和差异基因在各KEGG 条目中富集显著性情况分类,选择两个组学都显著富集的通路,以确定蛋白质参与的生化代谢途径和信号转导途径。转录/蛋白和代谢组学整合分析是指对来自转录组/蛋白组和代谢组等不同生物分子层次的批量数据进行归一化处理及统计学分析,建立不同层次分子间数据关系。使用R3.5.1 软件对差异基因/蛋白与代谢物进行KEGG 通路注释及富集关联分析,计算蛋白质和代谢物在各个通路的富集度的显著性水平。
2 结果
2.1 患者资料 从10 例HNSCC 患者中收集了10例肿瘤组织和10 例正常组织。
2.2 转录组学分析结果 将P<0.05,|log2foldchange|>1 作为差异显著性标准筛选差异表达基因,与癌旁正常组织相比,肿瘤组织中有3 876 个基因上调,3 067 个基因下调(图1A),选取差异表达基因进行GO 注释和富集分析(图1B),主要包括biological adhesion,extracellular matrix organization,multicellular organism development 等。对差异基因进行KEGG 富集分析,确定受到显著影响的代谢和信号转导途径(图1C),包括ECM-receptor interaction,cytokine-cytokine receptor interaction,protein digestion and absorption 等通路。
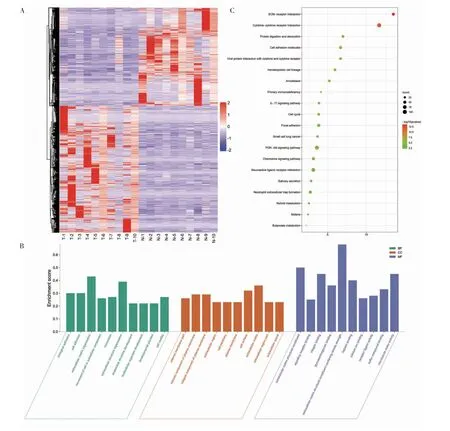
图1 头颈部鳞状细胞癌与正常组织中差异表达基因的转录组学分析Fig 1 Transcriptomics analysis of differentially expressed genes in head and neck squamous cell carcinoma tissues compared to adjacent normal tissues
2.3 代谢组学分析结果 正负离子模式下合并后实验鉴定416 种代谢物并根据其化学分类归属信息进行分类统计,其中正负离子模式分别鉴定275和212 种。以正交偏最小二乘判别分析的变量权重值(Orthogonal Partial Least Squares Discriminant Analysis Variable Importance for the Projection,OPLS-DA VIP)>1 和P<0.05 为标准,在正负离子模式下分别筛选显著性差异代谢物(图2A、2B)。合并正负离子模式筛选到的显著差异代谢物,进行KEGG 通路注释与富集分析(图2C)。富集通路主要有protein digestion and absorption,central carbon metabolism in cancer,ABC transporters,aminoacyl-tRNA biosynthesis 等。
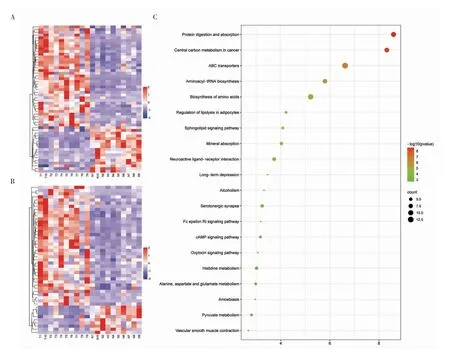
图2 头颈部鳞状细胞癌与正常组织中差异代谢物的代谢组学分析Fig 2 Metabolomics analysis of differential metabolites in head and neck squamous cell carcinoma tissues compared to adjacent normal tissues
2.4 蛋白质组学分析结果 实验测得肽段总数59 924,特异性肽段数51 333,鉴定蛋白质数10 162,可定量蛋白质数8 616。Fold Change>1.2 或<0.83 且P<0.05 为标准,得到差异蛋白质数目。与癌旁组织相比,肿瘤组织中1 553 个蛋白质上调,1 848 个蛋白质下调,总差异蛋白质数为3 401(图3A)。为了进一步探索蛋白质的功能,亚细胞定位分析表明线粒体可能是HNSCC 细胞中重要的细胞器(图3B)。对差异蛋白质进行GO 富集分析如图3C 所示,包括striated muscle cell development,muscle structure development,RNA binding,blood microparticle 等。将差异表达蛋白质进行KEGG 通路注释与富集分析(图3D),富集到的通路主要有complement and coagulation cascades,chemical carcinogenesis,cell adhesion molecules、central carbon metabolism in cancer 等。
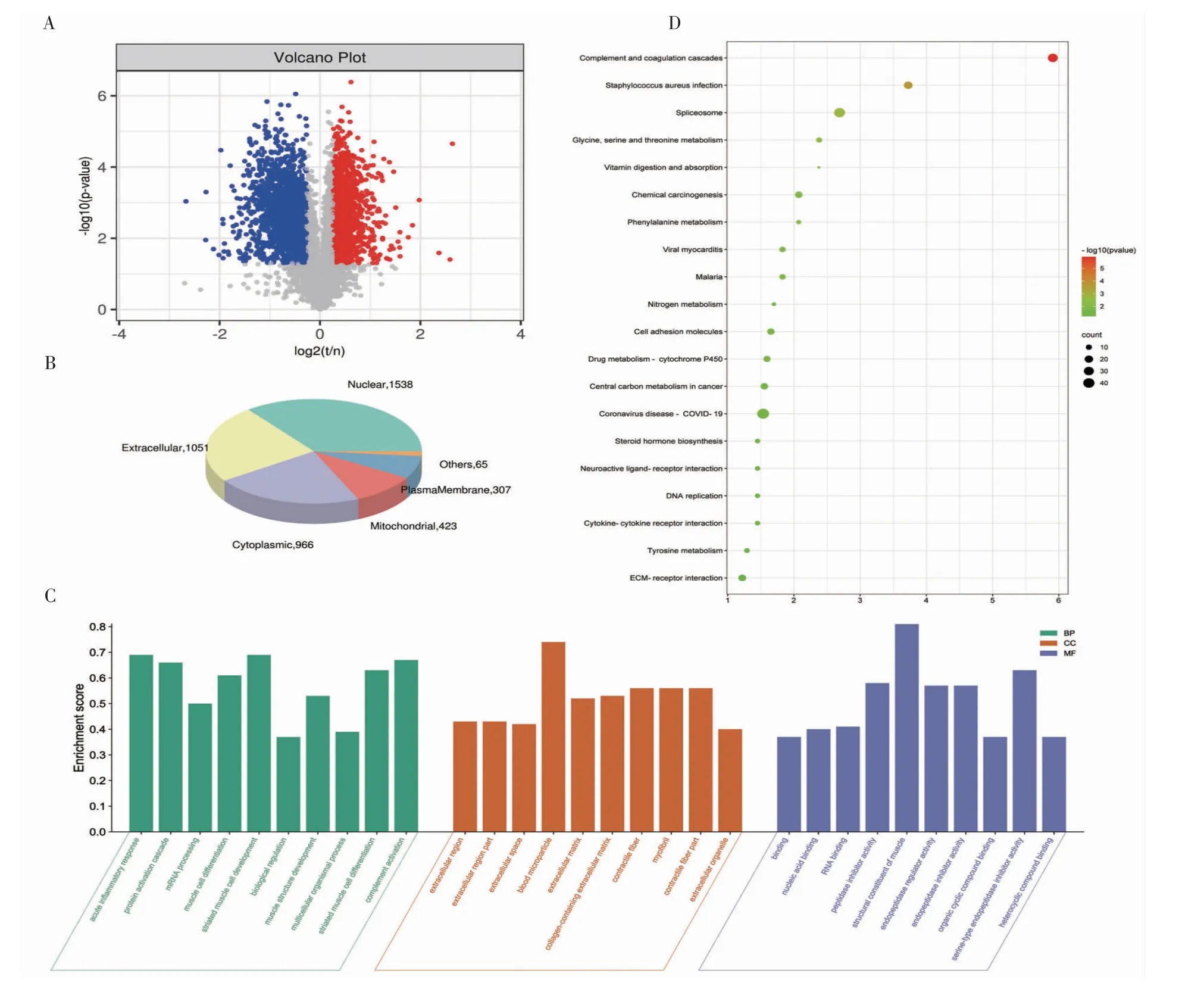
图3 头颈部鳞状细胞癌与正常组织中差异蛋白质的蛋白质组学分析Fig 3 Proteomics analysis of differential proteins in head and neck squamous cell carcinoma tissues compared to adjacent normal tissues
2.5 转录组学和代谢组学联合分析 统计鉴定到的基因和代谢物共同参与数最多的代谢通路(图4A)主要有calciumsignalingpathway,MAPKsignalingpathway,protein digestion and absorption,central carbon metabolism in cancer 等。通过对转录组学和代谢组学进行通路富集的比较分析,计算得出基因和代谢物在各个通路的富集度的显著性水平(图4B),主要包括protein digestion and absorption,neuroactive ligand receptor interaction,human papillomavirus infection 等。
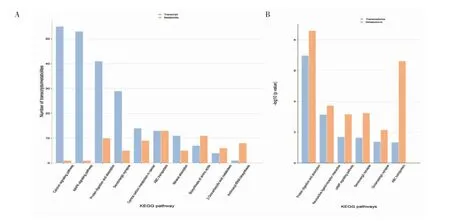
图4 转录组学和代谢组学联合分析Fig 4 Integrated analysis of transcriptomics and metabolomics
2.6 转录组学和蛋白质组学联合分析 整合相同样本来源的转录组学和蛋白质组学数据,当某一个蛋白被鉴定到且在转录组水平有表达信息时,则认为基因和蛋白被关联到。在可定量层面上得到关联到的蛋白和基因数为4 739,显著差异的层面上关联到基因及其蛋白数为182。对关联上的差异蛋白的KEGG 通路注释,确定出蛋白质参与的最主要生化代谢途径和信号转导途径(图5A),主要包括focal adhesion,IL-17 signaling pathway,protein digestion and absorption 等。寻找到在两个组学中都注释到的功能条目,以及各KEGG 条目中两个组学均显著富集的通路,如complement and coagulation cascades,chemical carcinogenesis,cell adhesion molecules 等(图5B)。
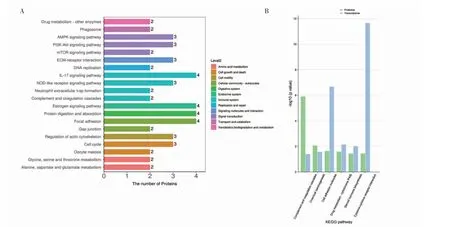
图5 转录组学和蛋白质组学的联合分析Fig 5 Integrated analysis of transcriptomics and proteomics
2.7 蛋白质组学和代谢组学联合分析 对差异蛋白和差异代谢物进行KEGG 通路注释比较,统计本次实验鉴定到的蛋白质和代谢物共同参与数最多的KEGG 通路,包括central carbon metabolism in cancer,protein digestion and absorption,glycolysis/gluconeogenesis 等(图6A)。通过对蛋白组和代谢组进行通路富集的比较分析,计算蛋白质和代谢物在各个通路的富集度的显著性水平,得到两个组学均显著富集的通路,包括neuroactive ligand-receptor interact ion 和central carbon metabolism in cancer(图6B)。
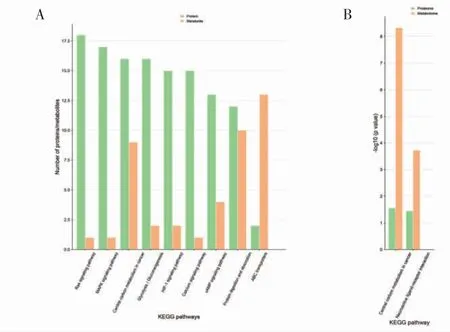
图6 蛋白质组学和代谢组学的联合分析Fig 6 Integrated analysis of proteomics and metabolomics
2.8 靶向蛋白的PRM 验证分析 根据转录组学、蛋白质组学、代谢组学和两两组学的KEGG 通路分析,优先筛选多组学同时检测到差异分子的通路,并查阅大量代谢与肿瘤相关文献,结果提示central carbon metabolism in cancer 和protein digestion and absorption 可能参与了头颈鳞癌的代谢重编程。此外,选择稳定差异表达且可测得性高的与这两条代谢通路相关的蛋白质进行PRM 验证实验。相关蛋白质包括羧肽酶B2 (CPB2)、1 型胶原蛋白链(COL1A1)、胶原蛋白Ⅵα1 链(COL6A1)、胶原蛋白VI α2 链(COL6A2)、胶原蛋白类型XⅣα1 链(COL14A1)、胶原蛋白XⅧα1 链(COL18A1)、乳酸脱氢酶B (LDHB)、磷酸甘油酸酯变位酶2(PGAM2)、丙酮酸脱氢酶E1 亚基β(PDHB)、EGFR、PGAM1、LDHA、HK3、PFKP,其中 EGFR、LDHA、PGAM1、HK3、PFKP 表达显著升高,COL6A1显著下调(表1)。
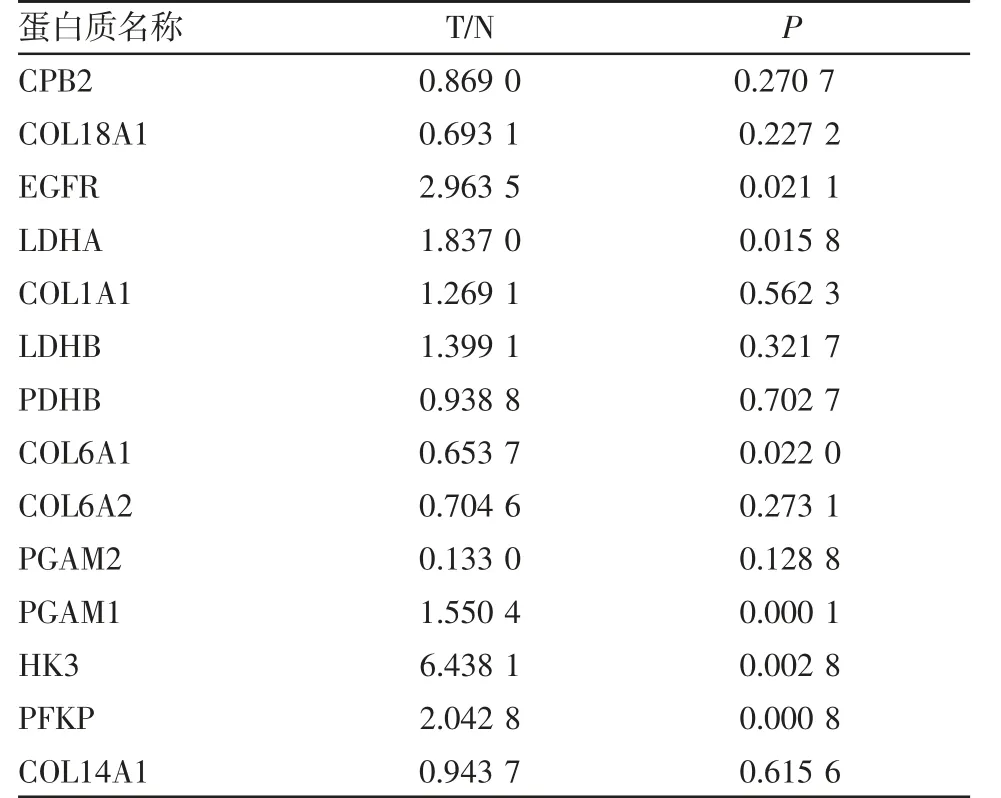
表1 靶向蛋白质的PRM 分析结果Tab 1 PRM analysis of targeted protein and peptide
3 讨论
HNSCC 早期即可出现淋巴结转移和局部浸润[16],因此常常预后不良,需要新的策略来应对。本研究首次通过转录组学、蛋白质组学、代谢组学、联合分析和PRM,系统地阐明了宏观代谢变化,证实了肿瘤中心碳代谢通路及其相关蛋白(EGFR、PGAM1、LDHA、HK3、PFKP)在HNSCC 的代谢重编程中起重要作用,有助于全面认识肿瘤的发病机制,为HNSCC 的精准、个性化治疗提供依据。
亚细胞器是细胞质内具有一定形态和功能的微器官(如线粒体、内质网等),是蛋白发挥功能的重要场所。本次研究中蛋白质组学亚细胞定位结果提示有较多差异蛋白质定位于线粒体。线粒体是细胞供能的主要细胞器,并参与细胞增殖凋亡等生物学过程[17],提示HNSCC 细胞与正常细胞相比在能量代谢上可能存在较大差异。肿瘤细胞比正常细胞摄取更多的糖,即使在氧气充足的条件下,仍会优先产生乳酸,这种现象被称为“Warburg 效应”或“有氧糖酵解”[18]。EGFR 能激活肿瘤细胞中心碳代谢,在有氧糖酵解过程中发挥重要作用。研究证实,EGFR 能直接或间接调控功能性葡萄糖转运蛋白1(GLUT1),维持糖酵解和戊糖磷酸途径[19]。EGFR 通过调节下游磷脂酰肌醇3 激酶(PI3K)/丝氨酸/苏氨酸激酶(Akt)/哺乳动物雷帕霉素靶点(mTOR)信号通路调控糖酵解,促进GLUT1 的正确定位[20],调节肿瘤细胞黏附、增殖、侵袭和迁移,与预后呈负相关[21]。已有研究表明,抑制糖酵解途径可增加靶向EGFR 治疗肿瘤的疗效,说明糖酵解可能是EGFR的主要致癌途径[22]。在本研究中,EGFR 在HNSCC组织中的表达高于癌旁组织,而EGFR 可以促进葡萄糖摄取和糖酵解,提示高表达的EGFR 可能通过糖酵解途径促进HNSCC 细胞的生长[23]。
LDHA 在有氧糖酵解过程中将丙酮酸转化为乳酸。已经证实,高活性的LDHA 与多种癌症的不良预后有关[24]。LHDA 浓度升高会导致肿瘤细胞中的pH 值降低,进而创造出有利于肿瘤侵袭的酸性微环境。LDHA 还能提供糖酵解所需NAD+、调节血管生成、产生乳酸诱导免疫逃逸,进而在很大程度上促进恶性肿瘤进展[24]。肿瘤细胞可以利用LDHA 和柠檬酸循环的中间体,合成肿瘤细胞快速增殖所需的脂类、脂肪酸和核酸[25]。本研究证实,LDHA 的表达在HNSCC 组织中明显上调,表明HNSCC 肿瘤细胞更多地利用糖酵解而不是线粒体氧化磷酸化来满足其能量需求。LDHA 可能成为新的治疗靶点,阻断LDHA 将导致细胞内ATP 严重耗竭,从而发挥抗肿瘤作用。
己糖激酶(HKs)参与糖酵解过程的第一步,即催化葡萄糖磷酸化为葡萄糖-6-磷酸。HK3 是糖酵解的第一限速酶,在许多肿瘤中过表达并能影响肿瘤患者的预后[26]。HK3 会增加细胞ATP 水平并减少活性氧簇的产生。由于高度糖酵解的肿瘤常伴有免疫刺激性肿瘤微环境,HK3 可能参与免疫浸润并可以预测免疫治疗反应[27]。目前,HK3 在HNSCC 中的报道较少。本研究发现HK3 蛋白在HNSCC 表达显著上调,提示糖酵解与恶性肿瘤之间存在密切联系,HK3 可能成为肿瘤治疗的新兴领域。
磷酸果糖激酶-1(PFK-1)是一类将果糖-6-磷酸转化为果糖-1,6,二磷酸的限速酶。在PFK-1 的3 种亚型中,血小板型(PFKP)比肝脏型(PFKL)和肌肉型(PFKM)在肿瘤中占比更多。有研究证实,PFKP 在肿瘤中过表达,可能提示预后不良[28]。PFKP活性增强,糖酵解通路激活,促进DNA 生物合成和损伤修复,从而刺激肿瘤细胞生长、迁移和侵袭[29-30]。近期研究表明,PFKP-LDHA 轴通过调节乳腺癌细胞的乳酸生成来介导有氧糖酵解[31]。抑制PFKP将使葡萄糖通量转向戊糖磷酸途径,在很大程度上挽救了代谢重编程和细胞死亡[28]。与既往研究结果一致,本研究进一步证实PFKP 在HNSCC 组织中表达上调,提示PFKP 不仅是代谢重编程和维持细胞增殖的必要条件,而且可能为HNSCC 的治疗提供潜在治疗靶点。
PGAM1 将3-磷酸甘油酸(3-PG)转变为2-磷酸甘油酸(2-PG),是糖酵解途径的关键蛋白。抑制PGMA1 会导致糖酵解活性降低,从而抑制肿瘤生长[32]。PGAM1 衰减后,其底物3-PG 升高,抑制戊糖磷酸途径通量和核苷酸合成反应;产物2-PG 降低,抑制氨基酸合成[33]。此外,mTOR-PGAM1 信号级联能促进Warburg 效应,阻断PGAM1 抑制了mTOR 依赖性糖酵解[34]。本研究发现HNSCC 患者PGAM1 高表达,提示PGAM1 参与了糖酵解相关的肿瘤的发展。这在HNSCC 的治疗中具有重要价值,并有助于识别潜在的生物标志物和药物靶点。
总之,本研究通过高通量技术结合精确的PRM,开辟了研究HNSCC 代谢重编程的创新模式。EGFR、LDHA、PGAM1、HK3、PFKP 的表达升高激活肿瘤中心碳代谢通路,触发或调节肿瘤进展。本研究为HNSCC 的进一步研究提供了有前景的肿瘤预后生物标志物和潜在的治疗靶点,有着重要的临床意义。
