右美托咪定对老年脓毒症机械通气患者炎症和预后的影响
2022-08-02于乐昌杨立恒张蔷
于乐昌,杨立恒,张蔷
(1.天津医科大学总医院保健医疗部,天津 300052;2.天津市胸科医院呼吸科,天津 300222)
脓毒症是机体对感染的反应失调而导致危及生命的器官功能障碍[1],临床病死率高达30%~70%[2],而机体免疫功能紊乱可能是导致脓毒症患者预后差的关键因素[3]。脓毒症发生率随年龄增长而升高,脓毒症病例中≥65 岁的老年人占64.9%。老年人免疫功能发生变化,罹患脓毒症的相对危险是年轻者的13.1 倍[4]。右美托咪定(Dex)是一种高选择性α2 肾上腺素能受体激动剂,能产生良好的镇静、镇痛、抗炎及中枢抗交感活性,对血流动力学和呼吸系统影响小,常用于ICU 机械通气脓毒症患者的治疗[5]。Ding 等[6]研究发现,Dex 在发挥镇静作用的同时,亦对心血管系统有保护作用。已有多项研究表明,Dex 有助于抑制脓毒症患者及动物模型过度的炎性反应,发挥脏器功能保护作用[7-10]。与劳拉西泮相比,Dex 可降低脓毒症患者28 d 病死率[11]。本研究将探讨Dex 对老年脓毒症机械通气患者炎症和预后的影响,以期为临床应用提供参考。
1 对象与方法
1.1 研究对象 回顾性分析2015 年9 月—2019年8 月天津医科大学总医院重症监护室收治的64例脓毒症患者的临床资料,其中男性43 例,女性21例,年龄69~98 岁,平均(81.88±6.04)岁,分为常规治疗+Dex 组(Dex 组,36 例)和常规治疗组(常规治疗组,28 例)。纳入标准:(1)行气管插管、机械通气。(2)年龄≥65 岁。(3)符合2016 年美国危重病医学会/欧洲危重病医学会脓毒症诊断标准[1]。排除标准:(1)重型颅脑损伤、心肺复苏术后等48 h 内死亡。(2)存在免疫系统相关性疾病,未进行系统治疗。(3)近3 月内使用激素或免疫抑制剂。(4)恶性肿瘤或血液病。(5)患者自动出院。
1.2 方法
1.2.1 常规治疗 按照2016 年国际脓毒症与感染性休克治疗指南指导意见,给予经验性合理抗生素、常规经鼻置入胃肠营养管、适当液体复苏、感染病灶外科引流、血管活性药物,必要时行床旁血液净化等治疗措施[12]。
1.2.2 呼吸机使用及镇静治疗 通气模式采用双水平气道正压通气(DuoPAP)或同步间歇指令通气(SIMV)+压力支持通气(PSV)。根据血气分析结果及病情变化调节呼吸机各项参数,维持PaCO2在35~50 mmHg(1 mmHg=0.133 kPa),SpO290%以上。应用Dex 定义为患者行气管插管、机械通气后初始给予Dex 0.5 μg/kg 静脉缓慢推注超过10 min,然后0.2~0.6 μg/(kg·h)静脉泵维持,根据病情需要决定泵注剂量和时间。调节输注速度以维持患者Richmond躁动镇静评分在-2~+1 分之间[13]。血流动力学不稳定患者采用去甲肾上腺素或多巴胺静脉泵注结合扩容治疗以维持平均动脉压(MAP)≥65 mmHg。
1.2.3 一般资料收集 收集两组基础临床资料,包括年龄、性别、入住ICU 时急性生理学及慢性健康状况评分系统评分(APACHEⅡ评分)和序贯器官衰竭评分(SOFA 评分)、机械通气时间、入住ICU 时间、基础病、感染部位;治疗前和治疗后第3、7 天外周血T 细胞亚群比例(CD4+T、CD8+T、CD4+T/CD8+T)及各自凋亡率(CD4+T、CD8+T);细胞因子[白细胞介素(IL)-6、IL-10、肿瘤坏死因子(TNF)-α]水平;计算入住ICU 期间多器官功能障碍综合征(MODS)发生率和病死率,并对两组入住ICU 期间28 d 存活状况进行生存分析。
1.3 统计学处理 采用SPSS 22.0 统计学软件进行统计学分析。不满足正态分布的计量资料采用非参数检验,用中位数及四分位数间距表示。正态分布的计量资料以±s 表示,两组间资料比较采用两独立样本t 检验,多组间比较采用单因素方差分析(方差齐性)。计数资料以n 表示,如果所有的理论数≥5 且总样本量≥40,用Pearson 卡方进行检验;如果理论数<5 但≥1,且总样本量≥40,用连续性校正的卡方进行检验;如果理论数<1 或总样本量<40,则用Fisher 检验。对于生存分析,使用Kaplan-Meier 法,并使用对数秩检验来检测两组之间的差异。P<0.05为差异有统计学意义。
2 结果
2.1 临床资料比较 两组性别、年龄、入住ICU 时APACHEⅡ评分和SOFA 评分、机械通气时间、入住ICU 时间、基础病、感染部位差异均无统计学意义(均P>0.05),见表1。
表1 两组临床资料比较[±s,n(%)]Tab 1 Comparison of clinical data between the two groups[±s,n(%)]
注:APACHEⅡ评分:急性生理学与慢性健康状况评分;SOFA 评分:序贯器官衰竭评分
常规治疗组(n=28)年龄(岁)81.28±6.5182.64±7.66男性/女性24/1219/9 APACHEⅡ评分(分) 18.72±3.1819.21±3.48 SOFA 评分(分)12.25±3.2713.50±3.78机械通气时间(d) 16.5(13.3,22.0)13.5(10.0,18.0)入住ICU 时间(d) 19.5(15.0,26.5)15.5(11.3,21.8)基础病高血压25(69.44)21(75.00)糖尿病11(30.56)8(28.57)慢性肾脏病5(13.89)3(10.71)慢性心功能不全7(19.44)5(17.86)脑血管病9(25.00)8(28.57)慢性肺疾病12(33.33)9(32.14)感染部位肺部22(61.11)16(57.14)腹腔6(16.67)4(14.29)尿路4(11.11)3(10.71)皮肤软组织4(11.11)5(17.86)临床特征Dex 组(n=36)t/z/χ2 0.770 0.012 0.590 1.417-1.730-1.750 P 0.444 0.915 0.558 0.161 1.084 1.081 0.241 0.030 0.000 0.026 0.103 0.010 0.624 0.863 1.000 0.872 0.748 0.920 0.103 0.068 0.000 0.166 0.749 0.795 1.000 0.684
2.2 外周血T 细胞亚群比例及各自凋亡率比较 两组治疗前、治疗后第3 天CD4+T 细胞比例、CD4+/CD8+、CD4+T 细胞凋亡率差异均无统计学意义(均P>0.05);第7 天CD4+T 细胞比例、CD4+/CD8+较治疗前升高,且Dex 组高于常规治疗组,而CD4+T 细胞凋亡率较治疗前降低,且Dex 组低于常规治疗组,(t=2.670、1.960、-1.984;均P<0.05)。两组CD8+T 细胞比例及其凋亡率组内、组间差异均无统计学意义(均P>0.05),见表2。
表2 两组外周血T 细胞亚群比例及各自凋亡率比较(±s)Tab 2 Comparison of the proportion of peripheral blood T cell subsets and their respective apoptosis rates between the two groups(±s)
注:与本组治疗前比较,aP<0.05;与常规治疗组对应时间点比较,bP<0.05
?组别例数时间CD4+T 细胞(%) CD8+T 细胞(%) CD4+/CD8+CD4+T 细胞凋亡率(%) CD8+T 细胞凋亡率(%)Dex 组36治疗前32.31±4.6126.74±4.731.19±0.2718.31±5.2920.81±4.99 36治疗后3 d31.79±4.2225.93±4.011.21±0.2718.69±5.6619.95±5.23 35治疗后7 d38.31±3.19ab25.48±4.551.63±0.39ab12.07±3.92ab18.62±3.76常规治疗组28治疗前33.15±4.4827.25±5.051.26±0.3917.93±5.4919.36±5.31 28治疗后3 d32.60±4.4926.57±4.191.23±0.3420.22±6.2320.84±5.73 27治疗后7 d35.72±4.45a25.83±3.581.45±0.33a14.31±4.97a19.50±3.96
2.3 外周血细胞因子水平比较 两组治疗前、治疗后第3 天TNF-α、IL-6 水平差异均无统计学意义(均P>0.05);总体呈下降趋势,第7 天TNF-α、IL-6水平较治疗前降低明显,且Dex 组低于常规治疗组(t=-2.159、-2.382;均P<0.05)。两组IL-10 水平组内、组间差异均无统计学意义(均P>0.05),见表3。2.4 入住ICU 期间MODS 发生率、病死率及28 d存活率比较 两组入住ICU 期间MODS 发生率、病死率差异均无统计学意义(均P>0.05),见表4。Dex组入住ICU 28 d 存活率高于常规治疗组(Log-rank=4.099,P<0.05),见图1。
表3 两组外周血细胞因子水平比较(±s)Tab 3 Comparison of peripheral blood cytokine levels between the two groups(±s)
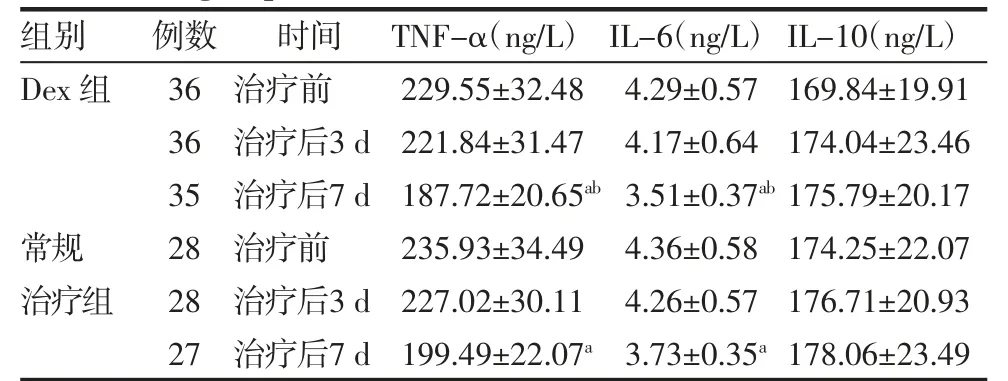
表3 两组外周血细胞因子水平比较(±s)Tab 3 Comparison of peripheral blood cytokine levels between the two groups(±s)
注:TNF-α:肿瘤坏死因子-α;IL-6:白细胞介素-6;IL-10:白细胞介素-10;与本组治疗前比较,aP<0.05;与常规治疗组对应时间点比较,bP<0.05
组别例数时间 TNF-α(ng/L) IL-6(ng/L) IL-10(ng/L)Dex 组36 治疗前229.55±32.48 4.29±0.57 169.84±19.91 36 治疗后3 d 221.84±31.47 4.17±0.64 174.04±23.46 35 治疗后7 d 187.72±20.65ab 3.51±0.37ab 175.79±20.17常规28 治疗前235.93±34.49 4.36±0.58 174.25±22.07治疗组28 治疗后3 d 227.02±30.11 4.26±0.57 176.71±20.93 27 治疗后7 d 199.49±22.07a 3.73±0.35a 178.06±23.49
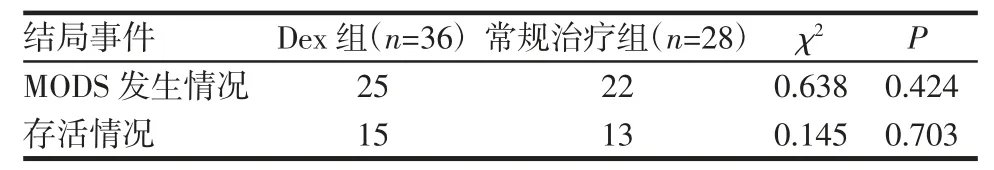
表4 两组入住ICU 期间MODS 发生率、病死率比较(n)Tab 4 Comparison of the incidence of MODS and mortality during the ICU stay between the two groups(n)
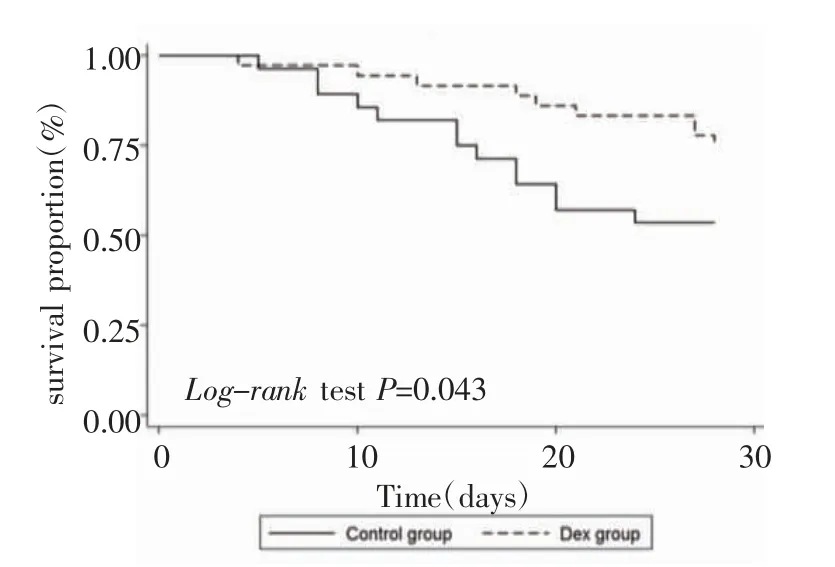
图1 两组患者入住ICU 28 d 生存率比较Fig 1 Comparison of the 28-day survival rate during the ICU stay between the two groups
3 讨论
脓毒症是宿主对感染的特异性反应导致的威胁生命的器官功能障碍。老年患者机体会出现不同程度的退行性改变,患病后容易出现呼吸功能障碍,往往需要机械通气治疗,镇静、镇痛药物的使用能够有效缓解机械通气患者出现的焦虑、紧张、恐惧、烦躁不安,减轻人机对抗,降低氧耗,减少非计划拔管等并发症的发生。理想的镇静药应具有起效快、半衰期短、无蓄积、没有循环和呼吸抑制等特点。2013 年更新的最新指南[14]建议对ICU 机械通气患者使用Dex 或丙泊酚镇静,以改善预后。研究发现,适度、持续、有效的镇静及镇痛可在某种程度上抑制脓毒症患者出现不可控的瀑布式炎症,降低基础代谢率,减轻炎症失控导致的“二次打击”,提高脓毒症患者的治愈率[15]。Dex 不仅具有良好的镇静效果,还能通过减少去甲肾上腺素的释放,抑制交感神经活性,从而激活胆碱能抗炎通路,减轻全身炎症及组织损伤[16]。研究已证实,刺激迷走神经所引起的胆碱能通路激活具有明显的抗炎效应,对脓毒症动物模型具有保护作用[17]。
脓毒症免疫抑制是近年研究的热点和焦点,其机制包括淋巴细胞反应性低下、凋亡增加、树突状细胞抗原递呈缺陷、迟发型免疫反应缺失以及吞噬细胞对微生物清除能力减弱等[18-19]。淋巴细胞表达抑制或凋亡增加是脓毒症免疫抑制的重要特征,其可发生在脓毒症早期,并与脓毒症不良预后直接相关[20]。相关研究证实,应用Dex 能抑制盲肠结扎穿孔法(cecal ligation and puncture,CLP)所致的脓毒症大鼠模型凋亡标志物caspase 3 在脾脏中的表达[21],逆转脂多糖诱导的脓毒症小鼠模型神经退行性变化和神经元凋亡[22],并通过阻抑肾脏细胞凋亡预防脂多糖诱导的脓毒症相关急性肾损伤[23]。本研究发现,与常规治疗组相比,Dex 组治疗后第7 天CD4+T细胞比例和CD4+/CD8+升高,CD4+T 细胞凋亡率下降,提示Dex 可能通过调节T 淋巴细胞亚群比例实现免疫调节作用。目前Dex 对脓毒症患者T 淋巴细胞的调节作用机制还不清楚,究竟是直接作用于淋巴细胞,还是通过降低全身炎症间接作用于胸腺和脾脏的淋巴系统仍需进一步研究。
在脓毒症病理生理过程中,炎症因子是关键物质,它们使得脓毒症进展中贯穿着促炎与抗炎,代偿与失衡,多重冲击与单次冲击等多种机制[24]。目前已经证实的参与脓毒症的炎症介质主要有TNF-α、IL-1β 和IL-6,抗炎症介质主要有IL-4、IL-10 和IL-13 等[25]。Hofer 等[26]研究显示,应用Dex 可下调CLP 所致的脓毒症小鼠模型TNF-α、IL-1β 和IL-6表达水平,提高脓毒症小鼠存活率。Zabrodskii 等[27]研究还发现,Dex 在腹腔注射大肠杆菌诱导的败血症小鼠模型中TNF-α、IL-1β 和IL-6 水平的表达和死亡率降低。本研究显示,与常规治疗组相比,Dex组治疗后第7 天TNF-α、IL-6 水平下降,提示Dex可能降低脓毒症机械通气患者炎症免疫反应,与先前研究相一致[28]。IL-10 水平无明显差异,考虑可能与样本量不足或者Dex 本身对抗炎症因子无明显影响相关。Dex 除了激活胆碱能抗炎通路外,可能通过以下途径实现调控:⑴抑制Toll 样受体4(TLR-4)/核因子-κB (NF-κB)/丝裂原活化蛋白激酶(MAPKs)炎症通路[29]。(2)降低CD4+T 细胞凋亡率,提高CD4+T 细胞比例及CD4+/CD8+,改善免疫抑制状态。(3)调节Th1/Th2 平衡。
有研究表明,Dex 不能缩短脓毒症患者的机械通气时间和ICU 住院时间[30-31]。本研究中,两组机械通气时间和ICU 住院时间没有显著差异,与先前的研究相一致。与未使用Dex 的患著相比,Dex 组患者28 d 死亡率下降[32]。Zhang 等[30]研究亦发现,Dex 可以减少脓毒症患者的短期死亡率。本研究显示,与常规治疗组相比,Dex 组在ICU 住院期间的28 d 生存率更高,与相关研究结果一致。然而两组入住ICU期间MODS 发生率、病死率差异并无统计学意义。究其原因,可能是Dex 只能提高脓毒症机械通气患者的短期存活率,而对长期死亡率没有影响。
综上所述,Dex 可能调节老年脓毒症机械通气患者T 淋巴细胞亚群比例,降低炎症指标水平,提高入住ICU 期间28 d 生存率,从而改善预后。然而本研究存在如下局限性:(1)仅对单一机构进行回顾性研究,导致分析中存在一些潜在偏差。(2)样本数量太少,存在抽样误差的风险。(3)仅提取和分析ICU 住院期间的临床数据,缺乏对远期结局的观察和分析。本研究只是对Dex 调节作用机制的初步探讨,尚需设计更全面、更严谨、更深入的实验进行相关研究。
