肺腺癌细胞中PRDM5 抑癌作用的分子机制初探
2022-08-02马梦楚任媛媛刘欣
马梦楚,任媛媛,刘欣
(天津医科大学基础医学院生物化学与分子生物学系,天津 300070)
PR 结构域锌指蛋白(PRDM)5 是PRDM 家族成员之一[1]。该蛋白由N 端保守的PR 结构域和C 端的16 个锌指蛋白结构域组成,其中PR 结构域与SET结构域高度同源,该结构域通常具有特异性DNA序列识别和结合活性[2]。目前认为PRDM5 蛋白是一个广泛表达的转录因子,不仅参与正常生长发育过程[3],而且在胃癌[4-5]、结肠腺癌[6]和神经胶质细胞瘤[7]的发生、发展中发挥作用。本课题组前期数据表明,在肺腺癌中PRDM5 低表达通常与低生存率和不良预后相关。并且一系列实验结果显示,PRDM5 在肺腺癌中发挥抑癌因子的功能[8]。因此本课题组计划探究PRDM5 发挥功能的具体分子机制。
NuRD 复合物全称为核小体重塑与去乙酰化酶复合物,也称为Mi-2 复合物,其主要通过参与组蛋白修饰和染色质重塑来调控许多下游基因的转录过程[9]。NuRD 复合物由多种蛋白组成,主要组分包括:组蛋白去乙酰化酶(HDAC)1/2、ATP 依赖性染色质重塑酶CHD3/4、组蛋白伴侣RbAp46/48、CpG结合蛋白MBD2/3、GATAD2a(p66α)和GATAD2b(p66β)以及转移相关蛋白MTA1/2/3[10]。前期本组的质谱数据显示,过表达PRDM5 的A549 细胞中NuRD复合物的组分与PRDM5 结合的评分相对较高,提示PRDM5 发挥抑癌功能可能与NuRD 复合物相关[11]。为了寻找和验证肺腺癌细胞中与PRDM5 相互作用的蛋白因子,本研究采用Co-IP 和GST-pull down 实验分别检测了NuRD 复合物中的蛋白组分与PRDM5 是否结合,为深入探讨PRDM5 在肺腺癌中发挥作用的分子机制提供了坚实基础。
1 材料与方法
1.1 材料
1.1.1 质粒与菌株细胞及培养条件 肺腺癌细胞株A549 与H1299 细胞株来自本系马振毅老师实验室馈赠;细胞培养所需RPMI 1640 培养基、特级胎牛血清和胰酶均购买自BI 公司。融合蛋白表达载体pGEX-4T-1、pET-28a(+)均来自本实验室,E.coli Trans-T1 以及BL21 均购于北京全式金生物技术有限公司;细菌所需培基有LB 液体培养基,LB 固体培养基,2×YT 液体培养基(Tryptone 16 g,Yeast 10 g,NaCl 5 g 超纯水定容至1 L),上述培基均高压灭菌后4℃保存。
1.1.2 主要化学试剂和仪器 ProteinA+G Beads 购于Merck Millipore 公司;PrimeSTAR® Max DNA Polymerase 购于Takara 公司;Pierce® Glutathione Agarose、限制性核酸内切酶EcoRⅠ与XhoⅠ等均购于Thermo Fisher Scientific 公司;T4 DNA 连接酶购于全式金公司;去内毒素质粒小提试剂盒购买自康为世纪;IPTG 购于北京鼎国有限公司;HIS-Select®镍亲和凝胶购于Sigma;PRDM5、MTA1、MTA2 和MBD2/3 抗体均购于Santa Cruz 公司;CHD3、CHD4和RbAp46/48 抗体均购于Abcam 公司;HDAC1 与HDAC2 抗体均购于Sigma 公司;辣根过氧化物酶标记的抗鼠源IgG 二抗以及抗兔源IgG 二抗购买自KPL 公司,超敏ECL 化学发光试剂购买自碧云天公司。实验仪器主要包括SDS-PAGE 垂直电泳相关设备,琼脂糖核酸电泳仪和湿转膜仪等。
1.1.3 纯化His 标签蛋白所用试剂 洗脱缓冲液(不含咪唑):Na3PO4(50 mmol/L,pH=8.0),NaCl(0.3 mmol/L);洗脱缓冲液(含咪唑):Na3PO4(50 mmol/L,pH=8.0),NaCl(0.3 mmol/L),咪唑(250 mmmol/L)。
1.2 方法
1.2.1 Co-IP 实验 PRDM5 抗体与protein A+G Beads,4℃孵育8 h,将结合有抗体的Beads 加入细胞蛋白裂解液共孵育过夜以钓取目的蛋白,将目的蛋白与Beads 分离,通过Western 印迹实验验证免疫共沉淀结果。
1.2.2 目的基因获取 以人源细胞基因组cDNA和pLVX-IRES-PRDM5 质粒分别作为扩增HDAC1、MTA1、MTA2 和PRDM5 的模板。根据NCBI 上查询到的每个基因CDS 区序列信息,设计含有EcoRⅠ与XhoⅠ限制性内切酶位点的引物序列(表1)。用DNA 聚合酶PrimeSTAR PCR 扩增各目的基因,PCR条件为98℃预变性5 min,98℃变性5 s,58℃退火15 s,72℃延伸3 min 共40 个循环,72℃延伸10 min。PCR 产物经1%琼脂糖凝胶电泳鉴定为单一清晰条带,将条带切下后按照DNA 胶回收纯化试剂盒说明书进行目的片段回收。

表1 融合蛋白引物序列Tab 1 The primer sequence of fusion protein
1.2.3 线性化载体以及目的片段的双酶切 采用EcoRⅠ与XhoⅠ双酶切载体pGEX-4T-1、pET-28a(+)和目的片段,琼脂糖凝胶电泳验证并回收。
1.2.4 重组质粒连接 将线性化载体与双酶切后得到的目的基因片段按照T4 DNA 连接酶说明书进行连接。连接产物转化感受态细胞Trans-T1,在含有相应抗生素的LB 平板上筛选克隆,过夜培养12 h左右,挑取细菌克隆进行菌体扩增。
1.2.5 重组质粒鉴定 取扩增后的菌液进行PCR,并以1%琼脂糖凝胶电泳验证阳性克隆,提取质粒经EcoRⅠ与XhoⅠ双酶切进一步验证。将初步确认的阳性克隆进行测序,测序结果比对序列无误即构建成功。
1.2.6 GST 融合蛋白的表达与纯化 将成功转入重组质粒pGEX-4T-1、pGEX-4T-1-HDAC1、pGEX-4T-1-MTA1 以及pGEX-4T-1-MTA2 的E.coli BL21 接种于2×YT 培养基中,37℃培养,当OD 值达到0.6~0.8 加入一定浓度IPTG 诱导蛋白表达。提取细菌蛋白裂解液加入一定量GST-Beads,4℃孵育过夜。冰PBST 洗涤GST-Beads 5 次,加入2.5×上样缓冲液混匀后99℃加热10 min。离心后取上清进行聚丙烯酰胺凝胶电泳和考马斯亮蓝染色。
1.2.7 His 融合蛋白纯化 将转入pET-28a(+)-PRDM5 重组质粒的E. coli BL21 接种至2×YT 培养基中扩增菌体,提取细菌蛋白裂解液。加入用洗脱缓冲液(不含咪唑)洗涤后的His-Beads 进行蛋白富集,弃去蛋白裂解液后用洗脱缓冲液(不含咪唑)洗涤富集有His-PRDM5 蛋白的Beads 3 次,最后加入洗脱缓冲液(含咪唑)洗脱His-Beads 上富集的His-PRDM5 蛋白。
1.2.8 GST-pull down 检测与PRDM5 直接结合的蛋白 将GST、GST-HDAC1、GST-MTA1 和GSTMTA2 成功诱导表达,富集有GST、GST-HDAC1、GST-MTA1 和GST-MTA2 蛋白的Beads 分别与纯化的His-PRDM5 蛋白4℃共同孵育12 h。PBST 洗涤Beads 重复5 次,加入2.5×上样缓冲液混匀置于99℃,加热10 min,离心取上清为待测样品,Western印迹检测蛋白直接结合情况。
2 结果
2.1 PRDM5 与NuRD 复合物存在内源性结合 Co-IP实验证实在肺腺癌细胞系A549 与H1299 细胞中,PRDM5 蛋白与NuRD 复合物中主要组分CHD3、CHD4、MTA1、MTA2、HDAC1、HDAC2、RbAp46/48和MBD2/3 之间存在内源性结合(图1)。
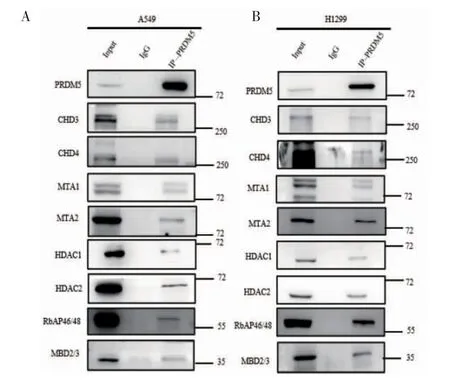
图1 Co-IP 实验证实PRDM5 与NuRD 复合物内源性结合Fig 1 The endogenous binding of PRDM5 with NuRD complex verified by Co-IP experiment
2.2 预测与PRDM5 直接结合的蛋白 依据STRING 网站预测结果(图2)PRDM5 与NuRD 复合物中HDAC1 存在直接结合。同时已有文献报道NuRD 复合物与其他蛋白结合时多与MTA 家族蛋白关联,因此从NuRD 复合物众多组分中优先选择HDAC1、MTA1 和MTA2 作为可能与PRDM5 直接结合的蛋白进行验证。
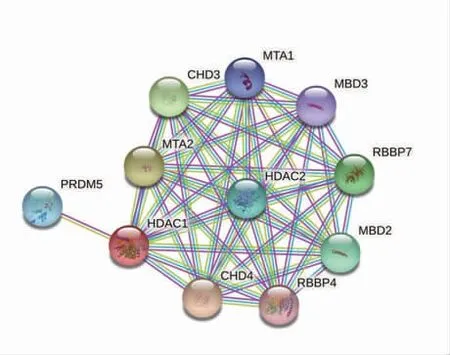
图2 PRDM5 直接结合蛋白的预测分析Fig 2 Prediction of PRDM5 direct-binding proteins
2.3 目的基因获取 PCR 扩增获得PRDM5、HDAC1、MTA1 与MTA2 基因。PRDM5、HDAC1、MTA1和MTA2 目的基因片段大小分别为1 893、1 449、2 148、2 007 bp。扩增产物经1%琼脂糖凝胶电泳,结果显示(图3),4 个目的基因均为清晰单一条带且分子量大小正确,然后回收目的条带凝胶。
图3 目的基因PRDM5、HDAC1、MTA1、MTA2 的获取Fig 3 Acquisition of target genes PRDM5,HDAC1,MTA1,MTA2
2.4 重组质粒构建成功
2.4.1 菌液PCR 证实阳性克隆 取菌液进行PCR,扩增产物经琼脂糖凝胶电泳验证。结果显示,pET-28a(+)-PRDM5、pGEX-4T-1-HDAC1、pGEX-4T-1-MTA1 以及pGEX-4T-1-MTA2 4 个重组质粒挑取的菌落均可扩增出目的基因条带,均为阳性克隆(图4)。
图4 重组质粒菌液PCR 鉴定阳性克隆Fig 4 Identification of recombinant plasmid by PCR
2.4.2 重组质粒双酶切及测序鉴定 重组质粒经双酶切后采用琼脂糖凝胶电泳进行验证(图5)。所有重组质粒、目的基因以及载体大小均正确。测序结果(图6)与目的基因序列一致,无缺失、插入或移码突变,表明重组质粒均已构建成功。
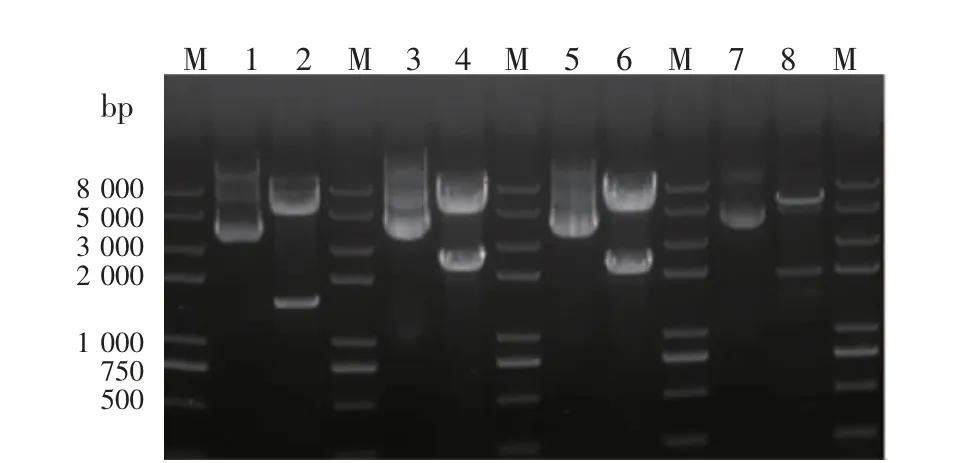
图5 重组质粒双酶切验证Fig 5 Verification of recombinant plasmid by double-enzyme digestion

图6 重组质粒测序结果Fig 6 Sequencing of recombinant plasmids
2.5 体外实验证实PRDM5 分别与HDAC1、MTA1、MTA2 直接结合 将上述各个成功诱导的GST 融合蛋白表达量调齐后(图7),通过GST-pull down 与Western 印迹实验联合检测蛋白间的结合情况。结果显示,His-PRDM5 蛋白与GST 标签不结合,而NuRD 复合物组分中的HDAC1、MTA1 和MTA2 蛋白分别与PRDM5 存在直接结合(图8)。
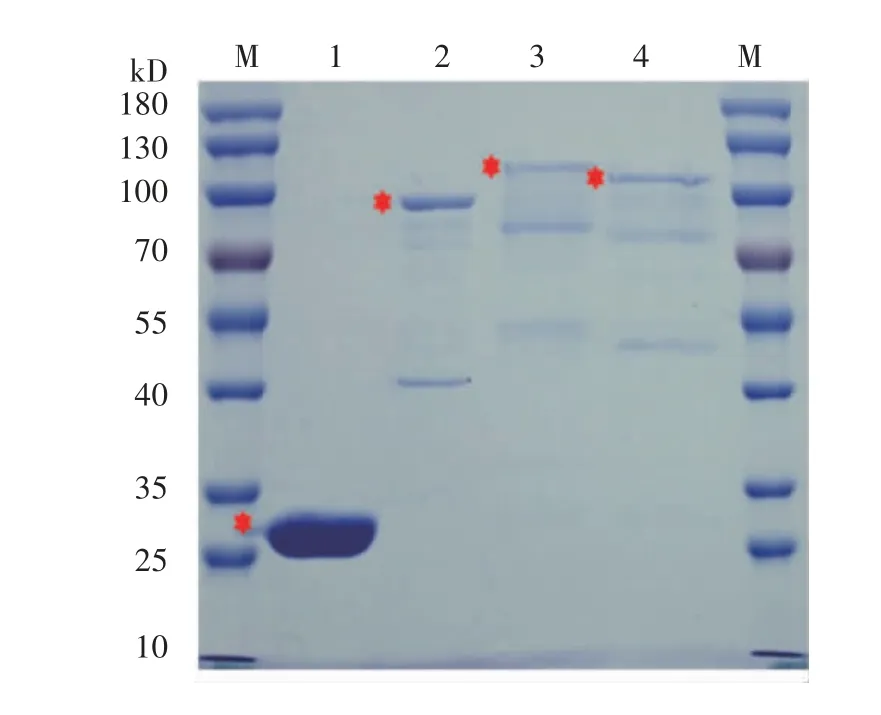
图7 GST 融合蛋白表达Fig 7 Expression of GST fusion protein
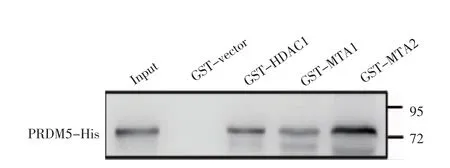
图8 GST-pull down 检测与PRDM5 直接结合的NuRD 复合物组分Fig 8 NuRD complex components directly bound to PRDM5 detected by GST-pull down
3 讨论
PRDM5 属于PRDM 蛋白家族成员[12],该家族成员通过其内在HMTase 活性或通过与其他染色质修饰酶的相互作用,参与基因表达的表观遗传调控,在细胞分化和恶性转化中发挥重要作用[1]。人类PRDM 家族均有进化上保守的N 端PR 结构域,此外C 端有数量不等的C2-H2 锌指重复序列,这些序列大多参与DNA-蛋白质和蛋白质-蛋白质的相互作用[12]。PRDM5 首次被发现是根据其与PRDM2在结构上具有相似性,因而从EST 数据库被识别[13]。已有文献报道在斑马鱼中,PRDM5 通过Wnt 信号通路在胚胎收敛性伸展运动中起重要作用[14]。在小鼠胚胎干细胞中,PRDM5 直接作用于参与早期胚胎发育的基因组区域,并可能在细胞分化过程中影响发育调节因子的表达[15]。病理状态下PRDM5 的突变可直接导致人类脆性角膜综合征[16-18]。
更为重要的是,PRDM5 在多种肿瘤的发生、发展中发挥重要功能。近期研究发现PRDM5 的下调与多种肿瘤的不良预后相关,抑制PRDM5 的表达可促进肿瘤细胞的增殖和迁移能力,提示PRDM5可能作为抑癌因子在肿瘤癌变中发挥作用。虽然已有文献报道在胃癌[4-5]、结直肠癌[6]、神经胶质细胞瘤[7]、肺腺癌[19]等肿瘤中PRDM5 由于启动子CpG 岛发生甲基化而被沉默,但是PRDM5 在肺腺癌中发挥抑癌作用的机制尚不清楚。前期本组在A549 细胞中过表达PRDM5 后进行质谱实验。通过分析发现PRDM5 与NuRD 复合物的大多数组分能够结合。为了探究二者之间的直接结合情况,本研究在肺腺癌细胞系A549 和H1299 中通过Co-IP 实验证实了二者的内源性结合。依据体外原核表达系统,笔者构建了pET-28a(+)-PRDM5、pGEX-4T-1-HDAC1、pGEX-4T-1-MTA1 以及pGEX-4T-1-MTA2 重组质粒并成功诱导融合蛋白表达。通过GST-pull down 实验证实PRDM5 与NuRD 复合物中HDAC1、MTA1、MTA2 3 个组分存在外源性结合,为进一步明确PRDM5 与NuRD 复合物相互作用的潜在机制打下坚实基础。
NuRD 复合物在染色质水平上调控基因表达,其参与了对肿瘤发生和进展必不可少的转录事件的调控[20]。研究表明,NuRD 复合物与不同致癌或抑癌转录因子结合,增强下游靶基因的转录抑制,在不同的肿瘤中发挥不同作用[21-22]。例如,在乳腺癌细胞中TWIST 这一转录因子可以通过MTA2 募集NuRD 复合物到目标基因CDH1 的启动子上,以介导转录抑制并促进上皮-间充质转化进程[21]。同样在乳腺癌中组蛋白脱甲基酶LSD1 可以通过MTA 亚基与NuRD 复合物结合后,抑制转化生长因子β、丝裂原活化蛋白激酶等途径的基因转录,继而干扰细胞增殖、侵袭和上皮细胞-间充质转化进程[23-24]。由此可见,NuRD 复合物与其他蛋白分子相互作用可能是通过MTA 家族蛋白。结合本文的实验结果,推测PRDM5 可能通过与NuRD 复合物中的HDAC1、MTA1 和MTA2 结合,从而影响受NuRD复合物调控的某些途径和(或)下游靶基因的转录活性,进而影响肺腺癌的发生和发展进程。此外,PRDM5 与上述不同蛋白结合的具体结构域也有待进一步明确。
综上,研究PRDM5 与不同蛋白(或结构域)之间的相互作用,有利于深入探讨PRDM5 在不同环境下发挥抑癌作用的分子机制。
