不同冻干保护剂在外泌体储存中的研究
2022-08-02吴颖杰耿梦缘汪晶尹海芳
吴颖杰,耿梦缘,汪晶,尹海芳
(天津医科大学基础医学院&医学技术学院,天津 300070)
外泌体因具有生物相容度高、免疫原性低/无、特定组织趋向性、可修饰性以及高稳定性等优势[1-2]被作为天然的纳米载体,广泛应用于药物运输[3-4]和疾病诊断治疗[5-7]等研究。
然而,外泌体的运输和长期储存是限制其临床应用的重要因素。目前外泌体主要以-80℃储存为主[8],但是该方法的运输成本较高,临床适用性差,因此,亟需开发一种更为有效的外泌体储存方法。冻干技术具有保持物质活性,防止其被氧化和加水易复原等优势,广泛用于保存蛋白质[9]、血清[10]和细胞[11]等生物物质,并且可用于改善纳米载体例如脂质体等的稳定性[12]。然而,冻干过程的极端环境会对外泌体造成破坏,因此,需要添加冻干保护剂进行保护。鉴于此,本研究尝试了包括赖氨酸、海藻糖、乳糖和菊糖在内的冻干保护剂对外泌体完整性、分散性和生物学功能的影响。
1 材料与方法
1.1 主要试剂及仪器 293T 细胞(购自ATCC 生物库)、C2C12 细胞(天津医科大学康复医学系傅力教授课题组赠送)、人脐静脉内皮细胞(HUVECs,第4 代,天津医科大学分子眼科实验室赠送)、DMEM高糖培养基(中国,allBio 公司)、青霉素/链霉素双抗(美国,Gibco 公司)、胎牛血清(美国,AusGeneX)、2.5%戊二醛(中国,索莱宝)、甲基纤维素(美国,Sigma 公司)、多聚甲醛(美国,Sigma 公司)、兔源CD63多克隆抗体(美国,Santa Cruz 公司)、鼠源CD81 多克隆抗体(美国,Santa Cruz 公司)、HRP标记羊抗兔抗体(中国,联科生物)、HRP 标记的羊抗鼠抗体(中国,联科生物)、海藻糖(美国,Sigma 公司)、乳糖(美国,Sigma 公司)、赖氨酸(美国,Sigma 公司)、菊糖5000(中国,上海恒远生物科技有限公司)、0.22 μm 滤器(美国,Millipore 公司)、细胞培养皿(美国,Thermo 公司)、基质胶(中国,索莱宝)、Nanodrop2000c 核酸蛋白微量检测仪(美国,Thermo 公司)、高速离心机(德国,Eppendorff 公司)、Avanti J-26XP 超速离心机(德国,Beckman 公司)、HT7700 透射电子显微镜(日本,日立高新技术公司)、DK-8D 恒温水浴锅(中国,上海精宏实验设备有限公司)、细胞培养箱(美国,Thermo 公司)、超净工作台(中国,AIRTECH 公司)、Alpha 1-4 真空冷冻干燥机及Christ 冻干机(德国,Christ 公司)、Olympus FV1000激光共聚焦显微镜(日本,奥林巴斯公司)、NS300 纳米粒径分析仪(英国,Malvern 公司)、IX71 倒置荧光显微镜(日本,奥林巴斯公司)。
1.2 方法
1.2.1 293T 细胞培养及超速离心法提取细胞上清中外泌体 293T 细胞(2.5×106)加入10 mL 无外泌体的DMEM 培养基(含1%双抗,10%FBS),于5%CO2、37℃下培养48 h。收取上清并分别以2 000 r/min的转速离心20 min 后弃沉淀,再以10 000 r/min 的转速离心30 min 后弃沉淀。离心后的上清液通过0.22 μm 滤器得到滤液,以100 000 r/min 超速离心70 min,弃上清。加入适量的无菌DPBS 或等渗冻干保护液反复吹打超速离心管底部,得到293T 细胞外泌体重悬液。将外泌体重悬液以10 000 r/min 离心5 min,去除超离过程中产生的杂质,回收外泌体重悬液待用。整个操作下均是在4℃下进行。
1.2.2 等渗冻干保护剂的配制 见表1。为验证赖氨酸在冻干过程能否保护外泌体,向超离后的293T细胞来源的外泌体中分别加入等体积浓度依次为50、100 和200 mmol/L 赖氨酸,冻干后加入等体积去离子水重悬,电镜下观察外泌体形貌。选择不同玻璃化温度的糖类如乳糖(lactose)、海藻糖(trehalose)和菊糖(inulin),并测试它们在外泌体冻干过程中的保护作用。
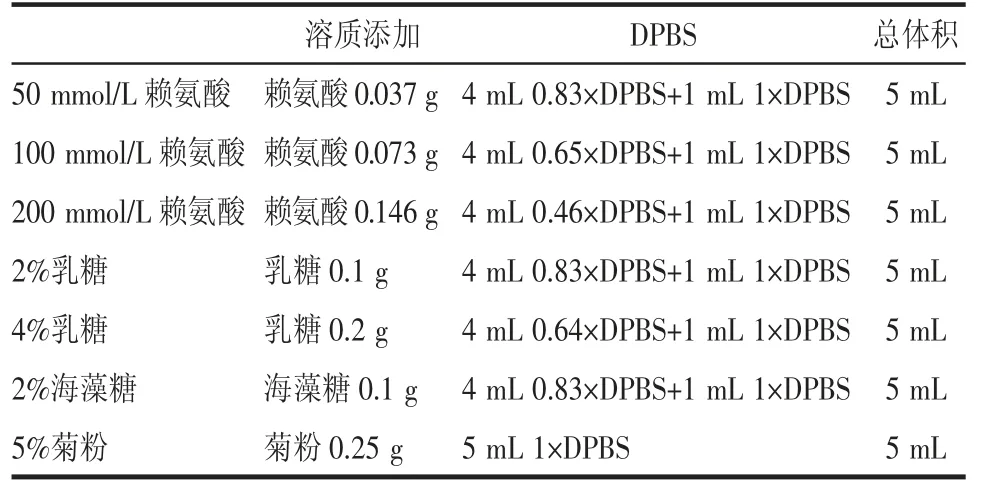
表1 不同冻干保护剂的成分和配比Tab 1 Composition and ratio of different lyoprotectants
1.2.3 外泌体冻干及重悬 将新鲜制备的外泌体放入液氮中快速冷冻,使用冷冻干燥机以0.050 mPa及-56℃条件将外泌体样品在真空中冻干12 h 后,并在室温下储存1 d~1 个月直至使用。在使用前,冻干后的外泌体用冻干前相同体积的水再水化。
1.2.4 醋酸铀染色及透射电镜表征 将等体积的4%多聚甲醛加入到外泌体重悬液,室温下静置20 min固定外泌体。取20 μL 固定后的外泌体置于Parafilm 封口膜上形成悬滴,再用镊子将碳膜铜网的光亮面倒扣置于外泌体悬滴上,室温下孵育20 min,使外泌体吸附到铜网上。随后,将铜网转移至100 μL DPBS 悬滴上孵育5 min,再转移到100 μL 去离子水上继续孵育5 min,接着将铜网置于100μL 1%戊二醛溶液上,室温固定5 min;用100 μL 去离子水洗涤铜网,每次洗涤时间2 min,一共洗涤8 次;将铜网转移至100 μL 草酸铀溶液(4%乙酸双氧铀溶液和0.15 mol/L 草酸等体积配制,并调pH 为7)上,室温染色5 min;将铜网转移到100 μL 甲基纤维素-乙酸双氧铀溶液(4%乙酸双氧铀溶液和2%甲基纤维素体积比为1∶9 配制)上,放置冰上染色7 min;用滤纸快速吸去铜网上多余的溶液,最后将铜网置于滤纸上风干,透射电镜观察形貌和分散性。
1.2.5 血浆外泌体诱导血管成管实验 将新鲜采集的人血加入抗凝剂EDTA 混匀,将血液于3 000 r/min离心30 min,取上清。将上清加入无菌DPBS 稀释10 倍,将稀释液以6 000 r/min 的转速离心30 min后弃沉淀,接着以6 000 r/min 的转速离心30 min后弃沉淀,再以10 000 r/min 的转速离心30 min 后弃沉淀。离心后的上清液通过0.22 μm 滤器得到滤液,以100 000 r/min 超速离心70 min,弃上清。加入适量的无菌DPBS 反复吹打超速离心管底部,得到293T细胞外泌体重悬液。将外泌体重悬液以10 000 r/min离心5 min,去除超离过程中产生的杂质,回收外泌体重悬液待用。整个操作均是在4℃下进行。将外泌体加入2%海藻糖冻干。将基质胶以每孔300 μL 加入预冷的24 孔板中铺匀,放入37℃培养箱中1 h 使其凝固。接着向每个孔中加入2.5×105个血管内皮细胞,并且加入50 μg 的外泌体,37℃培养4~6 h 后在倒置荧光显微镜下观察。
1.2.6 外泌体的粒径分析 将外泌体通过自动注射泵在纳米颗粒跟踪分析仪上测试,每个样品分别记录3 次60 s 时仪器测量值,并使用NTA3.3 软件进行分析。
1.2.7 蛋白免疫印迹表征 将30 μg 外泌体加入至10%聚丙烯酰胺凝胶中分离并转移至PVDF 膜,加入5%脱脂牛奶并在4℃下封闭2 h。将PVDF 膜按marker 蛋白剪成相应大小条带,将兔源CD63 多克隆抗体(美国,Santa Cruz 公司)、鼠源CD81 多克隆抗体(美国,Santa Cruz 公司)分别稀释200 倍与相应PVDF 膜孵育,在4℃摇床上孵育12 h,回收一抗。用5%脱脂牛奶清洗PVDF 膜,每次10 min,一共3 次。将HRP 标记羊抗兔抗体(中国,联科生物)、HRP 标记的羊抗鼠抗体(中国,联科生物)的二抗稀释5 000 倍,然后与相应的PVDF 膜条带孵育,于4℃摇床下孵育2 h,回收二抗。再用含有1‰吐温-20的PBS 清洗3 次,每次10 min。最后向PVDF 膜滴加200 μL 发光液,压片曝光成像。
1.2.8 细胞摄取实验 将C2C12 细胞以5×104个/孔接种到24 孔板的细胞爬片上,加入500 μL 去外泌体的10%FBS 培养基培养过夜。将10 μg 经DiR荧光标记的293T 外泌体加入24 孔板中,5%CO2,37℃培养24 h,使C2C12 细胞充分摄取外泌体。次日,加入500 μL DPBS 轻轻冲洗细胞3 次,去除死细胞,再加入200 μL 4%PFA 室温固定30 min。最后将爬片取出,加入一滴含DAPI 的封片剂封片,避光风干1 h,激光共聚焦显微镜拍照观察。
1.3 统计学处理 使用SigmaStat3.5 进行统计分析,正态分布的计量资料用±s 表示,组间均数比较采用单因素方差分析,P<0.05 为差异具有统计学意义。
2 结果
2.1 赖氨酸作为冻干保护剂对外泌体的影响 在不加冻干保护剂的情况下,冻干后的外泌体发生破损,产生大量外泌体聚集体,外泌体双层膜结构被严重破坏,分散度差。在含有50、100 和200 mmol/L赖氨酸的冻干组中,外泌体呈现典型的杯状囊泡结构,形貌较完整。另外,从分散性角度来看,不加冻干保护剂时,外泌体双层膜结构被严重破坏,产生大量外泌体聚集体,分散度较差。虽然赖氨酸作为冻干保护剂在一定程度上保护了外泌体形貌的完整,但与-80℃保存条件下的外泌体相比,赖氨酸未完全解决冻干导致的外泌体聚集和膜融合现象,见图1。
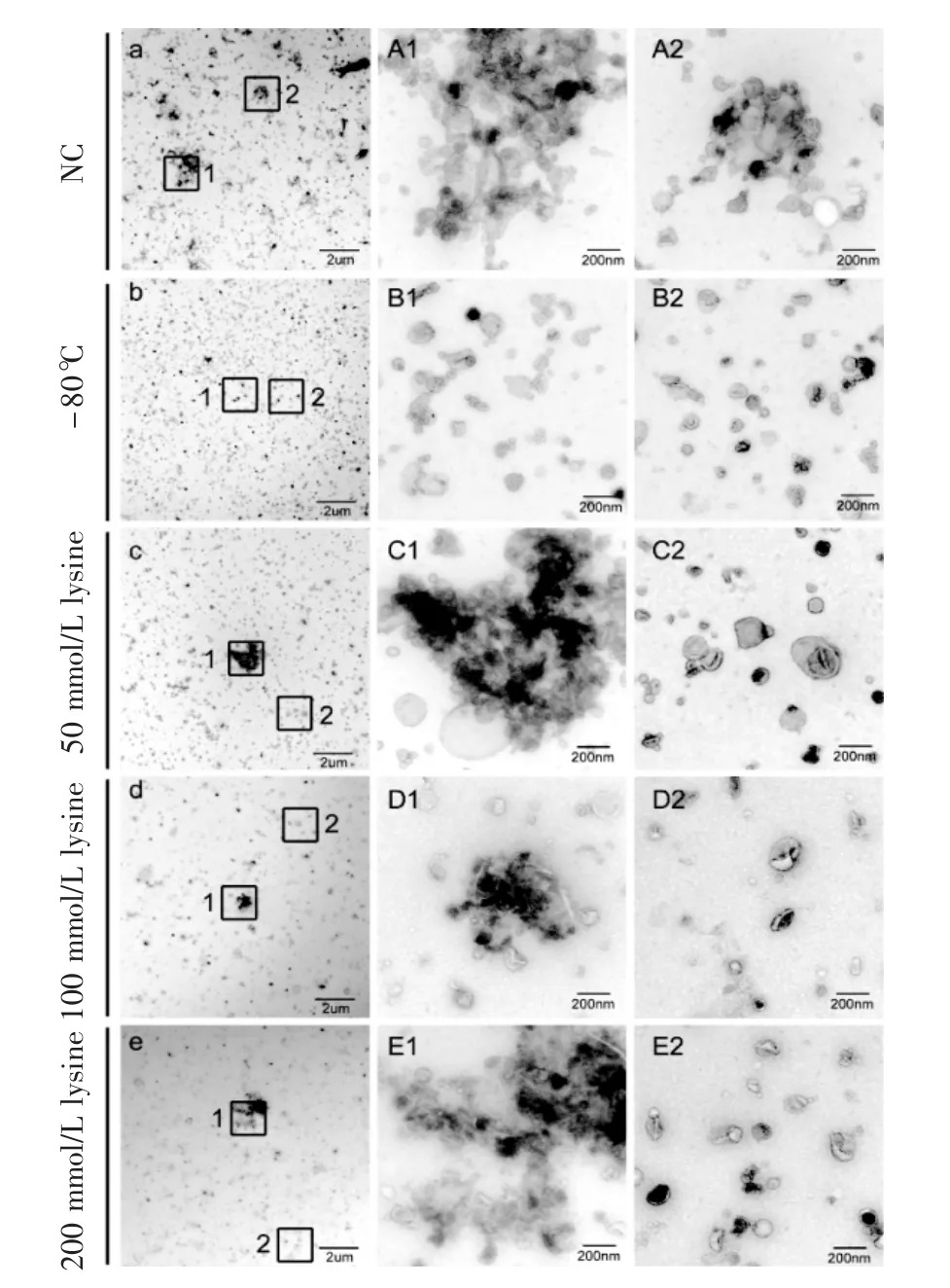
图1 赖氨酸作为冻干保护剂的外泌体的电镜表征Fig 1 Electron microscopy characterization of exosomes with lysine as a lyoprotectant
2.2 糖类作为冻干保护剂对外泌体的影响 2%乳糖部分缓解了外泌体在冻干过程中发生的聚集现象,但是存在少量膜碎片,而4%乳糖和2%海藻糖作为冻干保护剂时外泌体分散较好,呈现双层膜囊泡结构。乳糖对冻干外泌体的保护作用呈浓度依赖性。菊糖组外泌体分散良好,没有出现膜融合现象,但是外泌体膜发生破损。进一步比较了4%乳糖组和2%海藻糖组,可以看出两组外泌体形貌差异不大,而2%海藻糖组外泌体的分散程度更高。最终选用2%海藻糖作为外泌体冻干保护剂进行下游测试。2.3 血浆外泌体冻干后的功能测试 将血浆来源外泌体用2%海藻糖进行冻干,结果显示(图3),冻干后的血浆外泌体仍然可以诱导血管内皮细胞成管,并且和-80℃组相比基本没有差异。
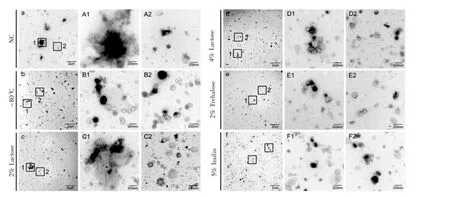
图2 乳糖、海藻糖和菊糖作为冻干保护剂的外泌体的电镜表征Fig 2 Electron microscopy characterization of exosomes with lactose,trehalose and inulin as lyoprotectants

图3 2%海藻糖用于冻干血浆外泌体的细胞成管实验Fig 3 2% trehalose for cell tube formation experiments of lyophilized plasma exosomes
2.4 冻干后不同储存时间下的外泌体表征 电镜结果显示(图4A、4B 和4C),冻干后常温储存1 d、1 周甚至1 个月的外泌体形貌依然完整,呈现典型的杯状结构,并且分散度良好、没有聚集。纳米颗粒跟踪分析仪结果显示(图4D、4E),在储存1 d 后,2%海藻糖冻干组外泌体与-80℃组外泌体粒径分布没有差异,而且两组外泌体数量均没有显著性差异(F=28.8,P>0.05),但是没有加入海藻糖组的外泌体数量和另外两组相比显著降低(F=28.8,P<0.001)。在储存1 周后,2%海藻糖冻干组外泌体与-80℃组外泌体粒径分布也没有差异,而且两组外泌体数量均没有显著性差异(F=88.8,P>0.05),但是没有加入海藻糖组的外泌体数量和另外两组相比显著降低(F=88.8,P<0.001)。在储存1 个月后,2%海藻糖冻干组外泌体与-80℃组外泌体粒径分布亦无差异,而且两组外泌体数量均无显著性差异(F=136.9,P>0.05),但是没有加入海藻糖组的外泌体数量和另外两组相比显著降低(F=136.9,P<0.001)。
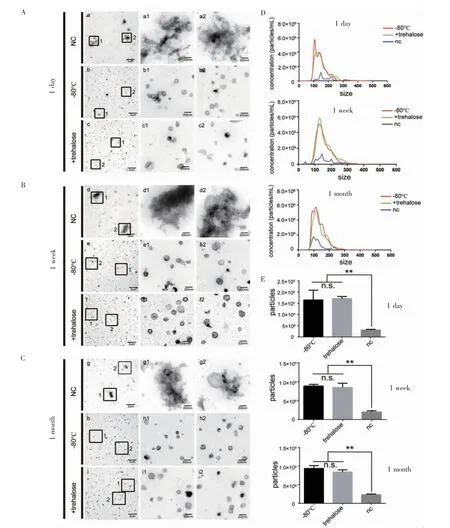
图4 分别储存1 d、1 周和1 个月的外泌体表征Fig 4 Characterization of exosomes stored for 1 day,1 week,and 1 month
免疫印迹结果显示(图5A),加入2%海藻糖冻干处理后的外泌体,即使在常温条件下储存1 个月,依旧能有效防止储存过程中外泌体标志蛋白CD63和CD81 被降解,而不加海藻糖的外泌体CD81 和CD63 蛋白都发生了降解,而且随着时间的增加,降解越严重,到1 个月后CD81 和CD63 蛋白基本完全降解。冻干后的外泌体用DiR 荧光染料标记并将其加入C2C12 细胞中,观察能否被细胞摄取。共聚焦结果显示(图5B),与储存在-80°C 下的外泌体相比,2%海藻糖冻干后储存的外泌体显示出相似的细胞摄取能力,而不加海藻糖组进入细胞的外泌体较少。
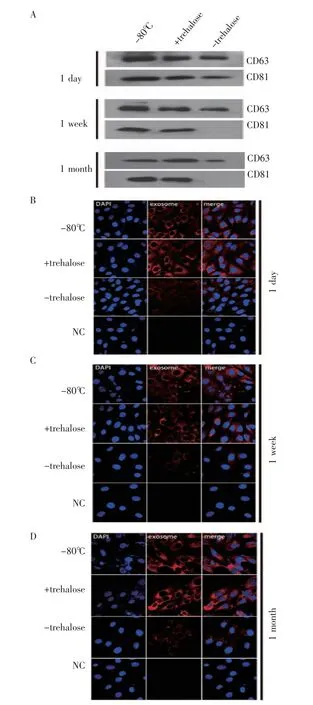
图5 2%海藻糖作为外泌体冻干保护剂时,不同储存时间的外泌体功能测试Fig 5 Exosome function test at different storage time with 2%trehalose used as exosome lyoprotectant
3 讨论
外泌体是由细胞分泌的直径在30~150 nm 的天然生物纳米囊泡,能够以长、短距离的方式来运输功能性生物分子,是细胞内及细胞间的信使[13-15]。同时外泌体因具有生物相容度高、免疫原性低/无、特定组织趋向性、可修饰性以及高稳定性等优势[1-2]被作为天然的纳米载体,已广泛应用于药物运输[3-4]和疾病诊断治疗[5-7]等研究。然而,外泌体的运输和长期储存是限制其临床应用的重要因素。目前外泌体以-80°C 储存为主[8],该方法运输成本较高,临床适用性差,因此,亟需开发一种更为有效的外泌体储存方法。冻干技术具有保持物质活性,防止其被氧化和加水易复原等优势,广泛用于保存蛋白质[9]、血清[10]和细胞[11]等生物物质,并且可用于改善纳米载体例如脂质体等的稳定性[12]。然而,冻干会对生物样品施加相当大的压力,因此,如果没有得到适当的保护,外泌体等膜结合囊泡在冷冻干燥和再水化过程中会发生破损。目前常用的冻干保护剂(lyoprotectant)有甘露醇、甘油、二甲基亚砜、糖类(如海藻糖、蔗糖)、聚乙烯吡咯烷酮等。
鉴于此,在本研究中,根据水置换[16]和玻璃化假说[17]保护理论评估了赖氨酸、乳糖、海藻糖和菊粉等冻干保护剂对冻干外泌体的影响。水置换假说提出非挥发性冻干保护剂分子(例如赖氨酸[18]),通过形成稳定的氢键来代替脂质体膜上的水分子来保持其膜完整性。笔者首先尝试了赖氨酸,通过电镜结果发现,不加冻干保护剂时,外泌体发生聚集和膜融合,这和Frank 等[19]发现将细胞外囊泡直接冷冻干燥会导致其粒径分布扩大和聚集一致。而在加入50、100 和200 mmol/L 赖氨酸的冻干组中,外泌体呈现典型的杯状囊泡结构,形貌较完整,但是不同浓度的赖氨酸均没法彻底解决冻干时外泌体的聚集问题。另一方面,玻璃化模型是冻干保护剂(如糖类)与脂质体形成高黏度水相,可以维持相邻脂质双层之间的间距,降低脂质双层的表面张力,避免外泌体在冷冻干燥过程中出现膜融合和破坏[20-21]。因此,再根据玻璃化模型比较了乳糖、海藻糖和菊糖对外泌体的保护效果。其中菊糖因高玻璃化温度在冻干外泌体的分散度上表现良好,但其分子量过大产生空间位阻,无法填补冻干时水分子的缺失造成外泌体膜破损。4%乳糖和2%海藻糖能很好地解决冻干时外泌体的聚集和保护外泌体形貌完整的问题,并且4%乳糖和2%海藻糖保护效果相当。但由于许多人对乳糖不耐受,最终选择了2%海藻糖作为冻干保护剂。EL Baradie 等[22]使用海藻糖和高分子化合物PVP40 结合冻干外泌体时,外泌体完整度和分散度都很好,但使用前需要将聚乙烯吡咯烷酮-40 去除,限制了其进一步的应用,故直接使用2%海藻糖会更加方便快捷。为了验证2%海藻糖冻干是否会影响外泌体本身的功能,检测冻干后血浆来源外泌体诱导血管生成功能是否保留[23],结果发现冻干后的血浆来源的外泌体仍然可以诱导血管上皮细胞成管。接着将外泌体用2%海藻糖进行冻干,在室温储存1 d、1 周和1 个月,评估在运输条件下储存不同时间周期对冻干外泌体的影响。电镜和纳米粒经分析结果显示在室温储存1 d、1 周和1 个月后仍然保持着原有的形貌和分散度,不会改变外泌体的粒径分布,并且防止了大量外泌体颗粒的损失。此外,还评估了外泌体表面蛋白保留情况和其作为载体的功能。免疫印迹结果显示,2%海藻糖能防止外泌体表面的关键蛋白CD63 和CD81 的降解,这和前面报道的海藻糖能稳定冻干的蛋白质一致[24-25]。同时,添加2%海藻糖冻干后的外泌体常温储存后依旧能被细胞摄取,不会影响外泌体作为纳米载体的进入细胞的固有属性。
综上所述,本研究为外泌体的储存提供了一个新的选择,便于外泌体早日走向临床应用。但在目前的实验中,外泌体的储存时间仅限于室温下1 个月,外泌体的更长时间的储存仍需进一步研究和探索。
