阻塞性睡眠呼吸暂停低通气综合征对非酒精性脂肪性肝病患者胰岛素抵抗及肝损伤的影响
2022-08-01王建军夏泽海王艺君吕群
王建军,夏泽海,王艺君,吕群
非酒精性脂肪性肝病(NAFLD)是一种常见代谢性疾病,在西方国家其总体患病率为25%,在我国NAFLD 患病率也呈逐年增多趋势[1]。NAFLD 主要临床特征为排除酒精及其他已知肝脏疾病所导致的三酰甘油在肝脏内聚集,临床可表现为单纯性脂肪肝、非酒精性脂肪性肝炎和(或)纤维化及终末期肝硬化。非酒精性脂肪性肝炎预计最终将超过丙型肝炎病毒和酒精性肝病,成为肝移植的主要原因[2]。
目前认为阻塞性睡眠呼吸暂停低通气综合征(OSAHS)能导致NAFLD 的发生发展,但确切机制尚未完全阐明,其中“二次打击”学说受到瞩目,胰岛素抵抗是代谢综合征的关键特征,被认为在脂肪肝浸润的第一重打击中起着核心作用[3]。胰岛素抵抗可能参与了OSAHS 导致的NAFLD 的发生发展。然而在胰岛素抵抗与夜间间歇性缺氧之间也存在着千丝万缕的联系,本研究旨在探讨夜间间歇性缺氧对NAFLD 患者胰岛素抵抗及肝损伤的影响。现报道如下。
1 资料与方法
1.1 一般资料 选取2019年1月至2021年9月在杭州师范大学附属医院诊治的NAFLD 患者共60例,所有患者均完成夜间多导睡眠图(PSG)监测。根据呼吸暂停低通气指数(AHI)是否≥5和(或)夜间最低血氧饱和度≤90%,分为OSAHS 合并NAFLD 组(30例)和单纯NAFLD 组(30例)。收集所有患者的性别、年龄、体质量指数(BMI)及吸烟状况等基本资料。本研究经医院医学伦理委员会批准,患者知情并签署知情同意书。
1.2 纳入及排除标准 纳入标准:(1)年龄18 ~80岁;(2)符合NAFLD诊断。排除标准:排除长期饮酒史,以及慢性阻塞性肺疾病、哮喘、肺部感染、间质性肺病、病毒性肝炎、酒精性肝病、自身免疫性肝病、药物性肝损及肝硬化等慢性肝脏疾病及肿瘤病史。
1.3 方法
1.3.1 PSG检测 采用美国邦德多导睡眠监测系统,监测夜间睡眠7 h 以上。OSAHS诊断参照《阻塞性睡眠呼吸暂停低通气综合征诊治指南(2011年修订版)》的诊断标准[4]:临床有典型的夜间睡眠打鼾伴呼吸暂停、日间嗜睡(ESS 评分≥9 分)等症状,查体可见上气道任何部位的狭窄及阻塞,AHI≥5 次/h 和(或最低血氧饱和度≤90%)可诊断OSAHS;对于日间嗜睡不明显(ESS评分<9分)者,AHI≥10 次/h或AHI≥5 次/h,存在认知功能障碍、高血压、冠心病、脑血管疾病、糖尿病和失眠等1 项或1 项以上OSAHS 合并症也可确立诊断,通过PSG 筛选出夜间间歇缺氧患者。
1.3.2 彩色多普勒超声检查 清晨空腹8 h以上,以彩色多普勒超声筛查脂肪肝患者。符合以下3 项中(肝脏近场回声增强、远场回声衰减以及肝内血管显示不清)2 项及以上者为脂肪肝。
1.3.3 肝脏脂肪变性及肝功能损伤检测清晨空腹抽取静脉血,检测血清总胆固醇、三酰甘油、丙氨酸氨基转移酶(ALT)及天冬氨酸氨基转移酶(AST)等指标。
1.3.4 胰岛素抵抗指数评估 以稳态模型(HOMA)的胰岛素抵抗指数(HOMAIR)来评估胰岛素抵抗水平。清晨空腹抽取静脉血,检测血清胰岛素水平及空腹血糖水平,HOMA-IR=[空腹血清胰岛素( U/ml)×空腹血糖(mmol/L)]/22.5。
1.4 统计方法 采用SPSS 25.0 统计软件进行分析,计量资料服从正态分布采用均数±标准差表示,偏态分布采用中位数表示,采用t 检验或非参数检验。计数资料采用2检验。P <0.05 为差异有统计学意义。
2 结果
2.1 两组一般资料比较 两组性别、年龄、吸烟史及BMI差异均无统计学意义(均P >0.05)。OSAHS 合并NAFLD组血胆固醇、三酰甘油、ALT 和AST 水平均高于单纯NAFLD组(均P<0.05)。见表1。

表1 两组一般资料比较
2.2 两组胰岛素抵抗水平比较 OSAHS 合并NAFLD 组AHI指数、空腹血清胰岛素及HOMA-IR 指数均高于单纯NAFLD 组(均P <0.05),OSAHS 合并NAFLD 组夜间最低血氧饱和度低于单纯NAFLD组(P<0.05),两组空腹血糖差异无统计学意义(P >0.05)。见表2。
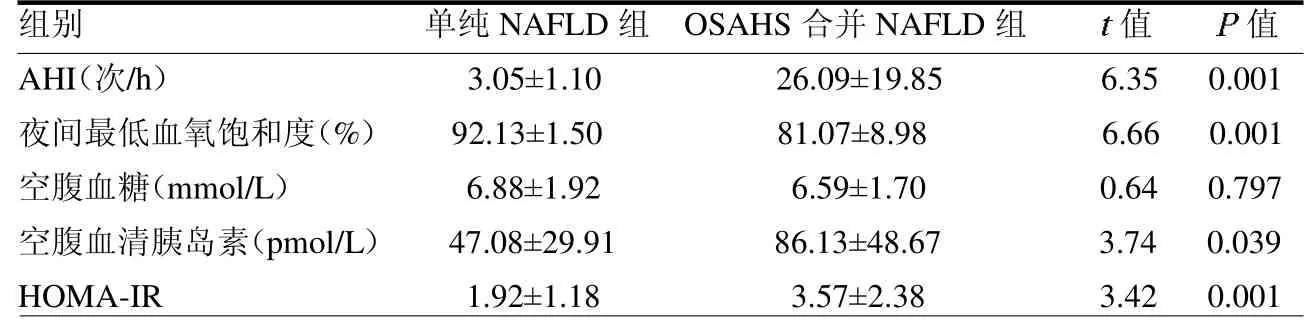
表2 两组胰岛素抵抗水平比较
2.3 中重度OSAHS 与轻度OSAHS 患者胰岛素抵抗水平比较 OSAHS 合并NAFLD组患者中,AHI≥15患者空腹胰岛素水平及HOMA-IR 指数均高于AHI<15 患者(均P <0.05);OSAHS 合并NAFLD组患者中,夜间最低血氧饱和度<85%患者空腹胰岛素水平及HOMAIR 指数均高于夜间最低血氧饱和度≥85患者,但差异均无统计学意义(均P >0.05)。见表3。
2.4 NAFLD患者夜间间歇性缺氧与胰岛素抵抗及肝功能损伤相关性分析 两组患者AHI 指数与空腹胰岛素水平、HOMA-IR、ALT 及AST 均呈正相关(均P<0.05);夜间最低血氧饱和度与空腹胰岛素水平、HOMA-IR、胆固醇、ALT及AST 均呈负相关(均P <0.05)。见表4。

表4 AHI 及夜间最低血氧饱和度与胰岛素抵抗及肝损伤指标的相关性分析
3 讨论
NAFLD 是一种常见的慢性代谢性肝脏疾病,其发病机制有多种因素导致,脂肪肝浸润、炎症、氧化应激和进行性纤维化等均有被提及与NAFLD 的发生发展相关[3]。目前对于OSAHS引起NAFLD的发病机制尚未阐明,“二次打击”学说备受瞩目[3]。多种因素如肥胖、糖尿病等可导致胰岛素抵抗,引起三酰甘油在肝细胞胞质中沉积,最终导致NAFLD的发生发展,而夜间间歇性缺氧可能在肝脂肪变性向脂肪性肝炎转变中起着关键性作用。
本研究发现存在夜间间歇性缺氧的NAFLD患者其血脂代谢异常更为显著,该部分患者血清三酰甘油水平高于单纯NA LFD 患者组,表明夜间间歇性缺氧可加重患者血脂代谢异常。三酰甘油通常与脂质代谢密切相关,血清高水平的三酰甘油也是导致肝细胞三酰甘油沉积的重要原因。相关性分析显示血清胆固醇水平随着夜间最低血氧饱和度的降低而升高,这表明夜间缺氧程度和脂质积累之间存在密切关联,缺氧越严重,脂质积累越明显。
本研究发现NAFLD 的肝功能损伤程度与OSAHS严重程度呈正相关。OSAHS 合并NAFLD 患者血清ALT 和AST 水平也较单纯NAFLD 患者更高,这表明夜间间歇性缺氧会加重肝细胞损伤。肝脏对缺氧较为敏感,反复的夜间间歇性缺氧会加重肝细胞损伤,导致单纯性脂肪肝向肝炎及肝硬化转变。AHI指数与ALT、AST 呈正相关;夜间最低血氧饱和度与ALT、AST 呈负相关,这些结果表明夜间缺氧越重肝损伤越明显。尽管有个例报道夜间持续气道正压通气可逆转NAFLD 的发生发展,但仍需要更多的循证学证据,目前对于纠正夜间缺氧是否能逆转NAFLD 的发生发展仍有待进一步研究证实[5-6]。
胰岛素抵抗在NAFLD 的发生发展中起着至关重要的作用。本研究结果显示OSAHS 合并NAFLD 组血清胰岛素水平和HOMA-IR 指数均高于单纯NAFLD组,这表明存在夜间缺氧的NAFLD患者胰岛素抵抗水平更为明显。在AHI≥15 次/h 的患者中其HOMA-IR 指数高于AHI<15 次/h及单纯的NALFD患者,进一步相关性研究结果显示,HOMA-IR 指数与AHI 指数呈正相关,而与夜间最低血氧饱和度呈负相关。这可能机制为夜间间歇性缺氧导致人体处于应激状态下,从而导致应激性血糖升高,通过负反馈性机制,使患者出现高胰岛素血症,长时间反复的缺氧刺激必然导致胰岛素抵抗的发生。胰岛素抵抗和高胰岛素血症是促进脂肪肝代谢综合症的组成部分。也有研究者认为NAFLD 本身会导致胰岛素降解受阻,从而诱导慢性高胰岛素血症[7-8]。
综上所述,OSAHS合并NAFLD患者存在更为显著的血脂代谢异常、肝功能损伤及胰岛素抵抗水平,而这恰恰也是NAFLD 发病机制中首次打击的主要原因。因此,对于OSAHS 合并NAFLD 患者早期及时有效的干预,纠正夜间缺氧,为该部分患者的治疗起到积极有效的作用。
