脑脊液HMGB1 水平在预测高血压继发性脑室出血患者慢性脑积水中的价值
2022-08-01管敏武王新东励勇章建飞陈威
管敏武,王新东,励勇,章建飞,陈威
脑室出血后脑积水(PHH)是脑室出血的常见并发症,发生率51%~89%,大部分患者可出现认知或神经功能恶化,严重影响预后[1]。目前研究认为脑室内的血液分解产物诱发的无菌性炎症与PHH的发生密切相关,对这些炎性物质的研究可能有助于评估脑室出血的严重性及预测PHH 的发生,为早期治疗提供帮助[2]。高迁移率族蛋白B1(HMGB1)是一种重要的促炎因子,参与多种神经系统疾病的炎症过程[3]。自发性脑出血患者急性期血液中HMGB1 浓度明显升高。小鼠模型研究发现,HMGB1 在脑出血1h后便被转运到神经细胞胞浆中,激活炎症细胞[4-5]。而HMGB1 在脑室出血患者脑脊液中的表达,以及与PHH发生的相关性,目前国内外尚缺乏相应报道。本研究拟对高血压继发脑室出血患者发生PHH的危险因素进行分析,并探讨脑脊液HMGB1 水平在预测PHH 发生中的价值,报道如下。
1 资料与方法
1.1 一般资料 收集2016年12月至2020年12月宁波大学医学院附属医院收治的高血压继发性脑室出血并行脑室外引流患者作为研究对象。所有患者符合2015年自发性脑出血诊断治疗中国多学科专家共识中脑室出血诊断标准[6],入院时头颅CT 证实为高血压脑实质出血并破入脑室,脑实质出血量<30 ml。排除标准:(1)年龄<18岁;(2)因凝血功能异常、动脉瘤、动静脉畸形、肿瘤或创伤导致的脑室出血;(3)近1个月内有过感染;(4)正在服用抗血小板或抗凝药物;(5)存在其他神经系统病变;(6)合并肝硬化、恶性肿瘤、自身免疫系统疾病等多种全身性病变。共纳入81例,男58例,女23例;年龄25 ~84岁,平均(58.6±13.1)岁。患者及其家属知情同意并自愿参加,本研究获本院医学伦理委员会批准。
1.2 方法 入选患者均在发病24 h 内行脑室外引流术,术后留置外引流管。记录患者入院时的基本资料、生命体征、既往病史、GCS 评分、改良Graeb 评分等。收集3 次脑脊液样本,均从脑室引流系统收集,分别为发病24 h 内(术中),发病第3、7天。将采集的脑脊液3 000 r/min离心10min,-80℃环境下储存直到检测。脑脊液HMGB1 水平采用酶联免疫吸附试验法,试剂盒购自北京索莱宝科技有限公司,所有操作均按规范完成。
1.3 观察指标 所有患者出院后进行为期3个月的随访,定期复查头颅CT或头颅MRI。对发病14d 后脑室仍扩大,符合脑积水诊断标准[7]的患者定义为PHH。
1.4 统计方法 采用SPSS 23.0 软件进行统计分析,计量资料以均数±标准差表示,组间比较采用t检验;计数资料采用2检验;相关性分析采用Pearson相关分析;采用单因素和多因素Logistic 回归分析评估影响PHH的相关指标;采用Medcalc(版本20.0)软件绘制受试者工作特征曲线(ROC),计算ROC 曲线下面积(AUC)分析HMGB1 对PHH 的诊断价值。P <
0.05 为差异有统计学意义。
2 结果
2.1 脑脊液中HMGB1 浓度的变化发病24 h 内(术中)测得脑脊液中HMGB1 浓度为(9.36±2.28)ng/ml,第3天浓度为(11.43±3.16)ng/ml,第7天浓度为(6.86±2.45)ng/ml。其中17例(21.0%)在发病3个月内发生PHH。
2.2 发生慢性脑积水组与未发生组的临床资料比较 两组入院时GCS评分、mGraeb 评分、术前梗阻性脑积水、术后尿激酶冲洗及脑脊液HMGB1 水平差异均有统计学意义(均P <0.05)。见表1。
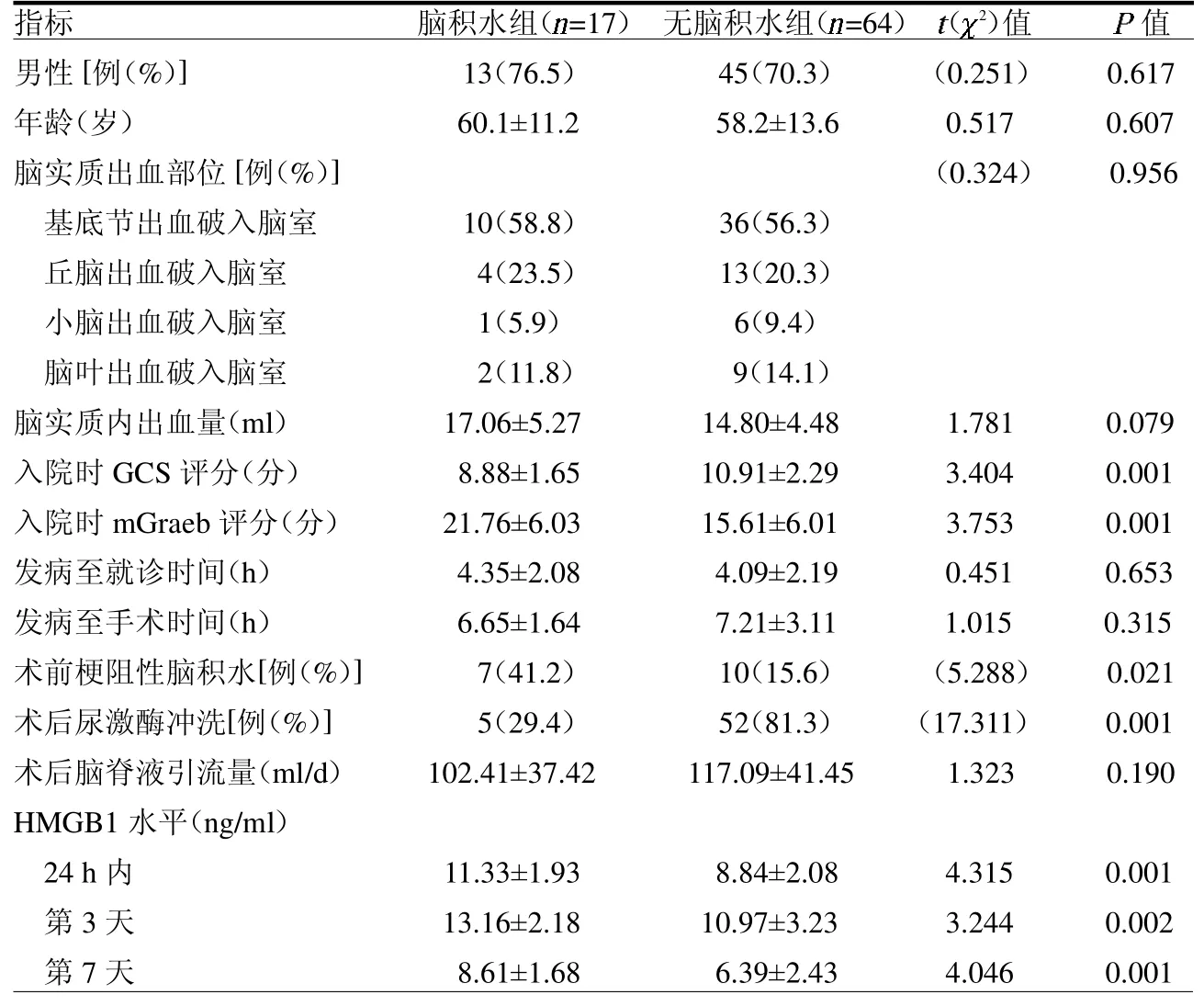
表1 发生慢性脑积水组与未发生组的临床资料比较
2.3 单因素和多因素Logistic 回归分析结果 单因素Logistic 回归分析显示入院GCS 评分、mGraeb 评分、术前梗阻性脑积水、术后尿激酶冲洗及脑脊液HMGB1 水平是影响高血压继发性脑室出血患者发生PHH的影响因素(均P <0.05)。多因素Logistic 回归分析显示入院时mGraeb 评分高、发病24 h 内和第7天HMGB1 水平高是发生PHH 的危险因素,术后尿激酶冲洗是保护性因素(均P <0.05)。见表2。
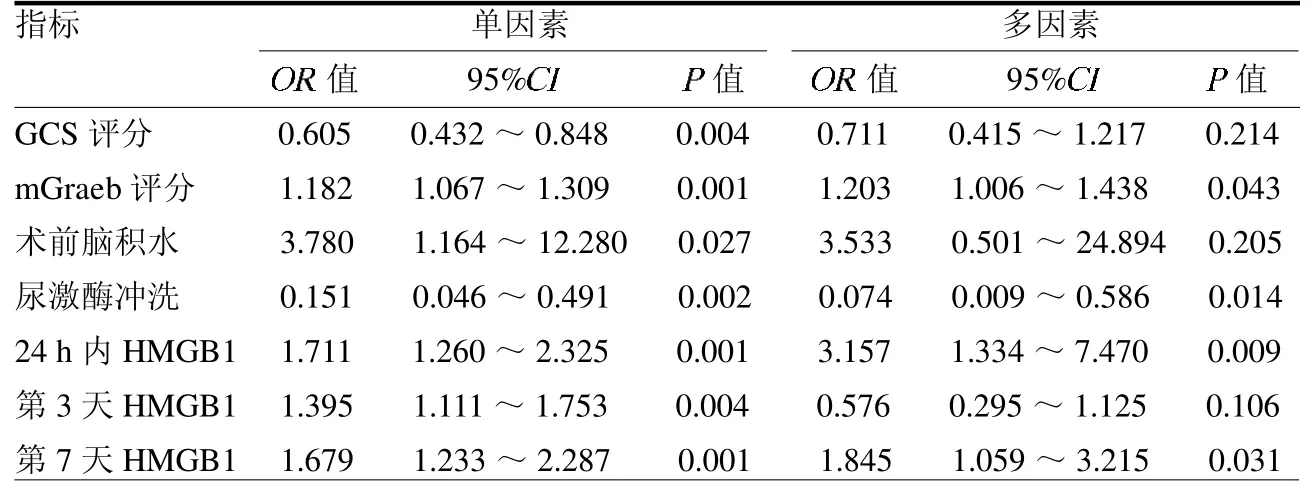
表2 单因素和多因素logistic 回归分析结果
2.4 HMGB1 对PHH 的诊断价值 发病24 h 内、第7天HMGB1 水平预测PHH 的AUC 分别为0.814 (95%CI:0.712 ~0.892)和0.806(95%CI:0.703~0.886),截断值分别为10.94 ng/ml 和7.57 ng/ml,灵敏度为58.82%和88.24%,特异度为90.62%和71.87%;2个指标联合预测PHH 的AUC 值为0.814(95%CI:0.711 ~0.918)。见封二彩图2。
3 讨论
PHH 是脑室出血的严重并发症,可增加患者死亡率或引起长期神经功能障碍。脑室出血后脑积水的发生机制非常复杂,但大部分研究认为急性期脑积水(<14 d)为梗阻性脑积水,慢性期脑积水(>14 d)与脑脊液异常分泌、吸收有关[8]。血液分解产物在脑室内诱发无菌性炎症,通过多种途径参与PHH 的形成。利用炎症因子作为生物标记物筛查PHH 高危患者一直是国内外研究的热点,但目前研究较多的是外周血中的炎症因子,结果容易受血脑屏障和机体其他器官炎症的影响[9]。本研究选择HMGB1 分子作为生物标记物,HMGB1是脑出血后启动和维持炎症瀑布式反应的中心分子,参与脑水肿、神经元凋亡等炎性损伤,已被证实能很好的反应脑出血患者的病情与预后。Zhou 等[10]研究发现脑出血患者急性期血液中HMGB1水平与入院时NIHSS 评分和3个月时mRS 评分呈正相关。Ma[11]报道脑室出血患儿脐带血中HMGB1 浓度显著高于正常新生儿,能反应患儿病情。Sokó[12]认为SAH患者急性期脑脊液中HMGB1水平与入院时Hunt-Hess 评分和WFNS评分呈正相关,并能预测患者预后。
本研究显示,高血压继发性脑室出血患者脑脊液中HMGB1 浓度在脑室出血后立即升高,于第3天达到高峰,然后逐渐回落。发生PHH 的患者,发病24 h内、第3、7天脑脊液中HMGB1 水平均高于无脑积水组;多因素回归分析表明,发病24 h 内、第7天脑脊液中HMGB1浓度是术后3个月内PHH 发生的独立危险因素(均P <0.05)。发病24 h 内、第7天HMGB1 水平预测PHH 的AUC分别为0.814 和0.806,截断值分别为10.94 ng/ml 和7.57 ng/ml。由此可见,脑脊液中HMGB1 浓度可作为预测脑室出血患者发生PHH的重要手段,具有一定的临床价值。
结合文献,笔者认为HMGB1 可能通过多种机制参与了脑积水的形成:(1)过度分泌脑脊液。HMGB1 是一种内源性DAMPs,通过活化Toll样受体4 信号通路,增加 NF- B 相关激酶 SPS1(SPAK)的表达,使脉络丛上皮细胞过度分泌脑脊液,形成PHH,抑制或沉默TLR4 信号分子则能减轻脑室扩张[13];(2)干扰脑脊液的正常流动。脑出血后HMGB1 升高可诱导VEGF生成,VEGF与脑室壁室管膜细胞上的VEGFR2 受体结合,激活NF- B 途径,使室管膜细胞连接中断和纤毛丢失,干扰脑脊液正常流动,从而引起脑积水的发生[14-15];(3)破坏血脑屏障。血脑屏障在维持脑脊液蛋白含量和脑内渗透压中发挥着重要作用,HMGB1 与TLR4 结合后能够活化MMP-9,下调钙黏连蛋白表达,增加血脑屏障的通透性,使脑脊液中蛋白含量和渗透压增加,自由水通过渗透梯度压流入脑室,产生继发性脑积水[16];(4)使蛛网膜纤维化,影响脑脊液的吸收。蛛网膜纤维化会影响脑脊液循环和吸收,HMGB1 通过影响下游TGF- 1,使细胞外基质过度沉积,参与蛛网膜纤维化的发生,进而产生脑积水[17]。
综上所述,HMGB1 在高血压继发性脑室出血患者脑脊液中水平升高,是影响PHH的独立危险因素,具有一定的预测慢性脑积水发生的价值,但HMGB1 参与PHH 的调控机制还有待进一步探究。
