碳青霉烯耐药铜绿假单胞菌株中耐药基因的表达及对多黏菌素异质性耐药的研究
2022-08-01许磊王广芬金雨虹周妃妃国建
许磊,王广芬,金雨虹,周妃妃,国建
铜绿假单胞菌(PA)是院内感染中常见的条件致病菌之一。在免疫功能低下、长期卧床及烧伤等患者中,PA 具有较高分离率,并可引起全身性感染等严重并发症[1]。碳青霉烯类抗生素是治疗PA 的首选抗菌药物之一。但随着其广泛应用,在临床逐渐检出碳青霉烯耐药铜绿假单胞菌(CRPA),给抗感染治疗带来极大困难,并造成不良的预后[2-3]。多黏菌素被认为是治疗多重耐药革兰阴性菌的最终选择。但多黏菌素在鲍曼不动杆菌、肺炎克雷伯菌等临床治疗中存在异质性耐药,往往造成抗感染治疗失败[4-5]。本研究对97 株CRPA 进行耐药基因检测与分析,并检测CRPA 对多黏菌素异质性耐药的频度,为临床治疗提供依据。报道如下。
1 材料与方法
1.1 材料 收集2019年1月至2020年2月宁波市医疗中心李惠利医院住院患者中分离的CRPA 97 株,排除同一患者重复菌株。所使用的标准菌株为铜绿假单胞菌(ATCC27853)和大肠埃希菌(ATCC25922),均购于美国ATCC公司。
1.2 药物试剂及仪器 抗生素亚胺培南、美罗培南、多黏菌素、比阿培南、头孢他啶、左氧氟沙星、头孢哌酮/舒巴坦、哌拉西林/他唑巴坦,购于Sigma 公司(上海)。肉汤培养基和Mueller-Hinton 琼脂平板购自OXOID公司(英国)。VITEK 2 Compact 全自动细菌鉴定及药敏分析系统、浊度仪为法国梅里埃公司产品;PCR 仪为美国BIO-RAD 公司产品。
1.3 实验方法
1.3.1 菌种鉴定 参考《全国临床检验操作规程》方法对菌株进行培养、分离和鉴定,并根据美国临床实验室标准化委员会(CLSI)标准分析结果,筛选CRPA。
1.3.2 耐药基因检测 所提取的菌株,经煮沸5 min 提取菌株总DNA。碳青霉烯酶相关基因(IMP、VIM、SIM、
GIM、SPM、NMD、OXA-1、OXA-2、OXA-10)及外膜蛋白(Opr)基因OprD2的特异性DNA 通过PCR 方法来测定。PCR 扩增体系为:模DNA 共计2 l,上下游引物各0.5 l,2×Taq PCR MasterMix 10 l(够自美国NewEnglandBioLab 公司),纯水7 l。PCR 仪器条件:94 ℃预变性10 min,94 ℃变性20 s,60 ℃退火10s,72℃延伸60 s,共40个循环。扩增完毕后,在琼脂糖凝胶中电泳成像。所用引物均由生工生物工程(上海)有限公司合成,见表1。

表1 PCR 引物序列及扩增产物长度
1.3.3 药物敏感性检测 将待测菌株与质控菌株分别在Mueller-Hinton 琼脂平板上37℃孵育过夜。制备0.5 麦氏上样菌液。配制12个浓度梯度的多黏菌素溶液,最高浓度为256 g/ml,依次将上样菌液加入96 孔板,37℃培养20 h。以上均在无菌条件下完成。根据美国CLSI2014 的标准[最小抑菌浓度(MIC)≤2 g/ml 表示敏感,MIC=4 g/ml表示中介,MIC >4 g/ml 表示耐药]来对判定菌株对多黏菌素敏感性。
1.3.4 群体谱分析 根据MIC 挑选对多黏菌素敏感的25 株进行群体谱分析。分别配制含有不同浓度多黏菌素(0、1、2、4、8、16、32 及64 g/ml)的Mueller-Hinton 琼脂平板。将0.5 麦氏菌液稀释8个梯度浓度,并植于Mueller-Hinton 琼脂平板上,37℃培养过夜。培养结束后计数生长菌落。取在最高浓度多黏菌素(64 g/ml)平板上生长的菌落,经无药平板培养传代72 h后,再次测定MIC。MIC>2 g/ml 浓度多黏菌素平板上生长的菌株为具有异质性耐药的菌株;此外,至少≥2倍MIC 浓度,但≤2 g/ml 浓度的多黏菌素平板上生长的菌株,定义为异质性[6]。
1.3.5 联合用药试验 选取6 株异质性耐药菌株以及相对应的原始菌株,同时选取6 株无异质性的菌株,进行体外药敏试验。抗生素的组合方案为:多黏菌素分别联合比阿培南、头孢他啶、左氧氟沙星、头孢哌酮/舒巴坦、哌拉西林/他唑巴坦进行药敏试验。以4 倍根据药物单独MIC 作为最高浓度,并进行8个梯度稀释,每两种药物1∶1 按降梯度方向加入96 孔板,37℃培养24 h,并计算部分抑菌浓度指数(FICI)。结果判定标准为:协同作用为FICI≤0.5,相加作用为0.5 <FICI≤1,无关作用为1 <FICI≤2,拮抗作用为FICI >2[7]。
1.4 统计学处理 用SPSS 25.0(美国IBM 公司)软件进行数据分析。
2 结果
2.1 菌株的基本特征 共在97例住院感染患者中收集97 株无重复CRPA。其中男52例,女45例;60岁及以上58例,60岁以下39例。菌株主要来源于体液(包括痰液、肺泡灌洗液、尿液、血液、分泌物以及引流液等),其中痰液中占比最高。患者住院科室主要分布于ICU(最常见)、呼吸内科、感染科和外科。
2.2 基因检测结果 通过PCR 验证:IMP 阳性20 株(20.61%),VIM 阳性11株(11.34%),SPM 阳性9 株(9.27%),OXA-10 阳性17 株(17.53%),OprD2 缺失62 株(63.92%)。
2.3 CRPA 多黏菌素MIC 值分布 95株(97.94%)对多黏菌素敏感,仅2 株呈中介,无耐药菌株。见表2。

表2 CRPA 多黏菌素MIC 值分布
2.4 CRPA群体谱分析 在用于群体分析的25 株CRPA 中,8 株(32.00%)存在异质性耐药,5 株(20.00%)具有异质性,12 株(48.00%)无异质性。见表3。
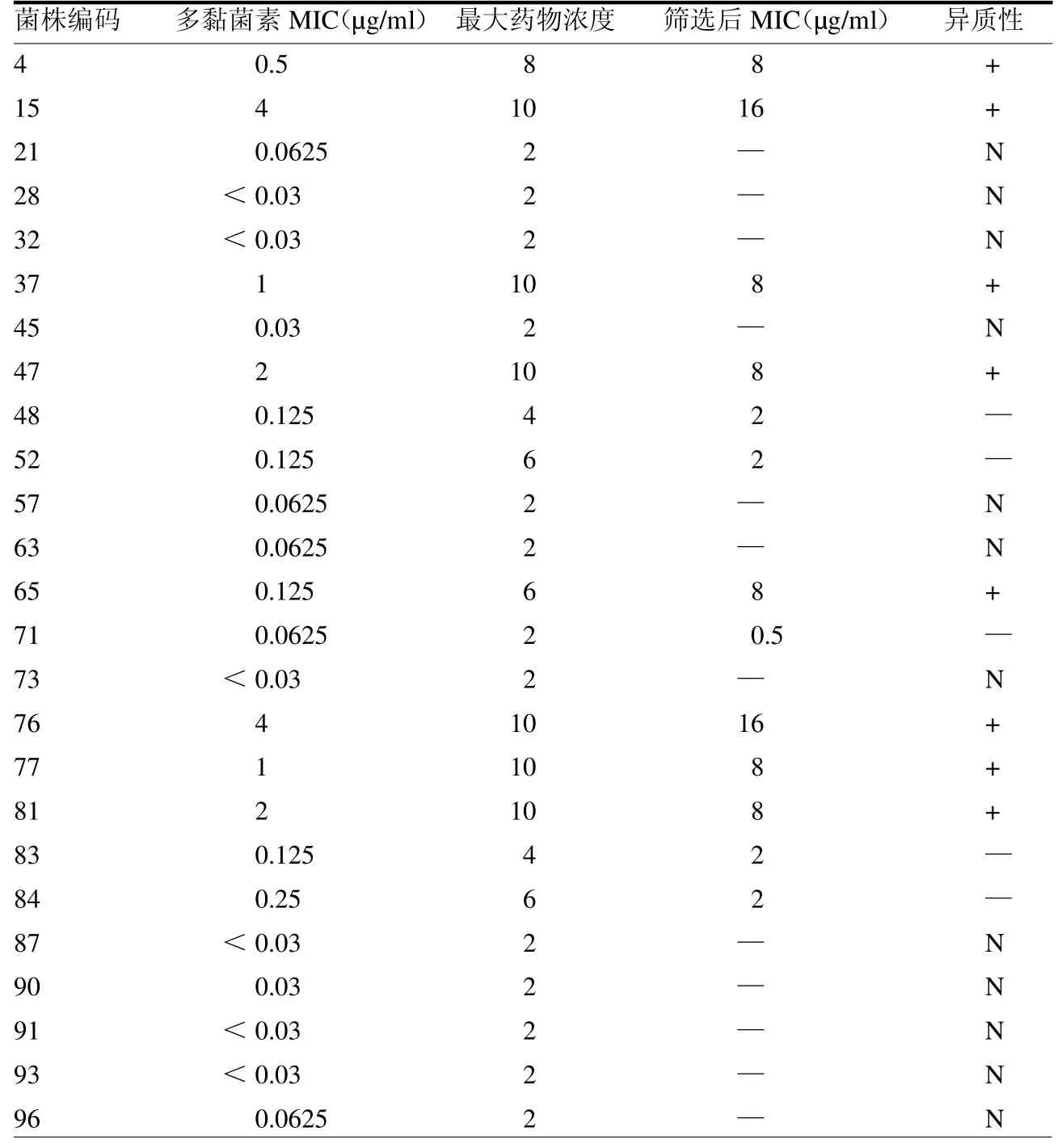
表3 CRPA 群体谱分布
2.5 联合用药结果 异质性耐药菌株4+、47+、65+,75+,77+,78+及其相对应的原始菌株表现出以协同作用和相加作用为主,部分却表现出无关作用。无异质性的菌株21、45、57、80、90、93 表现为协同作用、相加作用和无关作用。所有检测的菌株均没有出现拮抗作用。多黏菌素+比阿培南联合作用最佳,有66.67%(12/18)的菌株表现为协同作用,33.33%(6/18)的菌株表现相加作用。而多黏菌素+头孢哌酮/舒巴坦联合作用表现最差,只有22.22%(4/18)的菌株表现为协同作用。见表4。

表4 联合用药FICI
3 讨论
PA耐青霉烯类的主要机制为酶的生成,孔蛋白的缺失或主动内流[8]。PA 产生的青霉烯酶主要有 B 类金属酶(MBL,主要包括IMP、VIM、SIM、GIM、SPM、NMD)和D 类苯唑西林酶(OXA,包括OXA-1、OXA-2、OXA-10 等)。与文献[9]报道相似的是,本研究共收集97株CRPA 的结果提示IMP、VIM 和SPM可能是导致CRPA 耐药性的主要金属酶。此外,OXA-10 是引起CRPA 耐药的主要OXA 类型。
-内酰胺类抗生素需要经过细菌外膜的水通道Opr 进入细菌内[10]。OprD2是碳青霉烯类的特异性通道,缺失或不表达会此蛋白的PA 对碳青霉烯类抗生素耐药[11]。OprD2 进行PCR 扩增的结果显示,OprD2 缺失菌株 62 株(63.92%),因此推测CRPA 耐药性可能与OprD2 缺失有关。
本研究对97 株CRPA进行多黏菌素敏感性实验,其中95 株(97.94%)对此抗生素敏感,这表明多黏菌素对CRPA具有高度敏感性[12]。但需要临床医生重视的是,CRPA 对多黏菌素异质性现象也逐渐凸显[13]。本研究对25 株不同MIC 分布的CRPA 进行群体谱分析,结果显示8 株(32.0%)存在异质性耐药,5 株(20.00%)存在异质性。这表明多黏菌素治疗CRPA具有一定的潜在耐药的风险,其异质性及异质性耐药可能使临床抗感染治疗更加困难,在临床治疗中应加以重视。
由于CRPA 对碳青霉烯类的耐药性,及部分CRPA 菌株对多黏菌素异质性或异质性耐药,同时增加多黏菌素剂量后肾毒性的发生率也相应增加,故而采用多黏菌素为主联合其他抗生素治疗有一定的理论优势[14]。以往研究表明,多黏菌素联合治疗碳青霉烯耐药性或产生碳青霉烯酶的革兰阴性菌感染,同单用多黏菌素治疗组相比较,有显著的生存优势[15]。本研究联合用药实验中,多黏菌素与比阿培南联合应用抗菌效果最佳,这表明多黏菌素联合用药(特别是联合比阿培南)有助于防止异质性发展为耐药性。
综上所述,耐药性基因的表达可能是CRPA产生抗生素耐药的机制。CRPA对多黏菌素的敏感性仍很高,但对多黏菌素异质性或异质性耐药仍然存在。联合应用抗生素可能有效杀灭CRPA并预防其多多黏菌素的耐药。
