NOD1对甲状腺癌细胞BPCPA恶性生物学功能的影响及机制*
2022-08-01白宁刘春燕李颖张晓乐侯德强
白宁,刘春燕,李颖,张晓乐,侯德强
214000江苏 无锡,江南大学附属医院 内分泌科(白宁、刘春燕、李颖、张晓乐),口腔科(侯德强)
甲状腺癌是一种起源于甲状腺滤泡上皮细胞的恶性肿瘤,近年来其发病率呈上升趋势。尽管经手术、放射性碘和促甲状腺激素抑制等序贯治疗后甲状腺癌患者临床预后良好,但仍有5%~10%患者发生甲状腺或颈部淋巴结以外的转移,预后较差[1]。因此,探索可靠的预后标志物和转移机制对甲状腺癌患者的诊疗具有重要意义。核苷酸结合寡聚结构域1(nucleotide-binding oligomerization domain 1,NOD1),又称CARD4和NLRC1,是一种胞浆内模式识别受体,广泛表达于所有细胞类型,在免疫反应中起关键作用。近年来,NOD1已被证明可以调节癌症的进展,包括乳腺癌、肝细胞癌和结肠癌[2-4]。然而NOD1对甲状腺癌细胞的影响尚不清楚。本研究通过siRNA干扰甲状腺癌细胞中NOD1表达,进而确定NOD1对甲状腺癌的调控作用及分子机制,为甲状腺癌治疗策略的制定提供理论基础。
1 材料与方法
1.1 细胞株与试剂
人甲状腺癌细胞株BPCPA购自中国典型培养物保藏中心。NOD1 siRNA购自上海吉玛制药公司。Lipofectamine 2000试剂、TRIzol试剂、RIPA裂解液、Maxima H Minus第一链 cDNA合成试剂盒购自美国Thermo公司。TB Green预混试剂日本Takara公司。EdU试剂盒购自广州锐博生物公司。蛋白上样缓冲液、Annexin V-FITC细胞凋亡检测试剂盒、结晶紫染色液购自上海碧云天生物公司。细胞周期检测试剂盒购自南京凯基生物公司。兔抗人NOD1单克隆抗体、兔抗人GAPDH单克隆抗体、兔抗人p-P38单克隆抗体、兔抗人P38单克隆抗体、兔抗人p-ERK单克隆抗体、兔抗人ERK单克隆抗体和山羊抗兔IgG H&L(HRP)购自美国Abcam公司。
1.2 细胞培养
常规复苏人甲状腺癌细胞株BCPAP,培养基为含10%FBS、100 U/mL青霉素和100 mg/mL链霉素的DMEM培养基。细胞置于37℃、5% CO2的恒温生物培养箱培养。
1.3 细胞转染
将1×106个细胞种植于6孔板,待细胞密度达到70%左右进行转染。取10 μL Lipofectamine 2000试剂与250 μL Opti-MEM培养基混合,取10 μL siRNA混合于250 μL Opti-MEM培养基,室温孵育5 min。将两混合液混匀,室温孵育20 min。将siRNA-Lipofectamine 2000混合液加入含细胞及500 μL Opti-MEM培养基的孔中,摇晃孔板混匀。37℃、5% CO2的恒温生物培养箱培养6 h后,将培养基更换为完全培养基。转染空载体质粒NC-siRNA的细胞为siNC组,转染NOD1干扰质粒NOD1-siRNA的细胞为siNOD1组。
1.4 实时定量逆转录聚合酶链反应(Quantitative Real-time Polymerase Chain Reaction,qRT-PCR)
使用TRIzol试剂从细胞中提取总RNA,随后通过Maxima H Minus第一链 cDNA合成试剂盒将总RNA逆转录为cDNA。使用TB Green预混试剂在Stepone荧光定量PCR仪上进行定量扩增。引物合成由生工生物工程(上海)股份有限公司完成。NOD1:5’-CCTAGACAACAACAATCTCAACGACTA-3’(上游),5’-TTTACCCCACCGTCAGTGATC-3’(下游)。GAPDH:5’-GAAGGTGAAGGTCGGAGTC-3’(上游),5’-GGCTGTTGTCATACTTCTCATGG-3’(下游)。以GAPDH为参照基因,通过2-ΔΔCt计算NOD1相对表达量。
1.5 Western blot检测NOD1表达
使用RIPA裂解液提取细胞总蛋白,与蛋白上样缓冲液混合后95℃加热10 min。将等量蛋白样品加入SDS-PAGE凝胶进行电泳分离,然后转移至PVDF膜。5%脱脂牛奶常温封闭1 h后,加入兔抗人NOD1单克隆抗体(1∶1 000)4℃孵育过夜。次日PBST洗膜后加入羊抗兔IgG H&L(1∶2 000),常温孵育1 h。PBST洗膜后使用Tanon 5200发光成像系统曝光并采集图像。
1.6 细胞增殖检测
将1×103个细胞种植于24孔板,进行siRNA转染。将37℃预热的EdU工作液加入24孔板中,37℃孵育2 h。去除培养液,加入1 mL多聚甲醛固定液,室温固定15 min。去除固定液,每孔用1 mL洗涤液洗涤细胞3次,每次5 min。去除洗涤液,每孔加入1 mL通透液(含0.3% Triton X-100的PBS),室温孵育10 min。去除通透液,清水洗涤后在荧光显微镜下观察。
1.7 细胞周期检测
常规消化细胞,将原培养基和细胞均收集到离心管中,1 000 g离心5 min,沉淀细胞。使用1 mL预冷PBS重悬细胞,并转移到1.5 mL离心管内。再次离心沉淀细胞,吸除上清,加入1 mL预冷70%乙醇,轻轻吹打混匀,4℃固定30 min。1 000 g离心5 min,吸除上清。每管细胞样品中加入0.5 mL碘化丙啶染色液,轻柔并充分重悬细胞沉淀, 37℃避光孵育30 min。流式细胞仪上机检测。
1.8 细胞凋亡检测
用不含EDTA的胰酶常规消化细胞,1 000 g离心5 min,弃上清,收集细胞,用PBS轻轻重悬细胞并计数。取1×105个重悬的细胞,1 000 g离心5 min,弃上清,加入195 μL Annexin V-FITC结合液轻轻重悬细胞。再加入5 μL Annexin V-FITC,轻轻混匀。加入10 μL碘化丙啶染色液,轻轻混匀。室温避光孵育15 min,流式细胞仪上机检测。
1.9 细胞划痕实验
用记号笔在6孔板背后用直尺均匀地划横线,横穿过孔,每孔至少穿过5条线。在6孔板中种植1×106个细胞,培养细胞至汇合度达到90%以上。用200 μL枪头沿着直尺,垂直于背后的横线划痕。PBS漂洗3次后,加入无血清培养基,置于37℃、5% CO2培养箱。分别于0 h和24 h后显微镜下观察并拍照。
1.10 Transwell侵袭实验
在4℃条件下将Matrigel基质胶与DMEM培养基按比例稀释(1∶4),取100 μL混合液均匀覆盖Transwell小室聚碳酸酯膜表面,37℃静置1 h,使凝胶凝固。用DMEM培养基将待测细胞制成密度为5×105/mL的细胞悬液。在24孔板内加入650 μL 含 20%FBS的DMEM培养基,将Transwell小室置于24孔板内,取100 μL细胞悬液加入Transwell小室内,置于37℃培养箱孵育48 h。取出小室,用棉签轻轻拭去小室膜上表面细胞。4%多聚甲醛固定30 min。弃去固定液,将小室浸泡于0.2%结晶紫染色液10 min,清水漂洗小室三次。待小室风干后,在高倍显微镜下选取5个视野观察细胞并计数。
1.11 Western blot检测MAPK信号通路变化
具体步骤详见1.5,其中所用一抗分别为兔抗人p-P38单克隆抗体(1∶500)、兔抗人P38单克隆抗体(1∶1 000)、兔抗人p-ERK单克隆抗体(1∶1 000)、兔抗人ERK单克隆抗体(1∶1 000)。
1.12 统计学方法
使用SPSS 22.0统计软件进行统计学分析。计量资料以均值±标准差表示,t检验比较两组间差异,P<0.05为差异有统计学意义。
2 结 果
2.1 NOD1-siRNA干扰BPCPA细胞中NOD1表达
通过转染siRNA,干扰甲状腺癌细胞BPCPA中NOD1的表达水平。qRT-PCR结果显示,siNOD1组细胞中NOD1 mRNA表达水平较siNC组细胞显著下降(0.194±0.059vs1.00±0.000,t=19.220,P<0.001,图1A),抑制率达80.63%±5.93%。Western blot结果显示,siNOD1组细胞中NOD1蛋白表达水平显著低于siNC组(0.073±0.020vs0.352±0.040,t=8.852,P<0.001,图1B),抑制率达78.03%±5.64%。

图1 转染NOD1-siRNA后NOD1在BPCPA细胞中的表达
2.2 NOD1对BPCPA细胞增殖的影响
利用EdU增殖实验检测干扰NOD1后甲状腺癌细胞BPCPA增殖能力的变化。荧光显微镜下,蓝色荧光为细胞核,绿色荧光为EdU阳性细胞。结果显示,siNOD1组中EdU阳性细胞比例(76.41%±3.75%)相较于siNC组细胞(28.75%±3.79%)显著升高(t=4.751,P<0.001,图2),说明siNOD1组中处于增殖状态的细胞多于siNC组。
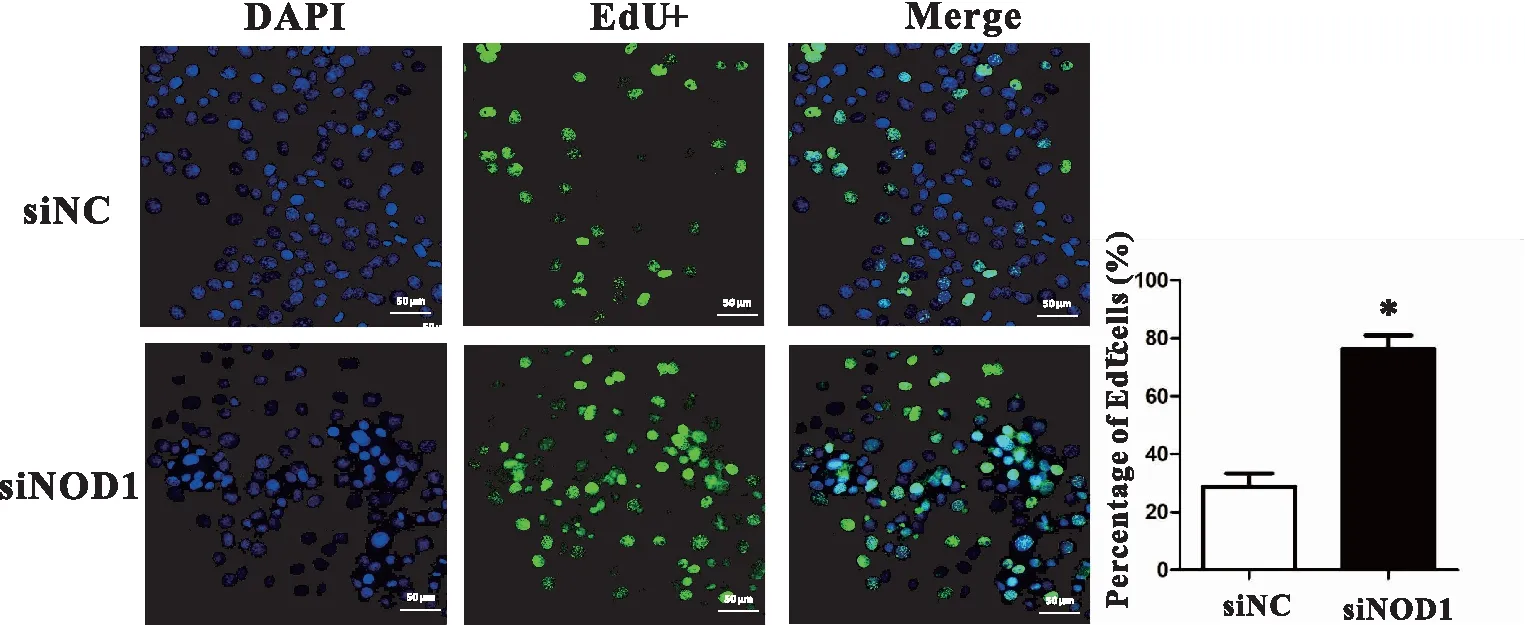
图2 NOD1表达对BPCPA细胞增殖能力的影响
2.3 NOD1对BPCPA细胞周期的调控
通过流式细胞仪探究干扰NOD1对甲状腺癌细胞BPCPA细胞周期的影响。结果显示,干扰NOD1表达后,siNOD1组较siNC组G1期细胞比例降低(55.38%±3.11%vs66.23%±4.28%),S和G2/M期细胞比例增加(36.00%±3.49%vs22.41%±2.87%,10.92%±1.08%vs6.84%±0.50%),差异具有统计学意义(G1,t=2.902,P=0.044;S,t=4.249,P=0.013;G2/M,t=4.859,P=0.010,图3)。
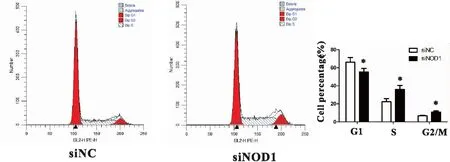
图3 NOD1表达对BPCPA细胞周期的影响
2.4 NOD1对BPCPA细胞凋亡的影响
利用流式细胞仪检测NOD1对甲状腺癌细胞BPCPA凋亡的调控作用。结果显示, siNOD1组的凋亡细胞比例(8.47%±0.61%)和siNC组细胞(8.74%±1.03%)的差异无统计学意义(t=0.322,P=0.763,图4)。

图4 干扰NOD1表达对BPCPA细胞凋亡的影响
2.5 NOD1对BPCPA细胞运动能力的作用
细胞划痕实验检测NOD1表达减少后甲状腺癌细胞BPCPA运动能力的变化。划痕24 h后,siNOD1组细胞愈合距离多于siNC组细胞[(609.33±41.11)μmvs(316.63±24.05)μm,t=8.691,P=0.001,图5]。

图5 NOD1表达对BPCPA细胞运动能力的影响
2.6 NOD1对BPCPA细胞侵袭能力的调控
Transwell侵袭实验检测干扰NOD1表达对甲状腺癌细胞BPCPA侵袭能力的影响。结果显示,siNOD1组穿过小室的数量为(545.3±24.5)个,显著多于siNC组(392.3±17.6)个,差异有统计学意义(t=5.060,P=0.007,图6)。

图6 NOD1表达对BPCPA细胞侵袭能力的影响(结晶紫染色)
2.7 NOD1对MAPK信号通路的调控作用
通过Western blot检测NOD1对MAPK信号通路的影响。结果显示,siNOD1组细胞的p-P38和p-ERK表达水平较siNC组显著升高(p-P38,1.196±0.045vs0.357±0.030,t=21.961,P<0.001;p-ERK,0.764±0.039vs0.219±0.038,t=14.265,P<0.001),P38和ERK表达水平无显著变化(P38,0.818±0.047vs0.844±0.036,t=0.623,P=0.567;ERK,0.927±0.054vs0.974±0.082,t=0.685,P=0.531,图7)。

图7 NOD1表达对MAPK信号通路的影响
3 讨 论
NOD1是一种模式识别受体,负责感知先天免疫中的致病肽。NOD1可诱导细胞内信号通路的激活,导致促炎反应和抗菌反应,因此NOD1被认为能够维持机体的免疫稳态[5]。随着研究的深入,NOD1对肿瘤的影响越来越受到重视。人透明细胞肾细胞癌肿瘤组织中NOD1的表达低于健康肾组织,而肝细胞癌细胞中NOD1相较于正常肝细胞则是高表达的[4, 6]。但Ma等[2]却发现NOD1在肝癌组织中低表达,且可通过抑制MAPK信号通路抑制肝细胞癌的增殖并增强其对化疗的敏感性。亦有报道称激活的NOD1有助于胃癌的发展[7]。以上研究表明NOD1可能在恶性肿瘤的进展中发挥双重作用。目前NOD1在甲状腺癌中的作用尚不清楚。
Ma等[2]发现NOD1通过增加P21蛋白水平,诱导细胞周期阻滞在G0/G1期,从而显著抑制了肝癌细胞的增殖。P21被认为是一种新型的肿瘤抑制因子,在G1检查点抑制细胞周期蛋白,抑制细胞周期从G1期向S期过渡[8]。本研究通过靶向NOD1的siRNA干扰甲状腺癌细胞中NOD1的表达,发现降低NOD1表达水平可促进甲状腺癌细胞的增殖。通过检测细胞周期,本研究发现干扰NOD1表达可导致细胞加速从G1期进入S期,进而增加G2/M期细胞的比例。以上结果表明干扰NOD1可通过减少G1期阻滞促进甲状腺癌细胞增殖,与已有文献结果相似。不同肿瘤中NOD1对癌细胞凋亡的影响是不一致的。Liu等[9]发现NOD1的激活促进了HPV16阳性宫颈癌细胞的凋亡。在肝癌中,抑制NOD1通路可诱导SMMC-7721和HepG2凋亡[4]。本研究发现干扰NOD1表达后甲状腺癌细胞的凋亡并未发生显著变化,NOD1对甲状腺癌细胞的凋亡可能无直接调节作用,具体机制仍需进一步研究。
肿瘤转移和复发是甲状腺癌患者预后不良的主要因素,而NOD1在调控肿瘤细胞运动和侵袭中发挥重要作用。Jiang等[3]证明NOD1的激活可能促进结肠癌细胞的黏附、迁移和转移。存在淋巴血管侵袭的宫颈癌组织中的NOD1表达高于原位癌组织,NOD1通过激活NF-κB和ERK信号通路促进鳞状宫颈癌的形成和转移[10]。此外,NOD1在卵巢肿瘤中的表达显著上调,且在转移性肿瘤组织中的表达高于非转移性肿瘤[11]。本研究发现干扰NOD1表达后,甲状腺癌细胞BPCPA的运动和侵袭能力增强,说明NOD1在甲状腺癌转移中可能发挥抑制性作用。
NOD1可通过与丝氨酸/苏氨酸蛋白激酶2(serine/threonine protein kinase 2, RIP2)相互作用,参与下游信号通路的激活[12]。RIP2是一种控制c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)和凋亡的蛋白激酶,并作为NOD1信号通路的下游中介[13]。RIP2被E3连接酶泛素化,激活抑制因子I-kappa B激酶(I-kappa B kinase,IKK)复合物和TGF-β活化激酶1(TGF-beta-activated kinase 1,TAK1)[14-15]。TAK1与IKK复合体相互作用,与P38和JNK结合,从而调控MAPK信号通路[16]。SRC是一种非受体蛋白-酪氨酸激酶,其过度激活与晚期疾病进展相关[17]。研究表明,NOD1通过抑制SRC磷酸化和SRC-MAPK轴发挥其抗肿瘤作用[2]。本研究检测了NOD1表达改变后MAPK信号通路的变化,发现干扰NOD1表达可提高p-P38和p-ERK水平,表明NOD1通过降低MAPK信号通路磷酸化抑制甲状腺癌细胞的增殖和侵袭。
综上所述,干扰NOD1表达可促进甲状腺癌细胞BPCPA的增殖、运动和侵袭,对细胞凋亡无影响,并降低MAPK信号通路磷酸化水平,表明NOD1可减少MAPK信号通路磷酸化进而抑制甲状腺癌增殖和转移。本研究为探讨NOD1在甲状腺癌中的作用提供了新视角,为甲状腺癌患者的治疗策略提供了新的理论依据。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
