体检人群血清癌胚抗原与非酒精性脂肪肝的相关性及预测价值
2022-08-01符诗陈奕奕庄秀南梁紫盈王永和
符诗,陈奕奕,庄秀南,梁紫盈,王永和
571100 海口,海口市第四人民医院 健康体检科(符诗、陈奕奕、庄秀南、梁紫盈),中医科(王永和)
脂肪肝可分为酒精性肝病和非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)[1-2],流行病学数据显示,全球成年人NAFLD的患病率在6.3%~45.0%之间[3],中国成年人NAFLD的患病率在6.0%~27.0%之间[4],且NAFLD的患病率正在逐年上升,并有低龄化趋势[5-6]。NAFLD的发病机制目前尚未完全阐明,但其发病与代谢综合征(metabolic syndrome,MS)密切相关已被大家广泛接受和认可,甚至认为NAFLD是MS的肝脏表现,是一种脂质过氧化导致的肝脏慢性炎症状态[7-8]。癌胚抗原(carcinoembryonic antigen,CEA)是一种具有人类胚胎抗原特性的酸性糖蛋白,除被用作多种恶性肿瘤早期诊断的广谱肿瘤标志物外[9],CEA还与慢性炎症有关,CEA在正常细胞中的表达可促进巨噬细胞、单核细胞中促炎性细胞因子的释放,进而促进和增强炎症反应[10]。基于CEA的促炎症反应特点和NAFLD具有的肝脏慢性炎症特点,提示CEA与NAFLD的发病可能存在关联。本研究在健康体检人群中,分析CEA与NAFLD的相关性,并探讨CEA对NAFLD的预测价值,旨在为NAFLD防控工作提供相关参考。
1 对象与方法
1.1 研究对象
选择2020年1月1日至2021年12月31日在我院参加健康体检人群作为研究对象。纳入标准:1)年龄≥18岁;2)肝脏超声检查、主要代谢指标资料完整可评价。排除标准:1)经常饮酒者(折合酒精摄入量男性:>140 g/周、女性>70 g/周);2)有病毒性肝炎、自身免疫性肝病、药物性肝病、肝脏恶性肿瘤疾病史及其他恶性肿瘤病史;3)合并其他心、肝、肾等严重疾病者。按照入排标准,最终共纳入符合条件的研究对象10 358例。
1.2 研究方法
1.2.1 一般资料收集 通过医院病案系统记录研究对象的性别、年龄、身高、体质量、腰围,计算和腰高比[(waist-to-stature ratio,WSR)=腰围(m)/身高(m)]。
1.2.2 腹部超声检查 采用PHILIPS HD-15型、日本东芝660A、荷兰飞利浦CS50实时彩色超声诊断仪(探头频率2~5MHz)对全部受检者行空腹腹部超声检查,由经过统一培训的2名从事超声诊断工作5年以上的超声副主任医师对受检者腹部进行仔细扫查,按NAFLD诊断标准记录肝脏超声各项参数值,评估脂肪变性程度,并由临床医生根据超声诊断结果结合体检者实际情况给出诊断意见。NAFLD诊断参照中华医学会肝病学分会脂肪肝和酒精性肝病学组制定的《非酒精性脂肪性肝病诊疗指南(2010年修订版)》[11]。
1.2.3 实验室指标检测 全部受检者空腹8 h以上,于次日清晨8∶00~9∶00采集空腹静脉血5 mL,统一使用全自动生化分析仪(罗氏公司,德国,P800型)测定空腹血脂、血糖及血肝功能指标,包括甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、空腹血糖(fasting plasma glucose,FPG)、糖化血红蛋白(hemoglobin A1c,HbA1c)、丙氨酸氨基转移酶(alanine aminotransferas,ALT)、门冬氨酸氨基转移酶(aspartic acid aminotransferase,AST)、血清白蛋白(albumin,ALB)、血清肌酐(creatinine,Cr),各项指标的检测方法均严格按照试剂盒说明书进行操作。
1.2.4 诊断标准 1)NAFLD的诊断,参照中华医学会肝病学分会脂肪肝和酒精性肝病学组制定的《非酒精性脂肪性肝病诊疗指南(2010年修订版)》[11],腹部超声所见满足至少2项:①肝脏近场回声弥漫性增强,回声强于肾脏;②肝内管道结构显示不清;③肝脏远场回声逐渐衰减。2)血脂、血糖指标,参照《中华医学会糖尿病学分会关于代谢综合征的建议(2013版)》[12]进行诊断,BMI≥28 kg/m2和(或)WSR≥0.5为肥胖;FPG≥5.6 mmol/L为高血糖;血清TG≥1.7 mmol/L为高TG血脂;血清TC≥5.2 mmol/L为高胆固醇血症;血清HDL-C<1.04 mmol/L为低HDL-C血症。3)肝功能指标,参照原卫生部发布的临床常用生化检验项目参考区间标准[13],ALT正常值范围:男性:9~50 U/L、女性:7~40 U/L;AST正常值范围:男性:15~40 U/L、女性:13~35 U/L;ALB正常值范围:35~51 g/L;Cr正常值范围:男性:54~106 μmoI/L、女性:44~97 μmoI/L。
1.3 统计学方法
采用SPSS 22.0统计软件进行数据进行处理和统计学分析,对正态分布或近似正态分布的计量资料采用均数±标准差进行统计描述,组间比较采用t检验,多组间比较采用单因素方差分析;非正态分布资料采用中位数和四分位间距[M(Q)]进行统计描述,组间比较采用Mann-WhitneyU秩和检验,多组间比较采用Kruskal-WallisH秩和检验;计数资料采用率或百分比(%)进行描述,组间比较采用χ2检验,NAFLD患病率随CEA的趋势分析采用趋势χ2检验;相关性采用Spearman秩相关分析,采用多因素Logistic回归模型分析CEA对NAFLD的影响;诊断预测价值评价采用ROC曲线下面积评价。检验水准α为0.05。
2 结 果
2.1 一般资料
本研究共纳入符合条件的体检者10 358例,其中男性5 451例(52.63%)、女性4 907例(47.37%);年龄18~85岁,平均年龄(56.79±9.53)岁,年龄分组:18~29岁(827例,7.98%)、30~39岁(2 229例,21.52%)、40~49岁(2 706例,26.12%)、50~59岁(2 614例,25.24%)、60~69岁(1 355例,13.08%)、70~79岁(447例,4.32%)、≥80岁(180例,1.74%)。按CEA值水平进行四分位分组,将研究对象分为Q1组(CEA<0.38 ng/mL)2 589例、Q2组(CEA: 0.38~0.86 ng/mL)2 590例、Q3组(CEA: 0.87~1.41 ng/mL)2 587例、Q4组(CEA≥1.42 ng/mL)2 592例。
2.2 健康体检人群NAFLD患病率
10 358例健康体检人群中,诊断出NAFLD患者3 396例,总体患病率为32.79%(3 396/10 358),其中,男性为38.01%(2 072/5 451),女性为26.98%(1 324/4 907)。
2.3 不同CEA水平健康体检人群的NAFLD患病率

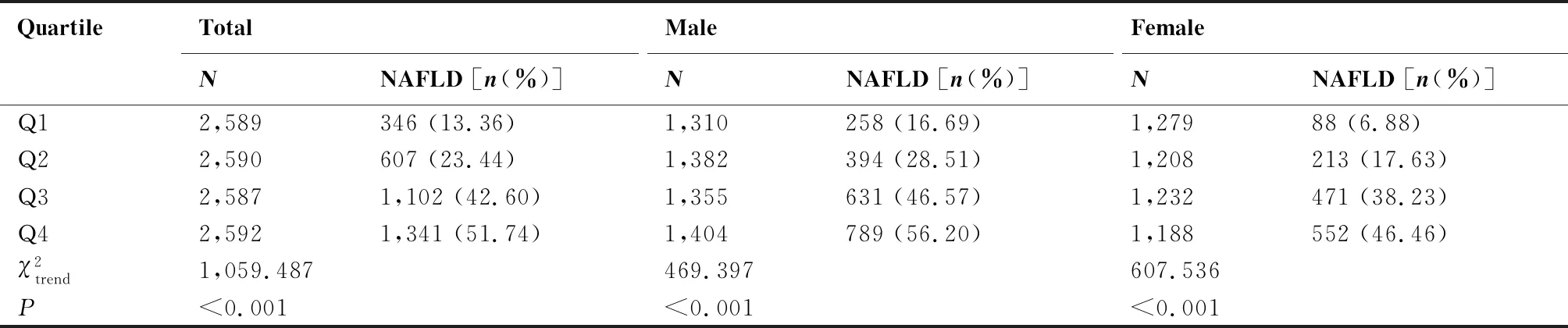
表1 不同CEA水平健康体检人群的NAFLD患病率
2.4 NAFLD与非NAFLD组主要代谢相关指标比较
结果显示,NAFLD患者的高血糖、肥胖症、高胆固醇血症、高TG血症、混合型高脂血症、低HDL-C血症、ALT异常、AST异常、白蛋白异常和血肌酐异常的比例均显著高于非NAFLD人群,NAFLD患者的CEA水平显著高于非NAFLD人群,组间差异均有统计学意义(均P<0.05)(表2)。

表2 NAFLD与非NAFLD健康体检人群主要代谢相关指标比较
2.5 CEA水平与主要代谢相关指标的相关性
采用Spearman秩相关分析显示,CEA水平与BMI、WSR、TG、TC、LDL-C、FPG、HbA1c、ALT呈正相关关系,与HDL-C呈负相关关系,有统计学意义(均P<0.05)(表3)。

表3 CEA水平与主要代谢相关指标的相关性
2.6 CEA水平对NAFLD影响的Logistic回归分析
以健康体检人群是否存在NAFLD作为因变量(NAFLD:Y=1,非NAFLD:Y=0),以CEA水平作为自变量,同时纳入经单因素分析与NAFLD相关的代谢相关指标作为协变量校正对NAFLD的影响,进行多因素Logistic回归分析,结果显示:高血糖、肥胖症、高TG血症、ALT异常、CEA水平是健康体检人群NAFLD患病的独立危险因素(均P<0.05),在调整代谢相关危险因素后,CEA仍与NAFLD独立相关(表4)。
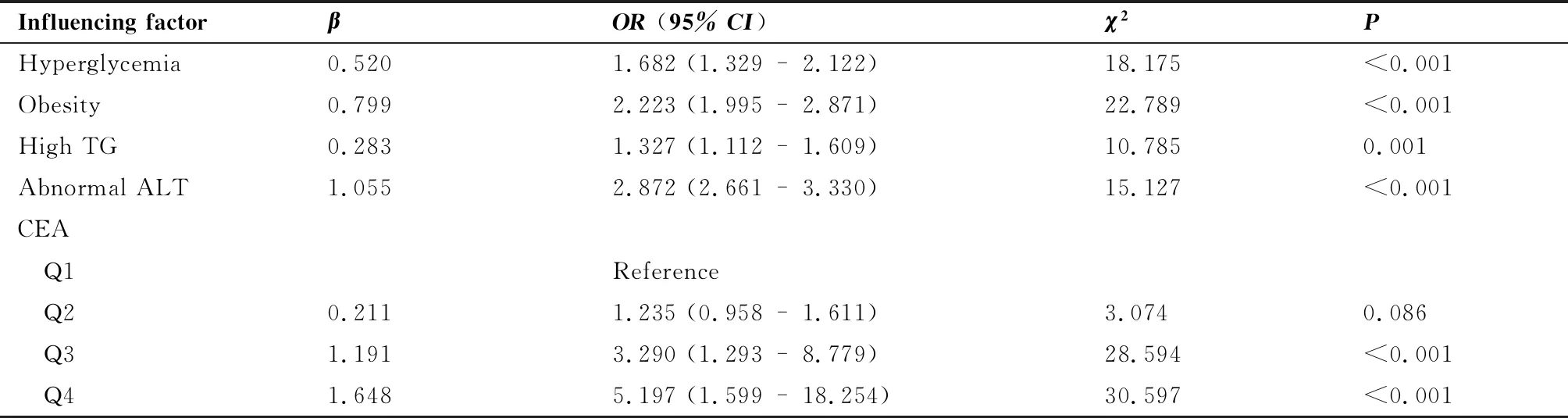
表4 NAFLD患病相关代谢影响因素的Logistic回归分析
2.7 CEA预测NAFLD的ROC曲线分析
联合CEA、高血糖、肥胖症、高TG血症、ALT异常拟合ROC曲线分析对NAFLD的预测价值,构建回归模型,回归方程Logit(P)=-11.257+0.520×高血糖+0.799×肥胖症+0.283×高TG血症+1.055×ALT异常+1.418×CEA,模型预测结果显示:AUC=0.744,95%CI:0.681~0.795,P<0.001(图1)。
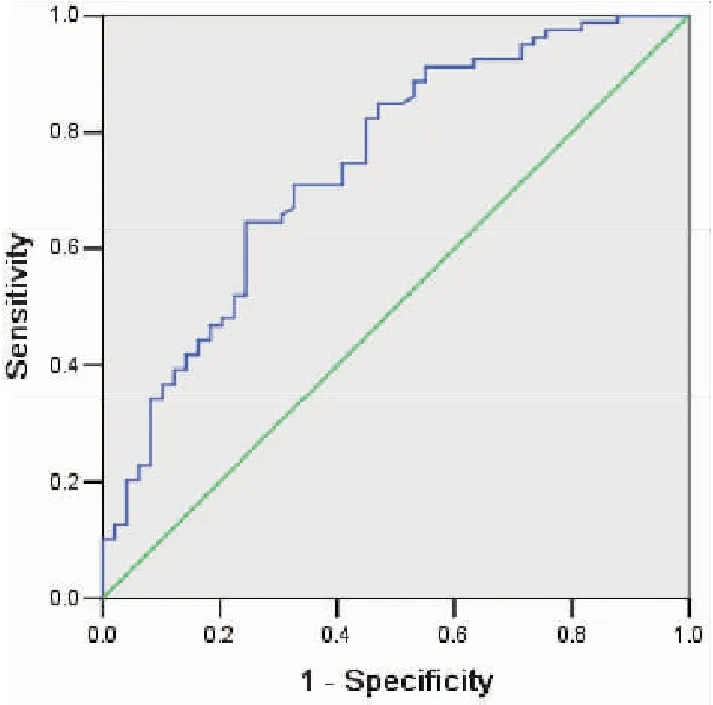
图1 CEA对NAFLD预测价值的ROC曲线
3 讨 论
NAFLD是指除酒精和其他明确的损肝因素以外所致的一种以弥漫性肝细胞大泡性脂肪病变为主要表现特征的与遗传易感性和IR密切相关的代谢应激性肝损伤综合征[14-15]。随着国人生活水平的提高、生活行为方式的改变,我国NAFLD的患病率也在不断上升,已经成为我国居民慢性肝病的首位病因以及健康体检肝脏生化指标异常的首要原因,如不及时尽早治疗极易发展为肝硬化、肝衰竭及肝癌,对我国居民的生命健康造成严重威胁[16-17]。全球成人NAFLD的总体患病率在6.3%~45.0%之间,中位水平约为25.2%[18],中国及大多数的亚洲国家NAFLD的患病率普遍>25.0%,处于全球患病率的中上水平[19]。本研究中对我院2020~2021年的全部受检者的体检资料进行分析,诊断出NAFLD患者3 396例,基于健康体检人群NAFLD的总体患病率为32.79%,与国内其他研究报道的患病率大体一致[20-21]。
流行病学数据显示[22-23],我国居民NAFLD患病率的流行趋势与肥胖症、2型糖尿病、高血脂症等的流行趋势平行,这与它们共同的危险因素脂代谢紊乱、肥胖、高血糖等MS组分的关系密切。有研究显示[24-25],腹部内脏脂肪组织的胰岛素抵抗是引起NAFLD的重要原因,并且与肝细胞的脂毒性以及肝细胞损伤有关,NAFLD会直接影响正常的肝脏功能,因此,在排除酒精性脂肪肝以及病毒性肝炎的前提下,ALT、AST和血肌酐的升高可以作为NAFLD的预测指标[26]。腰围和内脏脂肪组织的面积与NAFLD的相关性明显高于皮下脂肪,因此肥胖以及腹型肥胖是NAFLD发病的重要危险因素[27]。体内脂代谢障碍时,三酰甘油在肝脏中合成的速度就会明显超过脂蛋白释放入血的速度,导致三酰甘油升高;当脂代谢异常时,肝脏合成磷脂的量会减少,就使得HDL-C的合成相应的降低[28]。因此,一般情况下,患有肥胖、糖尿病、脂代谢紊乱、肝功能异常的患者发生NAFLD的风险更大[29]。本研究发现健康体检人群中NAFLD患者的高血糖、肥胖症、高胆固醇血症、高TG血症、混合型高脂血症、低HDL-C血症、ALT异常、AST异常、白蛋白异常和血肌酐异常的比例均明显高于非NAFLD人群。进一步的Logistic回归分析也证实高血糖、肥胖症、高TG血症、ALT异常是NAFLD的独立危险因素。
CEA是肿瘤早期筛查临床应用最为广泛的肿瘤标志物,其在多种恶性肿瘤中可以异常表达,在正常组织中其具有促进炎症反应的作用,国外有少量探索性研究发现CEA与NAFLD之间存在相关性[30]。本组健康体检人群中,随着CEA水平的升高,NAFLD的检出率也逐渐增加,经Logistic回归模型调整高血糖、肥胖症、高TG血症、ALT异常等危险因素的影响后,CEA仍然与NAFLD的发病独立相关。同时,CEA水平与BMI、WSR、TG、TC、LDL-C、FPG、HbA1c、ALT呈正相关关系,与HDL-C呈负相关关系。这都是说明CEA是一个临床极易获取、可用于NAFLD的预测与评估重要指标。本研究进一步使用CEA联合高血糖、肥胖症、高TG血症、ALT异常指标评估对NAFLD的预测价值,拟合的ROC曲线分析曲线下面积达0.744,证实CEA对NAFLD具有较好的预测价值,可以用CEA指数作为评估NAFLD发病风险的初步指标。
综上所述,NAFLD的发生和肥胖、糖脂代谢紊乱等MS及其组分关系密切,血清CEA检测简便且易获取,在反映NAFLD预测方面有很好的价值,对于健康体检人群,可使用该简便易获取的CEA值初步评估NAFLD的风险。本研究仍有一些不足:2020年国际专家委员会已经将NAFLD正式更名为代谢相关脂肪性肝病[metabolic (dysfunction) associated fatty liver disease, MAFLD],并提出了最新的诊断标准,这其中MAFLD最大的改变是删除了NAFLD中排除性诊断相关内容[31]。因本研究沿用老的NAFLD定义及诊断,在后续的相关研究中相关结果的对比方面可能受到一定限制。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
