代谢综合征大鼠主动脉Apelin及其受体的表达及意义
2022-07-31樊小容张旭升黄战军谭小青蔡博治
樊小容 张旭升※ 黄战军 谭小青 蔡博治
(1.深圳市龙岗区人民医院心内科,广东 深圳 518172;2.汕头大学医学院第一附属医院分子心脏病学实验室,广东 汕头 515000)
代谢综合征(Metabolic syndrome,MS)是一组在代谢上相互关联的危险因素的组合,是集高血压、高血糖、高尿酸、高脂血症、肥胖等多种病理状态的临床症候群。国内外多项研究发现代谢综合征患者是发生心血管疾病的高危人群[1]。其机制可能为高血压、高血脂及高血糖等因素引发血管内皮损伤,促进动脉粥样硬化形成,最终导致血管重构[2]。Apelin 是由脂肪细胞分泌的细胞因子,是血管紧张素II(AngII)1 型受体相关蛋白(APJ)的内源性配体[3]。广泛分布于多种器官及组织中,在心血管效应方面,具有降压、增强心肌收缩力、抑制动脉粥样硬化等作用。既往研究表明,冠状动脉粥样硬化患者血清中Apelin 表达明显低于正常组,且与冠状动脉病变程度呈负相关[4]。在大鼠血管钙化模型中,同样证实钙化组血清及主动脉组织中Apelin 表达较正常组减低[5]。Apelin 是否参与了MS 诱导的主动脉重构尚未有报道。本研究旨在通过观察Apelin 及其受体(APJ)在MS 大鼠血清和血管组织中的表达,初步探讨Apelin/APJ 在MS 诱导大鼠主动脉重构中的作用。
1 材料与方法
1.1 实验动物和主要试剂来源
1.1.1 实验动物16 只6~8 周雄性SD 大鼠,体质量180~200 g,由北京维通利华实验动物技术公司提供,所有动物均饲养于SPF 级动物房。
1.1.2 主要试剂高果糖饲料(60%)购自北京华阜康生物科技有限公司;Apelin Elisa 试剂盒(武汉华美);免疫组化用APJ 一抗(Novus Biologicals);二抗(上海基因科技)。
1.1.3 主要仪器血糖仪和血糖试纸(美国雅培),大鼠尾动脉无创测压仪及Beckman Coulter AU5800 生化分析仪分别由汕头大学动物实验中心及汕头大学医学院第一附属医院检验科提供。
1.2 MS 大鼠模型制备16 只雄性SD 大鼠按电脑随机数组法分为对照组和MS 组,每组8 只,对照组大鼠采用常规饲料喂养,MS 组大鼠采用高果糖饲料喂养,喂养周期为10 周。
1.3 标本收集2%戊巴比妥钠行腹腔麻醉后,酒精浸泡消毒,纵行剪开胸部皮肤及胸骨,暴露心脏,采用心脏穿刺采血法,所取血液置入含促凝剂试管中,-4 ℃低温离心,分离血浆,-80 ℃长期保存。将摘取的主动脉,剔除周围筋膜,一部分使用多聚甲醛固定并石蜡包埋,余组织采用锡箔纸包裹-80 ℃长期保存。
1.4 代谢指标检测大鼠血压采用鼠尾动脉无创测压仪测量,血糖由血糖仪测定,血清三酰甘油则由Beckman Coulter AU5800 生化仪检测。
1.5 主动脉胶原Masson 染色将大鼠胸主动脉组织依次经甲醛固定,脱水、透明、浸蜡、包埋、切片;切片厚为4 µm,经二甲苯脱蜡,梯度酒精脱水后,依次Masson复合染色液、5%磷钨酸溶液和亮绿染色液浸染;随后蒸馏水冲洗,脱水、二甲苯透明、中性树脂封片。
1.6 血清和主动脉组织Apelin含量的测定主动脉剪碎,于研钵中加入少许液氮研磨,随后放入组织匀浆器中充分匀浆,考马斯亮蓝法测定匀浆液蛋白浓度。将Apelin-Elisa 试剂盒中各液体平衡至室温,试剂或样品配制时充分混匀。按说明书步骤操作:即分设标准孔、空白孔、样品孔,每孔中加入液体100 µL,37 ℃孵育90 min。按说明书顺序依次加入生物素标记抗体工作液、辣根过氧化物酶标记亲和素工作液、底物溶液和终止溶液温育,上酶标仪以450 nm 波长测定各孔OD 值,据标准曲线换算成相应浓度值。
1.7 免疫组织化学法检测主动脉组织中APJ 的表达将制作好的厚约4 µm 主动脉组织石蜡切片,按上述方法脱蜡水化;依次用4%过氧化氢和10%BSA 血清封闭;加入一抗(APJ 一抗)4 ℃过夜;加二抗室温1 h,DAB 染色,苏木素复染,蒸馏水冲洗,脱水、二甲苯透明、中性树脂封片。
1.8 统计学方法采用SPSS 25.0 统计软件进行数据统计分析,正态分布的计量资料以()表示,2 组间比较用t检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 2 组大鼠平均动脉压、血糖和三酰甘油比较与对照组相比,MS 组中大鼠尾平均动脉压、血糖和三酰甘油水平明显增高(P<0.01),且主动脉组织胶原沉积明显,血管弹力纤维排列紊乱。见表1、图1。
表1 2 组大鼠平均动脉压、血糖和三酰甘油比较 ()

表1 2 组大鼠平均动脉压、血糖和三酰甘油比较 ()
注:(1)与对照组比较,aP<0.05;(2)1 mm Hg ≈0.133 kPa。
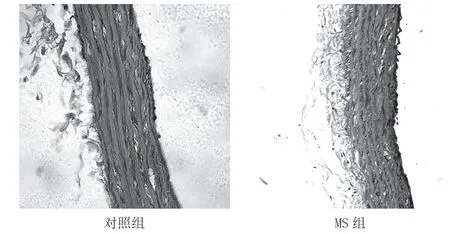
图1 大鼠主动脉Masson 染色(×40)
2.2 2 组大鼠血清和主动脉组织Apelin 表达比较与对照组比较,MS 组血清和主动脉组织中Apelin 的表达明显下调(P<0.01)。见表2。
表2 2 组大鼠血清和主动脉组织Apelin 表达比较 ()

表2 2 组大鼠血清和主动脉组织Apelin 表达比较 ()
注:与对照组比较,aP<0.05。
2.3 2 组大鼠主动脉组织中APJ 表达比较免疫组化染色显示,与对照组比较,MS 组主动脉组织APJ 表达明显低于对照组,并可见MS 组平滑肌细胞排列紊乱,管壁增厚明显。见图2。
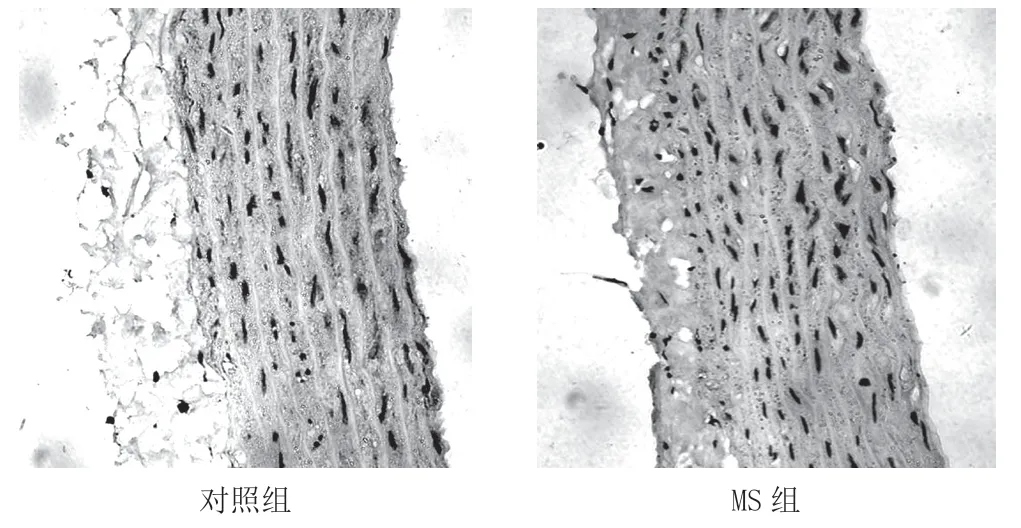
图2 主动脉组织APJ 免疫组化染色(×100)
3 讨论
随着生活方式的改变,不合理的膳食搭配和缺乏运动等导致肥胖人群增加,伴随而来的血压、尿酸和糖脂代谢异常,导致MS 的患病率明显增加,进一步增加不良心血管事件的发生率,严重影响人类的寿命及生命质量。研究发现MS 大鼠在病理上表现为血管内皮功能受损,血管细胞及中膜弹力纤维排列紊乱,平滑肌细胞增殖明显。血管活性肽、脂肪因子、氧化应激及炎症反应等[6-9]参与了这个病理过程。寻找新的脂肪因子将更好地阐明MS 诱导主动脉重构的相关分子机制,为临床的防治提供新策略。
本研究结果显示,Apelin/APJ 系统是心血管疾病的保护因子,这与既往多项研究结果相符。黄扬等[10]研究结果表明:老年高血压病组血清中Apelin 的表达较同龄人正常血压组低,且与血压变异性呈负相关,提示Apelin是高血压病患者的保护因子,其机制为通过NOS/NO途径拮抗AngII 的升压作用。体外注射Apelin-13 可显著提高小鼠体内的高密度脂蛋白含量,降低三酰甘油含量[11]。李梦[12]将32 只高脂饮食GK 大鼠和8 只Wistar大鼠随机分为5 组,高脂饮食组,二甲双胍、阿托伐他汀钙、Apelin 及Wistar 组。药物干预4 周后,较之于Wistar 大鼠,高脂饮食组大鼠的主动脉内皮细胞肿胀,胶原纤维增生;TG、LDL-C、ET-1 和iNOS 增高;HDL-C、NO 和cNOS 水平降低。Apelin 组大鼠的TG、LDL-C、ET-1和iNOS 水平下降;HDL-C、NO 和cNOS 升高。
本实验观察到高果糖饲养可成功建立MS 模型,表现为大鼠血压升高、糖脂代谢异常;MS 组主动脉发生重构,出现血管内膜、中膜、外膜胶原明显增生,血管细胞排列紊乱,管壁厚度明显增加;与本课题组前期实验结果一致[13]。MS 大鼠血清、主动脉组织Apelin 及APJ 表达明显下调,与血管重构程度呈负相关,与既往相关研究结果相符[14]。但也有研究表明:Apelin 在代谢综合征人群中的血清表达浓度高于正常[15,16]。故仍需大规模随机临床进一步观察。目前认为Apelin 抑制动脉粥样硬化的机制包括:改善内皮功能、抑制动脉平滑肌细胞增殖及迁移,抑制氧化应激、肿瘤坏死因子-α(TNF-α)和白介素1β 的表达)[17]、细胞凋亡及自噬等;涉及JNK/NF-κB 和APJ/pI3K/Akt 等信号通路[18-21]。本研究不足之处未行机制的研究,将在后续的实验中进一步研究。
