磁共振钆对比剂增强前后对APT信号影响的研究
2022-07-30杨倩刘周邹丽艳罗虹虹吴卫星姬红肖嘉辉罗德红
杨倩,刘周,邹丽艳,罗虹虹,吴卫星,姬红,肖嘉辉,罗德红,4*
作为一种新兴的化学交换饱和转移(chemical exchange saturation transfer,CEST)MRI 方法,酰胺质子转移(amide proton transfer,APT)成像可以间接量化组织中的内源性蛋白质和多肽的浓度。近年来,APT 成像在许多临床领域得到了广泛应用,尤其是在肿瘤领域,包括区分低级别和高级别胶质瘤[1-2],评估胶质瘤患者的治疗效果[3],区分感染性病变和肿瘤性病变[4],以及评估直肠癌的分级[5]和疗效评价等[6-7],区分唾液腺良恶性肿瘤[8-9]和区分乳腺恶性肿瘤和正常乳腺组织[10-11]等。
随着APT成像在临床上的广泛应用,随之而来的问题是增强后采集APT 图像是否会影响APT 效应,前期已有少量研究进行了探索[12-13],Tee 等[12]对四名颈动脉狭窄患者Gd对比剂增强前后脑白质和脑灰质APT值的变化进行了相关研究,该研究显示25%患者对比剂增强以后,APT值明显降低。此外,Torrealdea等[13]对7 名患者Gd 对比剂增强前后脑白质、肿瘤增强区域和肿瘤无增强区域APT值的变化进行了相关研究,研究结果显示对比剂增强前后,APT 值没有显著变化。由于脑肿瘤患者为了评估疾病是否进展需要进行多次磁共振增强扫描,而APT扫描对于评估病灶内部是否含有大量蛋白质具有较高价值,但是APT扫描是否应该在增强扫描后进行,即对比剂是否会对APT信号产生影响,暂无明确结论,且磁化传递比不对称分析依赖于T1[14,15],因此本研究通过体外模体实验和体内试验证实磁共振Gd 对比剂对APT 信号造成的影响。
1 材料与方法
1.1 体外实验
24 个编号为1~24 的试管首先装入10 mL 的新鲜鸡蛋清[16],在编号2~24 试管依次加入不同剂量的Gd 对比剂,具体每个试管加入的试剂量见图1,通过涡旋震荡仪将鸡蛋清和对比剂充分混合,从而形成体外实验的体模。将24个装好鸡蛋清和对比剂的试管放入试管架,将试管架放入留置针盒中,最后将留置针盒放入磁共振头颈线圈内部,进行磁共振扫描。为了测试数据的可重复性,连续扫描体模3次。
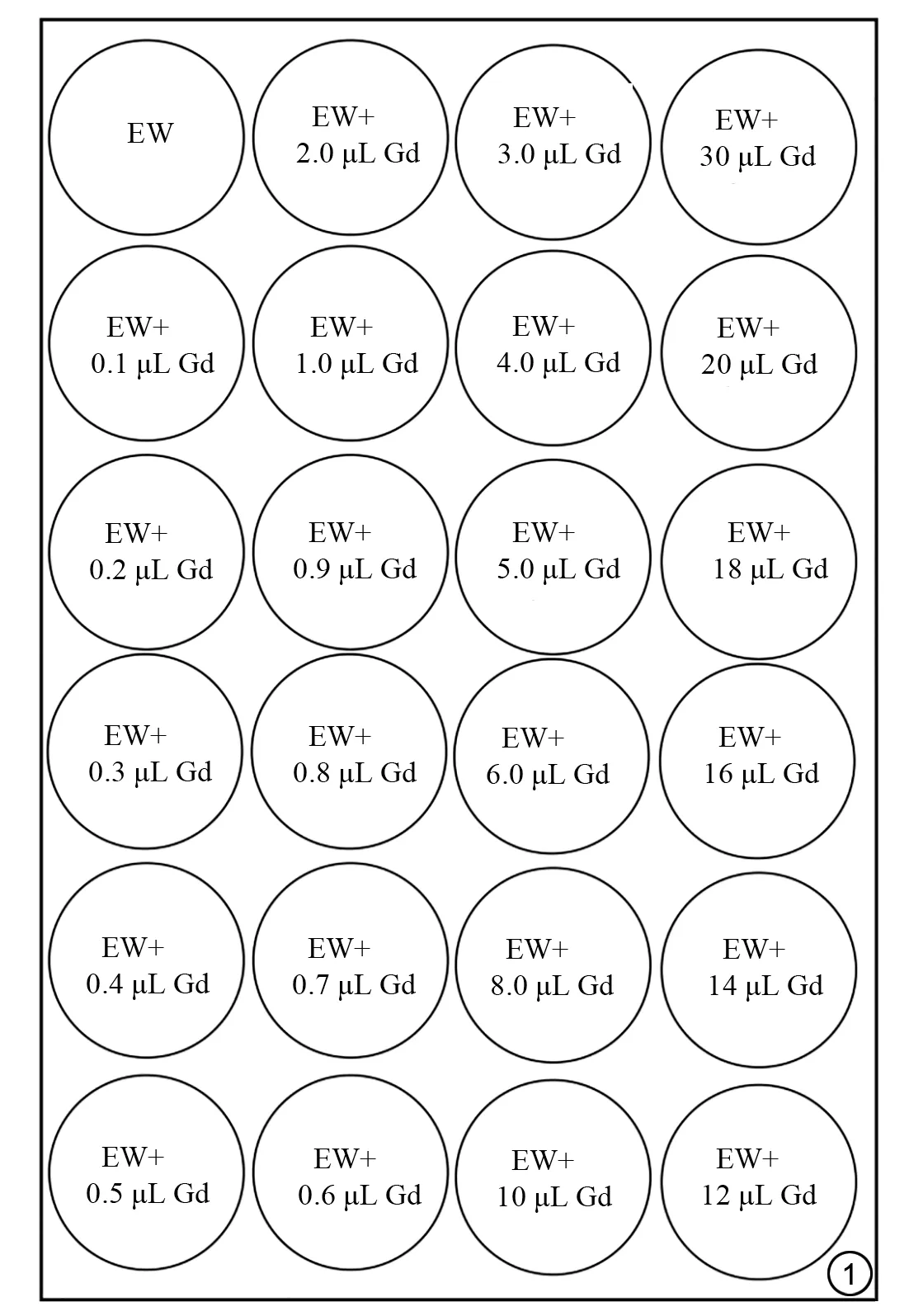
图1 体模设计图。EW为鸡蛋清,Gd为钆对比剂。Fig. 1 Design of phantom. EW is egg white, and Gd is gadolinium contrast agents contrast agent.
模体的扫描是采用GE 3.0 T 超导MRI 扫描仪(Discovery MR 750W)和24 通道头颈联合线圈,将装有试管的留置针盒放入线圈内部,APT 序列扫描技术为SSFSE (single-shot fast spin echo),预饱和脉冲类型为连续波,扫描参数为:TR 6500 ms,TE 25.56~28.67 ms,层厚4 mm,层数1,FOV 22 cm×22 cm,矩阵128×128,B1场强度2.0 μT,饱和时间2 s,扫描频率为0,±0.5,±1.0,±1.5,±2.0,±2.5,±3.0,±3.5,±4.5,±5.0,±5.5,±6.0,±6.5,±7.0 ppm,后处理的校正方式为WASSR (water saturation shift referencing),重建算法为Z 谱中水中心频率两侧±3.5 ppm处磁化传递率(magnetization transfer ratio,MTR)之差来计算非对称性磁化传递率参数。
1.2 在体试验
本次前瞻性研究通过了中国医学科学院肿瘤医院深圳医院伦理审查委员会的审批(审批文号:KYKT2021-95-1),本研究于2021年4月至2022年4月在中国医学科学院肿瘤医院深圳医院放射诊断科进行,研究过程得到了患者的知情同意,并签署了知情同意书。19 名脑肿瘤患者被纳入研究,女∶男=10∶9,年龄(53.95±8.28)岁。临床序列扫描结束以后扫描一次APT 序列和T1 map (TI=200,500,800,1100,1400,2500)序列,平扫结束后经肘静脉推注对比剂钆特酸葡胺(Gd-DOPA,Guerbet,法国),剂量0.2 mL/kg,注射速率为2.5 mL/s,对比剂注射以后以相同速率20 mL生理盐水进行冲洗高压注射器,注射对比剂9 min以后扫描APT 序列和T1 map 序列。APT 序列的扫描技术和扫描参数与模体基本一致,不同的是B1场强度:1.0 μT,饱和时间:1 s。图像经过影像医师评估,确保没有明显运动伪影。
1.3 图像分析
APT值的计算:在3.5 ppm处计算磁化传递率非对称性分析(asymmetric magnetization transfer ratio,MTRasym),APT=MTR (3.5 ppm)-MTR (-3.5 ppm),MTR=1-M(Δω)/M0,M(Δω)表示在ω ppm处用饱和射频脉冲获得的信号强度,M0 为不施加饱和脉冲的信号强度。在没有施加饱和脉冲的图像上使用开源软件ITK-SNAP进行ROI 勾画,对于体外实验的试管模型,每个试管的ROI 固定范围为5 mm×5 mm。对于体内试验所扫描的患者T1 map 图像上勾画ROI,ROI 包括整个脑组织,水肿区域(若有),脑白质,脑灰质,病灶实质。使用MATLAB软件分析并记录每个ROI的APT值,比较增强前后不同组织的APT 值差异。由于灰质和白质在T1 map 上的对比度较差,勾画整个区域存在挑战,而本研究目的是比较增强前后灰白质的APT值差异,只要确保勾画的区域分别是灰质和白质即可。因此,我们仅选择了病灶同层面最明显的脑灰质和白质。
1.4 统计学分析
采用SPSS 26.0 (IBM,USA)软件进行分析,组内相关系数(intraclass correlation efficient,ICC)被用来检验三次模体扫描的一致性,ICC值小于0.4认为诊断试验的可重复性较差;ICC值大于0.75则认为诊断试验的可重复性好。余弦相似度被用来分析增强前后患者APT图像整体的相似性,余弦相似度值越接近1,图像相似度越高。配对样本t检验被用来分析每个患者整个脑组织、肿瘤区域、水肿区域、脑灰质以及脑白质每个ROI 增强前后APT 值的差异,P<0.05表示差异有统计学意义。
2 结果
2.1 体外模体实验结果
在对试管模型的3 次连续APT 扫描中,三次扫描结果的APT 值具有极好的一致性(图2),ICC 值为0.998 (95%CI:0.977~0.999)。扫描数据的Z 谱图显示,模体数据在3.5 ppm 处呈现了明显的APT 效应,如图3所示。
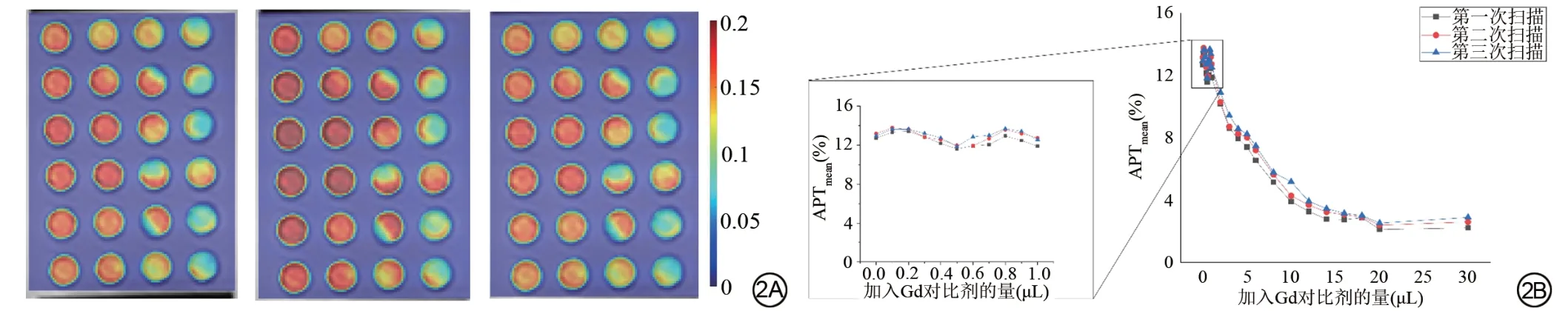
图2 不同剂量钆(Gd)对比剂对酰胺质子转移(amide proton transfer,APT)成像的影响。2A为加入不同剂量Gd对比剂的鸡蛋清模体三次扫描的APT图;2B为APT值随不同Gd对比剂剂量变化的定量展示图,黑色方框为第一次扫描数据,红色圆圈为第二次扫描数据,蓝色三角形为第三次扫描数据。Fig.2 Effects of different doses of Gd on amide proton transfer(APT).2A shows the APT images of three scans of egg white phantoms with different doses of Gd;2B shows the quantitative display of APT values with different Gd doses. The black box, red circle and blue triangle indicate the data of the first scan, the second and third scan,respectively.

图3 加入不同剂量Gd 对比剂的鸡蛋清模体的Z-spectrum 谱图(3A)与asym图(3B).Fig. 3 The Z-spectrum spectrum (3A) and asym image (3B) of egg white phantoms with different doses of Gd.
随着MRI对比剂浓度的增加,体模中各模型的平均APT值呈下降趋势(图2、3)。当加入的Gd剂量小于1 μL时,APT值的平均值保持相对稳定,并在12%左右波动(11.61%~13.42%)。但当Gd 添加剂量超过1 μL 时,蛋清的APT 值显著降低。直到剂量达到20 μL 左右,APT值的下降率逐渐稳定在2%左右(1.88%~2.13%)。
2.2 体内试验
2.2.1 纳入患者的基本信息
本研究共纳入19 名脑肿瘤患者,其中男9 名,年龄(55.78±8.12)岁,女10 名,年龄(52.30±8.50)岁,疾病类型包括9 名脑转移瘤患者,4 名脑膜瘤患者,2 名表皮样囊肿患者,1 名胶质瘤患者,1 名血管源性肿瘤患者,1 名听神经瘤患者和1 名脑转移瘤术后复发患者。
2.2.2 全脑增强前后APT信号变化
对于整个脑组织,注射对比剂增强以后,T1 map图像具有较高的图像相似度(余弦相似度值为0.72~0.99),且T1 值显著降低(P<0.05)。而增强以后APT图像的相似度低于T1 map图像(余弦相似度值为0.01~0.93),但APT 值增强前后差异无统计学意义(P=0.18) (表1)。

表1 对比剂增强前后全脑组织、脑灰质、脑白质以及肿瘤病灶APT值和T1值比较Tab.1 comparison of APT value and T1 value of whole brain tissue,gray matter,white matter and tumour before and after contrast agent enhancement
2.2.3 脑灰质和脑白质增强前后APT信号变化
对于脑灰质而言,对比剂增强前后,APT 值和T1 值差异均无统计学意义(P>0.05),对于脑白质而言,对比剂增强以后,APT 值显著升高(P=0.03),T1 值没有显著变化(P=0.80) (表1)。图4为1名53岁脑肿瘤患者的脑灰质和脑白质增强前后APT 和T1 map 的直方图。

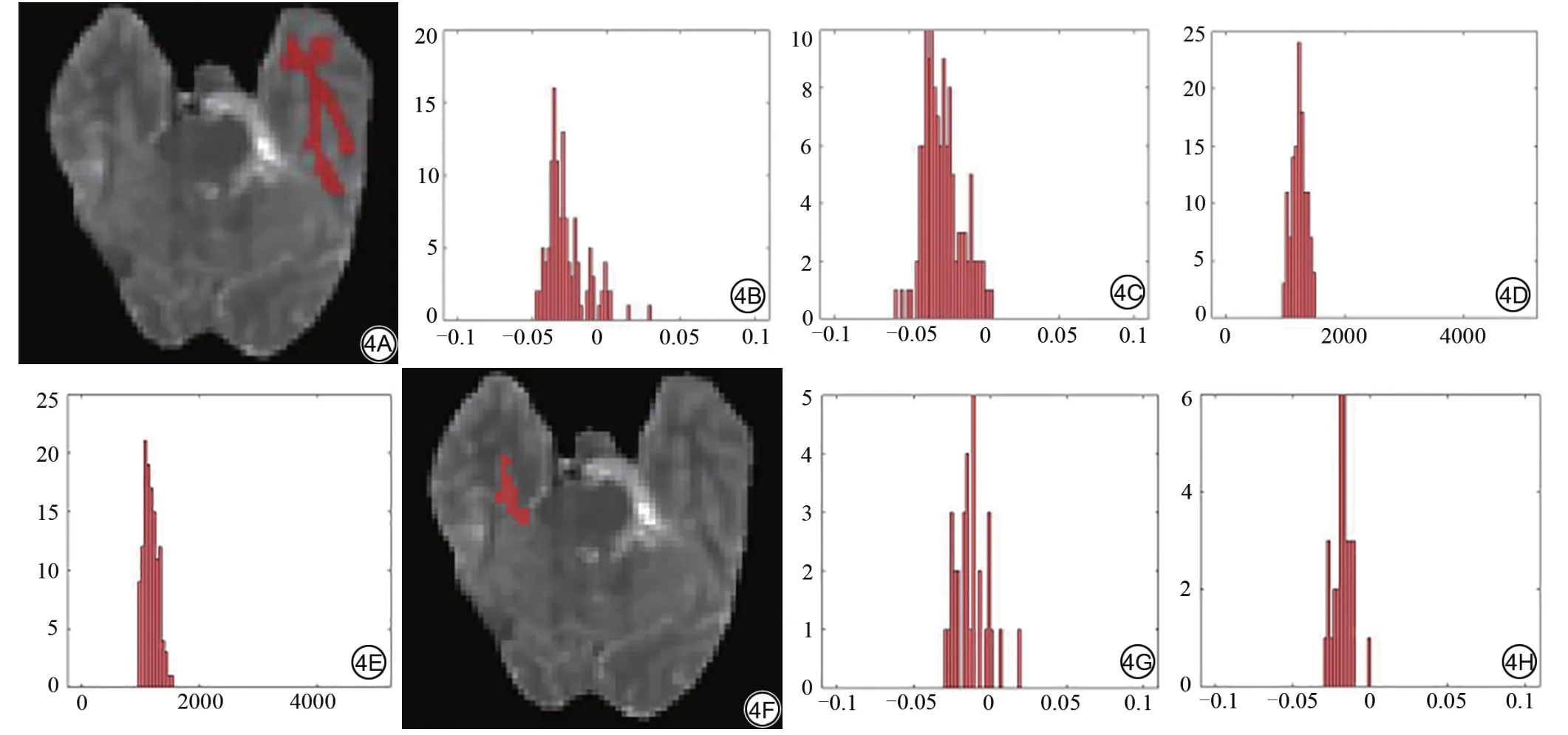
图4 女,53岁,表皮样囊肿。脑白质和脑灰质增强前后酰胺质子转移(APT)和T1 map 的直方图。4A 为脑白质感兴趣区(ROI)勾画图,4B、4C 分别为脑白质增强前后APT 的直方图,4D、4E 分别为脑白质增强前后T1map 的直方图;4F 为脑灰质ROI 勾画图,4G、4H 分别为脑灰质增强前后APT 的直方图,4I、4J分别为脑灰质增强前后T1 map的直方图。Fig. 4 Histograms of APT and T1 values of white matter and gray matter before and after enhancement for a 53-year-old female patient with epidermoid cyst.ROI in white matter (4A); histograms of APT values in white matter btefore (4B) and after enhancement (4C); histograms of T1 values in white matter before (4D) and after(4E) enhancement; ROI in gray matter (4F); histograms of APT values in gray matter before(4G)and after(4H)enhancement;histograms of T1 values in gray matter before(4I)and after(4J)enhancement.
2.2.4 tumor增强前后APT信号变化
对于肿瘤病灶而言,注射对比剂增强以后,T1 值显著降低(P<0.05)。但APT 值增强前后差异无统计学意义(P=0.08),具体见表1。图5 为1 名61 岁的脑转移瘤患者肿瘤区域增强前后的APT和T1 map图。
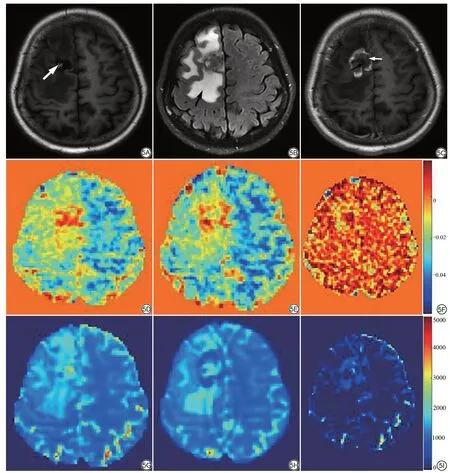
图5 女,61 岁,脑转移瘤。酰胺质子转移(APT)和T1 图像增强前后的对比。5A 为T1WI图像,箭头所指为出血区域;5B 为T2WI图像,箭头所指为水肿区域;5C为T1WI增强图像,白箭头为强化明显区域,黑箭头为强化不明显区域;5D和5E分别为增强前后的APT图,5F为增强前后相减的图像;5G和5H分别为增强前后的T1 map图;5I为增强前后相减的图像。Fig. 5 Images of a 61-year-old female patient with brain metastases, including T1-weighted image with the arrow pointing the hemorrhage (5A), T2-weighted image with the arrow pointing the edema(5B),T1-weighted enhanced image with the arrow pointing region with overt enhancement(5C),APT images before(5D)and after (5E) enhancement and their subtracted image (5F), respectively, T1 maps before (5G) and after (5H) enhancement and their subtracted image (5I),respectively.
由于本次纳入的19 名病例,有多名患者增强以后病灶不强化,包括脑转移瘤放疗以后的病灶以及表皮样囊肿等,因此本研究将对强化病灶和非强化病灶进行分别研究,其中包括10 个强化病灶和9 个非强化病灶,研究结果显示,强化病灶对比剂增强以后APT 值显著升高(P<0.05),非强化病灶对比剂增强以后APT值没有变化(P=0.53),具体结果见表2。

表2 对比剂增强前后不同肿瘤病灶APT值比较Tab.2 comparison of APT value oft different tumors before and after contrast agent enhancement
19名患者中有3名患者的病灶含有水肿部分,水肿区域增强前后T1 值和APT 值变化有所差异,T1 值呈现不同的变化,其中一个升高,两个降低,但APT值均降低。
3 讨论
APT 成像[17]是CEST 技术的一种,CEST 技术[18]与磁化传递技术[19]密切相关,临床上应用的磁化传递成像是非特异性饱和的磁化传递技术[20]。APT 成像技术应用最为广泛的是脑部,包括脑梗死[21-22]、脑肿瘤[23-24]、神经性疾病[25]等各个方面。尤其对于脑肿瘤患者而言,为了评估肿瘤是否进展,通常需要进行Gd对比剂增强扫描,但是Gd 对比剂是否会对APT 信号造成影响,尚需进一步研究进行证实。因此,本研究创新性地通过体外实验和体内试验分析了Gd对比剂对APT 信号的影响,体外实验对加入Gd 对比剂的鸡蛋清模体进行APT 扫描,结果显示随着Gd 对比剂剂量的增加,APT 信号呈现下降的趋势。体内试验结果显示,对于脑白质和肿瘤强化病灶,Gd 对比剂会对APT 信号造成一定的影响,因此在临床应用中,应该在注射对比剂前进行APT序列的扫描,防止对比剂对APT信号造成影响。
3.1 体外实验对比剂增强前后APT信号的变化
本研究的体外实验研究结果显示,随着Gd 对比剂浓度的升高,APT 信号呈现下降的趋势。我们知道,磁化传递比不对称分析是与T1 效应有关的[26],与T2 效应关系不大[12]。注射钆对比剂以后会缩短组织的T1时间,因此在注射Gd对比剂以后进行APT扫描,有可能会对APT信号造成一定的影响。
3.2 对比剂增强前后脑白质和脑灰质APT 信号的变化
本研究对19名有脑部疾病的患者对比剂增强前后均进行了APT扫描,结果显示对于脑灰质而言,对比剂增强前后APT值差异无统计学意义,但是对于脑白质而言,对比剂增强以后APT值显著升高。Torrealdea等[13]发现脑白质对比剂增强前后APT值差异没有统计学意义,其结果与本研究结果不一致。Tee 等[12]也进行了与本研究相类似的研究,其研究结果显示25%患者的脑白质和脑灰质对比剂增强以后,APT 值明显降低,但本研究结果显示对比剂增强以后脑白质APT 值上升,脑灰质没有显著改变。
3.3 对比剂增强前后脑肿瘤区域APT信号的变化
本研究结果显示对于强化肿瘤病灶而言,对比剂增强前后APT值显著升高,但对于非强化肿瘤病灶而言,对比剂增强前后APT值没有显著的变化。肿瘤强化病灶区域有更多的蛋白质种类,且更高的蛋白质表达水平[27-28],因此受到Gd对比剂的影响更大,APT值变化更明显。Su 等[29]对17 名脑肿瘤患者和17 名年龄性别相当的志愿者进行APT扫描和磁共振波谱(magnetic resonance spectroscopy,MRS)扫描,研究结果显示对于肿瘤患者,APT值与MRS的胆碱(choline, Cho)和N-乙酰天门冬氨酸(N-acetyl aspartic acid, NAA)呈显著相关,而健康志愿者的APT值与MRS的Cho和NAA没有相关性,因此APT 可以为肿瘤引起的分子和结构变化提供补充信息。此外,一项纳入23 篇研究报道的Meta分析结果显示,APT 成像对于区分高级别和低级别胶质瘤方面存在较大的潜力[30]。不同级别胶质瘤强化程度不一致,可以预期的是如果在Gd增强后进行APT扫描,对比剂也可能会对APT信号产生不同程度的影响。肿瘤周围的脑水肿区域,含水量比较高,增强以后没有明显强化,但本研究有3名患者的病灶含有水肿区域,研究结果显示,3 名患者增强以后水肿区域的APT值均降低,可能是由于水肿区域与肿瘤核心区域的界限不是特别明确有关。Yang 等[31]对脑转移瘤患者、胶质瘤患者以及正常检查者的病灶实质、水肿区域以及非病灶区域的APT值进行了相关研究,研究结果显示对于脑转移患者而言,肿瘤实质和水肿区域APT值有显著差异,但水肿区域与非病灶区域APT没有显著差异,但是对于胶质瘤患者,肿瘤实质与水肿区域、肿瘤实质与非病灶区域以及水肿区域和非病灶区域的APT值均有显著差异,可见不同种类的肿瘤由于其代谢差异,APT值会有所差异,本研究没有对肿瘤病灶进行详细的分类,仅按照是否强化进行了分组,结果显示强化肿瘤病灶APT值有显著变化,后续可按照不同种类的肿瘤进行分类,分析对比剂是否会对APT值产生影响。
本研究的体外实验表明,加入对比剂以后APT值显著降低,但体内试验表明,除了脑白质和肿瘤明显强化的区域对比剂增强以后APT值显著升高外,全脑组织、脑灰质以及肿瘤非强化区域对比剂增强以后APT 值差异无统计学意义,主要原因可能是体外实验全部为鸡蛋清,含有大量的酰胺质子,APT 信号较高,其值在12%左右,因此注射钆对比剂以后会缩短组织的T1 时间,导致APT 值也相应降低。但是脑组织内部成分复杂,酰胺质子含量有限,APT 信号较低,其值在0 左右,因此对于全脑组织而言,对比剂增强以后并不会对APT 信号造成影响。虽然脑白质和肿瘤强化区域,增强以后APT 值显著升高,但其值亦在0 附近波动,APT 值的大小受环境以及pH 影响较大,因此为了避免对比剂对APT 信号造成影响,APT 扫描最好在增强扫描前进行。
3.4 局限性
本研究存在一定的局限性。一方面,在体外实验中,模体的图像出现了不均匀性的现象,当加入的Gd 对比剂越多时图像不均匀性的现象越明显,可能的原因是Gd 对比剂在鸡蛋清中未充分混匀,或者后面放置后有沉淀。由于鸡蛋清是半固体,尽管每个试管我们都用涡旋震荡仪将蛋清和对比剂进行充分混合,但可能充分混匀存在一定困难。但是发现连续3 次扫描图像的不均匀性都是一样的,ICC>0.99,说明图像很稳定,且连续3次扫描均证明随着MRI对比剂浓度的增加,各管体模的平均APT值呈下降趋势,说明不影响整体结果。另一方面,体内试验中,仅纳入19名脑肿瘤患者进行扫描和统计分析,相对而言样本量较少,且纳入的19名患者,有9名患者肿瘤病灶不强化,因此后续可纳入更多的强化病灶进行分析。此外,本次研究纳入的病例包含7种不同的疾病类型,肿瘤的异质性也是本次研究的局限性之一。
综上所述,本次研究通过体外实验和体内试验均证实,对比剂增强以后,APT 信号会受到不同程度的影响,因此在进行临床扫描方案设计时,为避免对比剂对APT 信号的影响,应该在注射对比剂前进行APT扫描。
作者利益冲突声明:全体作者均声明无利益冲突。