脑卒中后运动功能障碍与连接半球间同位脑区的胼胝体结构损伤相关
2022-07-30郭苗徐国军余秋蓉王鹤玮尹大志孙莉敏宁瑞鹏刘凡范明霞
郭苗,徐国军,余秋蓉,王鹤玮,尹大志,孙莉敏,宁瑞鹏,刘凡,范明霞*
单侧皮质下病变导致脑卒中出现对侧肢体偏瘫,尤其是上肢及手的运动功能障碍会严重影响患者的生活自理水平[1]。越来越多的研究证实单侧皮质下脑卒中运动功能的恢复与受损半球功能活动的正常化和跨半球活动的重新平衡有关[2-3]。因此,了解脑卒中偏瘫患者半球间功能和结构变化与临床运动行为学改变的关系,将有助于更深入理解脑卒中半球间失衡的作用机理,以期更好地指导临床中康复治疗工作。
神经影像学早期研究发现,左右大脑半球相同起源的神经元具有极其稳定的自发活动同步性[4]。Stark等[5]在大脑中选取112 个区域(左右对称,各56个),证实了双侧大脑半球间同位区域功能连接较其他连接模式(双侧半球间异位脑区、健侧半球内及患侧半球内)连接强度更大。本课题组曾采用体素镜像同伦功能连接(voxel-mirrored homotopic connectivity,VMHC)研究初步发现,单侧皮质下脑卒中在全脑水平上存在着广泛的同位脑区功能连接降低,涉及双侧感觉运动区、前额叶、颞叶、顶叶、小脑等区域[6]。有研究也揭示脑卒中偏瘫患者的感觉运动网络内的同位脑区功能连接与上肢运动功能最为相关[3,7]。近期有研究进一步发现,脑卒中患者双侧初级运动皮质(primary motor cortex,M1)的功能连接和其经胼胝体的M1-M1 神经纤维束的微结构变化均与上肢运动功能障碍的严重程度有关[8-9]。运动功能恢复良好的脑卒中患者的病灶侧M1 至病灶对侧M1 的有效功能连接也依赖于双侧M1 潜在解剖结构连接的完整性[10]。不过,现有研究只关注了某一脑区(例如M1)经胼胝体神经纤维束微结构的改变。对于其他更多半球间同位脑区的功能活动是否受到与其对应相连的经胼胝体纤维束微结构损伤的影响,及其与运动行为学功能损伤的关系均不清楚。
神经科学研究认为,脑结构是功能连接的基础,尤其是当存在结构连接时,结构完整性与功能连接的强度具有高度一致性[11]。脑卒中后半球间功能连接所对应的结构基础会发生什么变化?这是本研究感兴趣并想要回答的问题。本研究尝试基于高分辨经胼胝体纤维束模板(trancallosal tract template,TCATT),对比分析一组单侧皮质下脑卒中和健康对照组的半球间连通大脑皮质多个同位脑区的经胼胝体纤维束微结构改变。本研究推测:(1)与脑卒中导致半球间多个同位脑区功能连接异常相似,该组患者多个同位皮质脑区经胼胝体纤维束微结构连接可能也会出现普遍异常改变;(2)皮质下脑卒中患者的胼胝体异常改变可能源于运动通路上皮质脊髓束损伤所导致的继发性变性损伤;(3)除了双侧M1 经胼胝体的解剖连接微结构变化与运动行为学表现具有相关性之外,其他同位脑区可能也具有类似关系。本研究拟揭示单侧卒中病变导致半球间同位脑区功能连接失衡的结构基础变化及其与运动功能障碍的关系,将有助于更加全面理解脑卒中偏瘫患者半球间结构变化在脑重塑的全局整合效应中的作用。
1 材料与方法
1.1 受试者信息
本研究为一项前瞻性、探索性的横断面观察研究。卒中组招募于2020 年7 月至2022 年1 月间在复旦大学附属华山医院康复科治疗的皮质下脑卒中患者。纳入标准:(1)首次发病皮质下单侧脑梗死或脑出血,病灶主要位于内囊或基底节区;(2)发病时间≥3 个月;(3)存在上肢或手功能运动障碍;(4)所有患者无明显认知功能障碍,所有患者认知功能量表评测均≥27 分;(5)年龄在35~70 岁之间;(6)爱丁堡利手问卷确认为右利手。排除标准:(1) MRI 扫描禁忌证或幽闭恐惧症;(2)意识不清、癫痫、失语;(3)酒精、药物滥用或神经精神病史等;(4)参与任何实验性康复或药物研究。另外,筛选入组43 名年龄相匹配的右利手健康受试者。纳入标准包括:(1)年龄在40~70 岁之间;(2)头颅常规MRI 扫描未见异常病灶;(3)无明显认知功能障碍。排除标准同卒中组。
本实验研究经过复旦大学附属华山医院和华东师范大学伦理委员会批准(批准文号:HR 393-2020),所有受试者在入组本课题研究时以及做磁共振扫描前均已签署知情同意书。华山医院康复医学科的一名医生在MRI 扫描当天评定脑卒中患者上肢运动功能评分(Fugl-Meyer Assessment of Upper Extremity,FM-UE)。Fugl-Meyer 评估表是脑卒中临床和科研疗效评判中应用最为广泛的运动学评估方法。其中上肢运动包含33 个评估项目,上肢运动功能评分总分为66 分,各单项评分全部完成为2 分,部分完成为1 分,不能完成为0 分。医生根据受试者最后的评分对其运动障碍严重程度进行评定[12]。
1.2 磁共振数据采集
本研究中磁共振数据采集于上海市磁共振重点实验室(华东师范大学)的西门子Trio 3.0 T 磁共振成像扫描仪。数据采集前为受试者戴上一次性防噪声耳塞。为了固定头部并减少头动,用海绵垫固定受试者头部,同时告知受试者在影像数据采集过程中,尽量身体放松并保持头部静止不动。
所采集的磁共振数据包括:高分辨T1WI结构像,常规T2WI结构像,弥散张量成像。具体扫描序列和参数如下:(1) T1WI采用快速梯度回波序列,进行矢状位三维成像,TR 2530 ms,TE 2.34 ms,FOV 240 mm×240 mm,采集层数192 层,层厚1 mm,层间距0.5 mm,翻转角7°,采集矩阵256×256。(2) T2WI采用快速自旋回波序列进行横断位成像,TR 6000 ms,TE 93 ms,FOV 220 mm×220 mm,采集层数30 层,层厚5 mm,无层间距,采集矩阵320×320。(3) DTI采用单激发平面回波序列进行横断位成像,TR 6100 ms,TE 110 ms,FOV 256 mm×256 mm,采集层数40 层,层厚3 mm,无层间距,翻转角90°,采集矩阵128×128,累加次数average=2,弥散梯度方向30 个,b 为1000 s/mm²,采用并行采集技术(2倍)加快成像速度。
1.3 数据处理
1.3.1 数据预处理
本研究使用FSL (http://fsl.fmrib.ox.ac.uk/fsl)和PANDA (http://www.nitrc.org/projects/panda)软件包进行DTI数据的处理。预处理流程包括:(1)数据格式转换,检查图像质量;(2)涡流和头动校正图像,BET工具去除非脑组织;(3)利用dtifit工具拟合计算弥散指标各向异性分数(fractional anisotropy,FA)值;(4)之后使用flirt 线性配准工具将FA 图像经3D-T1WI 图像配准至MNI (Montreal Neurological Institute)标准空间,并使用6 mm半高全宽的高斯核对图像进行空间平滑。
FA 值反映白质神经纤维束的完整性,介于0~1之间,FA值越大表明白质纤维束完整和神经传导畅通,如果出现轴突和髓鞘损伤,则FA值下降[13]。
1.3.2 32 对经胼胝体的同位皮质脑区的解剖连接微结构计算
为了识别经胼胝体的同位皮质脑区的解剖连接微结构,本研究采用了以往研究提出的TCATT 进行后续分析,TCATT 选自人类连接组计划(http://www.humanconnectomeproject.org)中100 名健康受试者的高分辨率的扩散光谱成像数据,从自动解剖标记分区中确定左右半球32 对同位脑区,对左右半球间经胼胝体白质通路进行概率性纤维束追踪,共得到32 对同位通路[14]。这32 条通路包含的同位脑区有:感觉运动区(初级运动皮质、背侧运动前区、腹侧运动前区、初级感觉运动区、辅助运动区、辅助运动前区),前额叶(额下回三角部、额下回盖部、额下回眶部、额中回、额上回、外侧眶回、内侧额回、嗅皮层、内侧眶前回、眶前回、直回、内侧眶回),顶叶(缘上回、顶下小叶、角回、顶上小叶、中央旁小叶),颞叶(颞上回、颞中回、颞下回)和枕叶(楔叶、枕上回、枕中回、距状裂、舌回、枕下回)。首先,将该模板包含同位脑区的32 条神经纤维束配准到MNI 空间模板;随后,沿MNI 模板的轴向方向以长和宽都为8 mm 的平行平面识别出胼胝体,并制作成二值化模板(CCmask);接着,由CCmask 获取32 个位于胼胝体上中矢状面区域的感兴趣区(region of interest,ROI);最后将这32 个ROI 配准到每个受试者的FA 值图像上,提取胼胝体纤维中矢状面区域相应位置的FA 值。以M1 为例,图1 展示双侧M1 经胼胝体神经束的中矢状面区域。

图1 双侧M1 经胼胝体神经束的中矢状面区域。1A:MNI 空间模板中双侧M1 经胼胝体的纤维束;1B:沿MNI 模板轴向方向的平面制作出胼胝体二值化模板(CCmask);1C:双侧M1 经胼胝体的纤维束与CCmask 进行重叠;1D:双侧M1经胼胝体纤维束在胼胝体中矢状面区域的感兴趣区。Fig. 1 The middle sagittal area of bilateral M1 through the corpus callosum. 1A: The fiber of corpus callosum connecting bilateral M1 in MNI space; 1B: The corpus callosum binarization template (CCmask) is made along the plane in the axial direction of MNI template; 1C: The fiber connecting bilateral M1 overlapped with CCmask; 1D: Region of interest(ROI) of bilateral M1 transcallosal fibers in the midsagittal region of the corpus callosum.
1.3.3 CST结构损伤指标计算
基于约翰·霍普金斯大学白质纤维束图谱确定双侧CST,计算CST 的FA。FA 比率(FA ratio,rFA)为病灶侧FA与病灶对侧FA之间的比值(rFA=FAipsilesional/FAcontralesional)。应用rFA对双侧CST微结构改变和损伤程度情况进行定量评价,rFA越低,表明病灶同侧CST各向异性分数降低越明显,即CST 完整性损伤越严重[15]。脑卒中患者组中位于左侧和右侧病灶的人数分别为19 例和15 例,为了避免大脑半球不对称造成的差异,按照与卒中组中左/右侧病灶相同的比例,随机选择24 名健康受试者的大脑左侧对应病人的病灶侧,大脑右侧对应病人的病灶对侧;另19 名相反,右侧对应病人的病灶侧,左侧对应病人的病灶对侧。
1.3.4 统计学分析
采用SPSS 22.0 统计软件进行分析。计量资料采用(±s)表示,组间比较采用双样本t检验,计数资料采用卡方检验。组间差异检验采用双样本t检验,检验对象为卒中组与健康对照组之间CST 的rFA 值,以及两组间同位脑区经胼胝体神经纤维束的FA 值,以P<0.05 (FDR 校正)为差异具有统计学意义。年龄、性别和卒中后病程作为协变量,利用Pearson 偏相关性分析同位脑区的32条经胼胝体神经纤维束的微结构损伤指标FA 值与FM-UE 的相关性,rFA (CST)与FM-UE 的相关性,以及rFA (CST)与同位脑区经胼胝体的神经纤维束的FA 值的相关性,统计阈值P<0.05表示存在相关性。
2 结果
2.1 人口学信息分析
根据数据纳入标准,共纳入77 例受试者,其中,卒中组34 例[男27 例,年龄(52.6±10.2)岁],健康对照组43 例[男21 例,年龄(56.0±9.6)岁]。两组在年龄上差异无统计学意义(t=1.599,P=0.114),性别上差异有统计学意义(χ2=2.928,P=0.005),由于健康对照组与卒中组的性别不完全匹配,在随后的统计分析中将性别视为协变量。卒中组病程大于3 个月[(11.9±7.9)个月]。脑卒中患者组中病灶主要位置在皮质下的基底节、放射冠和丘脑,位于左侧和右侧病灶的人数分别为19例和15例。上肢运动FM-UE总分为66分,评分越高代表上肢运动功能越好,而卒中组FM-UE 为(16.6±11)分,均小于39 分,上肢运动功能障碍属于中重度水平[16]。卒中组的临床资料信息详见表1。
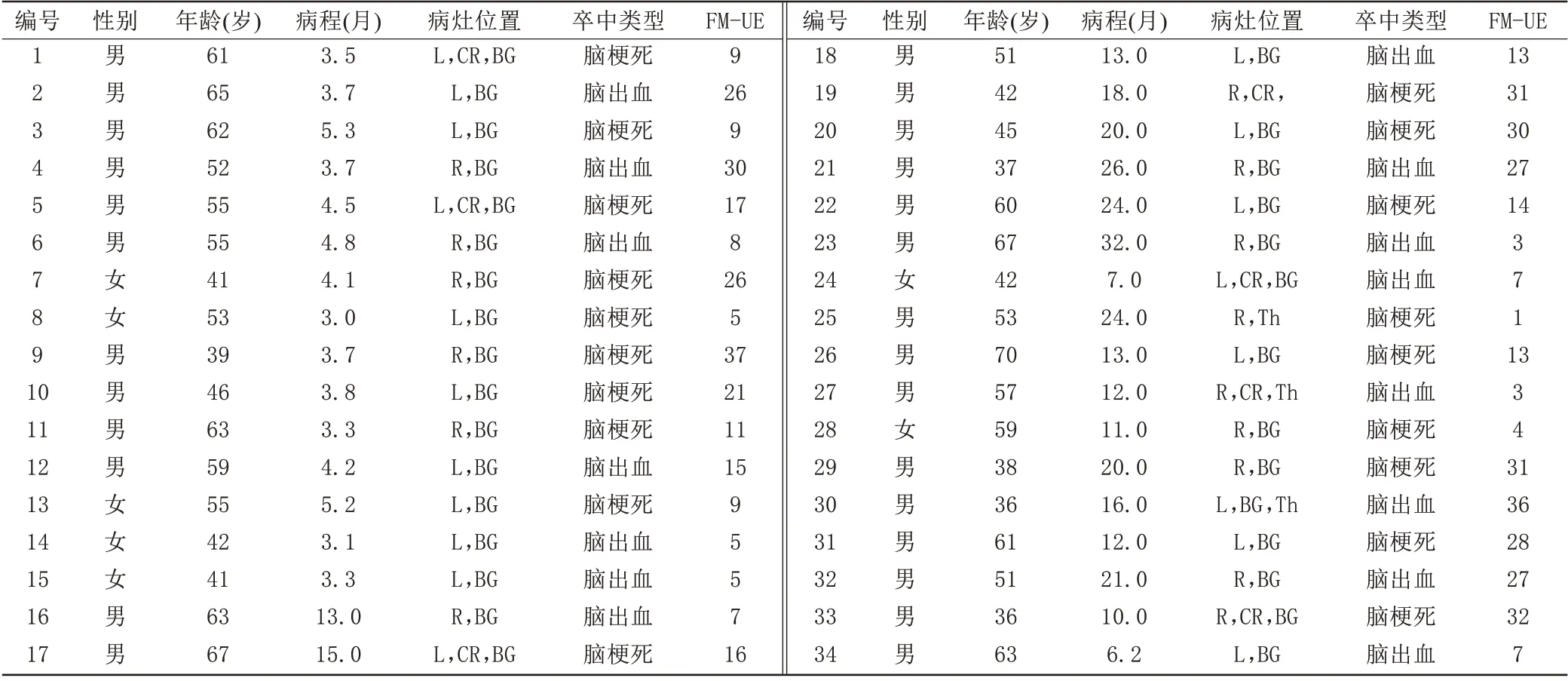
表1 卒中组的临床资料信息Tab.1 Clinical prop?erties of the stroke patients
2.2 经胼胝体纤维束和CST 的结构完整性的组间比较
与健康对照组相比,卒中组半球间同位脑区的32条经胼胝体神经纤维束在中矢状面区域的FA值均有不同程度的降低,差异有统计学意义的有29 条(P<0.05,FDR 校正)。其中,6 条属于感觉运动区(初级运动皮质、背侧运动前区、腹侧运动前区、初级感觉运动区、辅助运动区、辅助运动前区),10 条属于前额叶(额下回三角部、额下回盖部、额下回眶部、额中回、额上回、外侧眶回、内侧额回、嗅皮层、内侧眶前回、眶前回),4 条属于顶叶(缘上回、顶下小叶、角回、顶上小叶),3 条属于颞叶(颞上回、颞中回、颞下回)以及枕叶的6条(楔叶、枕上回、枕中回、距状裂、舌回、枕下回)。而差异不显著的3 条属于内侧眶回、中央旁小叶和直回的纤维束(P>0.05,FDR 校正),如表2 和图2所示。与健康对照组比较,脑卒中患者组病灶侧CST的FA值和rFA (CST)显著降低(分别为t=-12.461,P<0.001;t=-10.855,P<0.001)。病灶对侧CST的FA值在两组之间差异无统计学意义(P>0.05),详见表3。

图2 卒中组(Pat)与正常对照组(HCs)的32 对同位脑区经胼胝体神经纤维束在中矢状面区域FA 值的组间比较。经过FDR 校正(**:阈值为P<0.01;*:阈值为P<0.05),其中差异有统计学意义的有连接29对同位脑区的纤维束,包括感觉运动皮质(初级运动皮质、背侧运动前区、腹侧运动前区、初级感觉运动区、辅助运动前区、辅助运动区),前额叶(额下回三角部、额下回盖部、额下回眶部、额中回、额上回、外侧眶回、内侧额回、嗅皮层、内侧眶前回、眶前回),顶叶(缘上回、顶下小叶、角回、顶上小叶),颞叶(颞上回、颞中回、颞下回),枕叶(楔叶、枕上回、枕中回、距状裂、舌回、枕下回)。连接3 对同位脑区的经胼胝体纤维束差异无统计学意义,包括直回、内侧眶回、中央旁小叶。Fig.2 Comparison of FA values of 32 transcallosal tracts in the midsagittal plane between stroke group and healthy control group.After FDR correction(**: threshold of P<0.01, *: threshold of P<0.05). Significant differences were found in the fibers connecting 29 pairs of homogeneous brain regions,including sensorimotor area (M1, PMd, PMv, S1, preSMA, SMA),prefrontal lobe (IFG. triangularis, IFG. opercularis, IFG. orbitalis, middle frontal, superior frontal, lateral orbital, medial orbitofrontal, anterior orbital), parietal lobe (supramarginal gyrus, inferior parietal, angular,superior parietal), temporal lobe (superior temporal, middle temporal,inferior temporal), occipital lobe (cuneus, superior occipital, middle occipital, calcarine, lingual, inferior occipital); the other three transcallosal tracts connecting bilateral homogeneous areas showed no significant differences,including gyrus rectus,medical orbital,paracentral lobule.
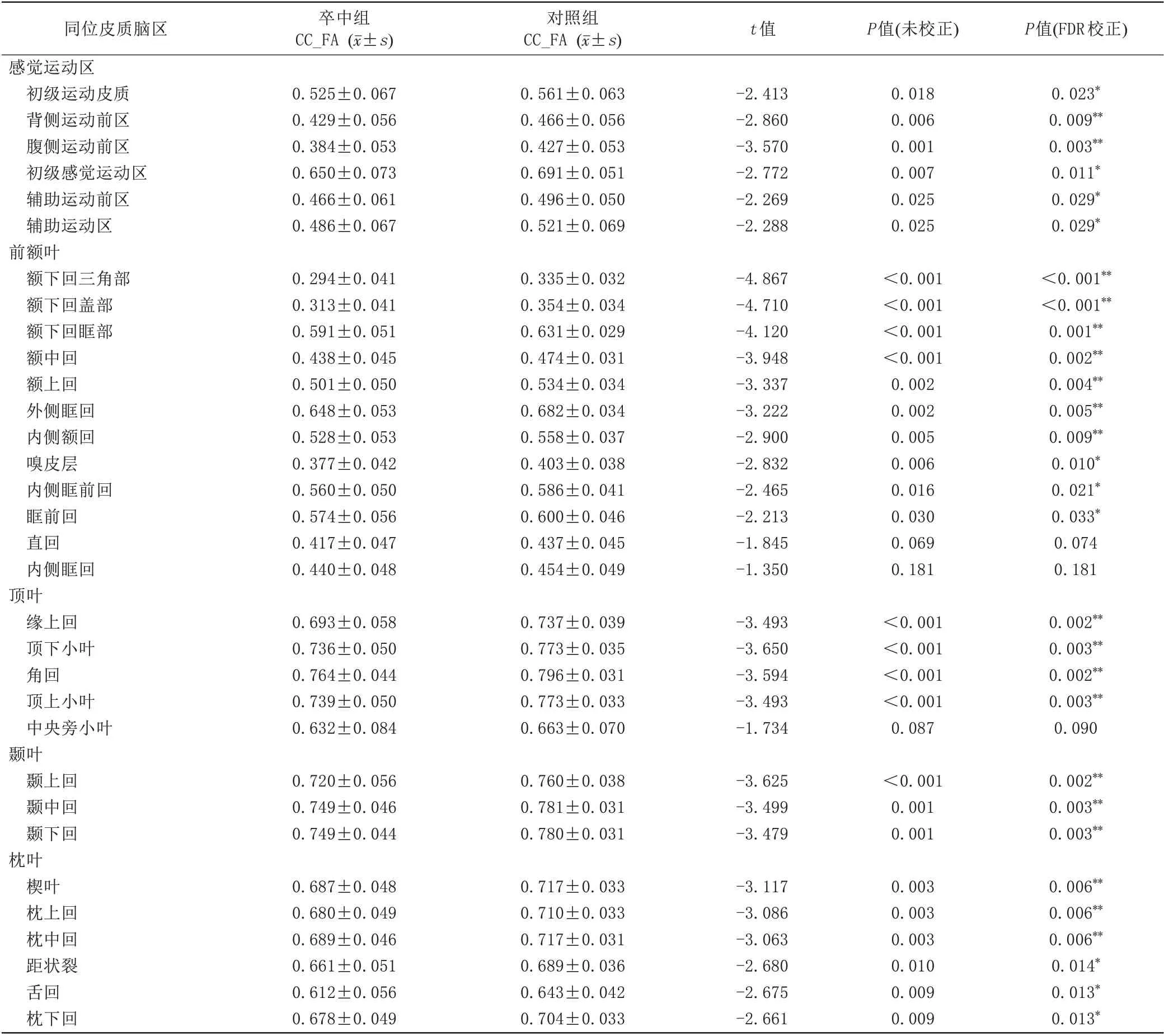
表2 同位脑区经胼胝体神经纤维束在中矢状面区域FA值的组间比较Tab.2 Comparison of FA values in the midsagittal slice of trancallosal tracts in homologous cortical brain regions between the Pat and HCs

表3 卒中组和健康对照组CST的rFA比较Tab.3 Comparison of ratio FA of CST between Pat and HCs
2.3 脑卒中组经胼胝体纤维束和CST 的结构完整性与运动学评分的关系
以性别、病程和rFA (CST)为协变量,对组间差异有统计学意义的29对同位脑区的经胼胝体神经纤维束在中矢状面区域的FA 值与上肢FMA 评分做偏相关性分析,研究发现9对同位脑区的纤维束通路与上肢运动功能评分均呈正相关(P<0.05),详见表4。此外,脑卒中组rFA (CST)与上肢FMA 评分呈显著正相关(r=0.596,P=0.0004)。
2.4 同位脑区经胼胝体纤维束结构完整性与rFA(CST)的相关性
控制协变量性别和病程,利用Pearson偏相关性分析发现,卒中组这29条经胼胝体神经纤维束在中矢状面区域的FA值与rFA (CST)均存在正相关(P<0.05),详见表4。健康对照组中未发现此相关性(P>0.05)。

表4 同位脑区经胼胝体神经纤维束在中矢状面区域FA值与上肢FMA评分、rFA(CST)的相关性Tab.4 Correlation between FA values in the midsagittal slice of trancallosal tract in homologous cortical brain regions and FM-UE,rFA(CST)
3 讨论
本研究利用TCATT 探究了单侧皮质下脑卒中的半球间同位脑区经胼胝体纤维束微结构受损与病灶同侧CST 损伤以及上肢运动功能障碍的关系。研究结果发现,与健康对照组比较,卒中组经胼胝体通向双侧同位脑区(包括感觉运动区、前额叶、顶叶、颞叶和枕叶)的29 条神经纤维束在中矢状面区域的FA 值显著下降,并与rFA (CST)及上肢运动功能评分均存在显著正相关。本研究结果揭示了半球间同位脑区的经胼胝体神经纤维束微结构连接广泛受损与病灶同侧CST损伤密切相关,同位脑区的经胼胝体纤维束结构的完整性或许可作为评估单侧皮质下脑卒中上肢运动功能障碍严重程度的参考指标。
3.1 利用TCATT 分析脑卒中半球间同位脑区结构连接变化
由于技术限制,以往对经胼胝体纤维束成像往往只能对胼胝体通向大脑整体脑叶进行纤维追踪成像,即把通向眶部、额叶、顶叶、枕叶和颞叶的经胼胝体纤维束划分为5至8个相应通道[17]。目前Archer等[14]利用更高分辨率的DTI图像、更大规模的人脑计划大队列数据和更先进的后处理算法,建成通向大脑半球间同位脑区的32 条精细高分辨经胼胝体纤维束模板。TCATT 创建的初衷是研究与胼胝体相关的神经变性型疾病,但也为研究其他神经和精神疾病的胼胝体精细微结构异常奠定了方法学基础。
本研究率先将TCATT模板应用于脑卒中的研究,探究单侧皮质下卒中病变导致半球间同位脑区的结构连接变化及其与运动功能障碍的关系。静息态功能磁共振成像研究证实正常健康人的绝大多数脑功能网络表现为双侧对称[3,5,7]。采用VMHC研究发现,脑卒中后在全脑水平上存在着广泛的同位脑区功能连接降低,且躯体感觉运动网络的同位脑区功能连接与上肢运动功能障碍密切相关[3,6,8]。实际上,基于全脑和ROI水平的功能连接分析均发现,除了感觉运动网络是易遭受卒中病变攻击损伤的核心网络以外,脑卒中偏瘫患者的非感觉运动脑区(例如额叶、顶叶和颞叶)的异常功能活动也很常见[18-19]。然而同位脑区功能连接异常的结构基础和微结构损伤与运动功能损伤的关系尚不清楚。运用针对感觉运动区的经胼胝体纤维束高分辨率模板能够以感觉运动区的半球间对称性亚区(包括双侧M1、PMd、PMv、S1、SMA 和preSMA)为ROI 进行概率性纤维束追踪[20-21],可以获得连接双侧感觉运动区的经胼胝体结构,但对于经胼胝体通往其他非感觉运动同位脑区纤维束的微结构变化知之尚少,尤其是额叶、顶叶和颞叶等同位脑区进行更为精细分区的情况。因此,利用经胼胝体通往大脑半球间所有同位脑区的32 条纤维束精细模板,将有助于全面弄清楚脑卒中导致的相关同位脑区功能活动异常所对应的结构变化及其与运动损伤之间的关系。
3.2 单侧皮质下脑卒中半球间同位脑区结构连接变化与临床运动功能障碍的关系
本研究采用TCATT分析发现,患者组半球间感觉运动脑区的经胼胝体纤维束的FA 值均显著下降,且与CST 损伤严重程度均存在正相关。与以往研究一致,该研究结果进一步证实其经胼胝体神经纤维束微结构连接受损与病灶同侧CST 继发性损伤有关[15,19,22]。本课题组成员曾采用其他白质微结构分析方法研究类似皮质下脑卒中,结果显示受累的CST的微结构损伤不仅局限在卒中病灶附近,其继发的顺行性和逆行性神经变性会累及CST全程,原发灶上方(逆行性)很多通往大脑皮质的白质通路的FA 值均显著降低,涉及病灶同侧额内侧回、中央前回、颞上回、辅助运动区和对侧中央后回[13,23-24]。正如研究预期,本组患者的其他同位皮质脑区(前额叶、顶叶、颞叶和枕叶)经胼胝体纤维束微结构连接也出现了普遍异常改变。皮质下脑卒中可导致白质纤维束轴索损伤和髓鞘降解,以往研究揭示内囊或基底节区卒中后两类神经纤维束存在逆行性病变:一类是从感觉运动皮质下行到脊髓的皮质脊髓束;另一类是源于丘脑核团形成的5个并行的基底节-丘脑-皮质回路,每个回路涉及到特定的大脑皮质,包括运动皮质、躯体感觉皮质、辅助运动区、扣带运动区和颞上回[24-25]。跨突触轴突变性理论认为,皮质下卒中皮质脊髓束损伤对相邻的纤维束产生神经元跨突触效应,脑卒中导致的突触丢失可导致相关神经纤维相连接的皮质发生神经元凋零和萎缩,神经影像学上表现为皮质厚度降低,继发性退化和代谢受损从而干扰半球间的神经元连接[26]。目前普遍赞成的观点是,受损皮质脊髓束通过跨突触轴突变性会影响脑卒中患者双侧M1的结构连接,CST的结构性损伤以及大脑半球间运动皮质之间的结构连接是影响皮质下脑卒中上肢运动功能恢复的关键因素[8,27-28]。
脑卒中后半球间相互作用失衡模型表明大脑半球间的白质结构通路失连接与广泛性功能连接中断相关,该模型强调了经胼胝体连接对运动恢复的重要作用[2,29]。Stewart 等[16]研究发现慢性脑卒中胼胝体上的运动和感觉区域FA 均降低,并且与上肢运动功能水平呈正相关。Li等[9]在急性期脑卒中的纵向研究中发现,患者双侧初级运动皮质(M1-M1)功能连接以及经胼胝体M1-M1 纤维束的FA 值在治疗前下降,治疗后均有增高并与运动功能恢复一致,表明经胼胝体束结构的完整性是影响脑卒中恢复的重要因素。单侧脑梗死动物模型研究也证实,在发病最初几天实验鼠脑双侧的初级运动皮质间功能连接显著减低,并与M1-M1之间经胼胝体的锰传递减低具有相关性[30]。本研究扩展了关于同位脑区经胼胝体结构连接的研究,发现本组脑卒中患者大脑半球间同位脑区经胼胝体结构连接普遍受损并均与上肢运动功能障碍的严重程度相关,而不仅仅局限在与双侧感觉运动同位脑区的结构连接。由此可见,除了皮质脊髓束的结构性损伤是影响皮质下脑卒中上肢运动功能恢复的关键因素,本研究结果表明其他同位脑区经胼胝体纤维的结构连接损伤也同样会影响脑卒中后的运动功能恢复。
目前神经调控技术改善脑卒中运动功能障碍的理论基础大多基于“半球间竞争模型”,这一模型认为神经功能障碍与损伤后大脑半球间兴奋性失衡相关[31]。“代偿模型”这种功能重塑模式认为残存未受损的脑网络替代了受损部分网络的功能。最新提出的“双相平衡恢复模型”融合以上两种理论,将大脑半球间平衡和功能恢复与病变所保留的结构基础联系起来,并提出了结构保留度的大小(如运动区、皮质脊髓束的保留度)决定半球间竞争模型和代偿模型哪一种占优势[32]。对于损伤较重、患侧大脑结构保留较少者,健侧功能代偿尤为重要[33-34]。脑卒中导致的脑结构损伤进入慢性期通常具有不可逆性,难以恢复。已有不少研究证实处于该期脑卒中患者大脑半球间同位脑区功能活动异常与运动功能严重程度同样密切相关[7-8,26]。因此,对于慢性期较严重的偏瘫患者,重视并设法改善相关脑区功能活动或许是临床康复值得努力尝试之处[11,35]。
3.3 局限性
本研究存在主要不足之处:(1)本研究入组的研究对象是一组慢性期中重度上肢运动功能障碍患者,所得研究结论对于处于其他时期(例如急性期)的卒中严重程度不同(例如轻度)的患者不一定适用。另外,了解脑卒中后皮质脊髓束和同位脑区经胼胝体纤维束随时间的退化或重塑过程,后续还应开展包括从卒中早期就进行的动态跟踪以及干预前后的研究。(2)基于全脑体素水平的VMHC 分析结果显示,除了大脑皮质,脑卒中患者皮质下及小脑中也存在同位脑区功能变化。本研究所采用的经胼胝体纤维束模板只能观测半球间大脑皮质同位脑区的经胼胝体结构连接。下一步研究可考虑选择高分辨皮质下结构和小脑结构模板探究半球间同位脑区皮质下和小脑的结构连接,以期更加全面深入地了解脑卒中全脑水平的同位脑区结构异常状况。
本研究利用TCATT 探讨了一组单侧皮质下脑卒中患者同位脑区经胼胝体纤维束微结构异常与运动功能障碍的关系。研究结果进一步证实皮质下脑卒中的胼胝体微结构受损与病灶同侧CST 损伤密切相关;大脑半球间同位脑区经胼胝体结构连接普遍受损均与上肢运动功能障碍的严重程度相关,则暗示继发性跨半球结构连接损伤对皮质下脑卒中运动功能障碍具有同样重要的影响作用。
作者利益冲突声明:全体作者均声明无利益冲突。