吸食安钠咖对大鼠学习记忆能力的影响及其机制研究
2022-07-30李建忠郝兴华吴海平武志兵张丽芳
李建忠,郝兴华,吴海平,武志兵,张丽芳
1.长治医学院人体解剖学教研室;2.长治医学院基础医学研究所神经退行性疾病实验室;3.长治医学院附属和平医院临床心理门诊,山西 长治 046000;4.长治市人民医院神经内科,山西 长治 046099
安钠咖(Caffeine and Sodium Benzoate)是临床治疗麻醉药物所致呼吸、循环衰竭等疾病时用于兴奋中枢神经的药物,属于我国规定管制的精神类药品。安钠咖具有成瘾性,俗称“白面”、“白粉”。安钠咖长期滥用不仅会损害吸食者的心、肺、肝和脑等器官或系统[1~3],影响个体身心健康,而且会影响家庭和睦、社会安稳。长期吸食安钠咖的患者会出现不同程度的神经精神症状和和脑损害[4]。动物实验研究发现,连续20 d 腹腔注射大剂量安钠咖会造成大鼠学习能力下降[5]。关于大剂量吸食安钠咖降低学习记忆能力机制的研究鲜见报道。本实验采用灌胃给药制备安钠咖吸食大鼠模型,观察安钠咖对大鼠学习记忆能力及海马突触可塑性的影响,探讨安钠咖滥用影响认知功能的机制,为社会宣传抵制吸食安钠咖提供更有力的理论和生物学依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物及主要试剂 35 日龄雄性SD 大鼠购自斯贝福(北京)生物技术有限公司【SCXK(京)2019-0010】。
1.1.2 药物、试剂及仪器 安钠咖由长治市公安局禁毒办提供。兔抗突触素(synaptophysin,SYN)抗体(编号:ab32127)和兔抗突触后致密蛋白95(postsynaptic density 95,PSD95)抗体(编号:ab18258)购自abcam 公司,石蜡切片神经元高尔基法(GOLGICOX)染色试剂盒购自上海杰美基因医药科技有限公司。Morris 水迷宫(瑞沃德,中国);SMART 3.0 行为分析软件(Panlab,西班牙);石蜡切片机(Leica,德国);超薄切片机(Leica,德国);电泳仪(BIO-RAD,美国);凝胶成像仪(Azure,美国);透射电子显微镜(FEI,美国)。
1.2 实验方法
1.2.1 实验动物分组与处理 33 只SD 大鼠随机分为对照组(C)、安钠咖小剂量组(A-LD)和安钠咖大剂量组(A-HD)3 组,每组11 只,饲养于室温(22 ± 1)℃,12 h 昼夜节律(8:00~20:00)的动物房,自由进食和饮水。每日上午8 时左右灌胃给药1 次(C 组:生理盐水1 mL;A-LD 组:安钠咖溶液60 mg/kg;A-HD 组:安钠咖溶液120 mg/kg),连续60 d。
1.2.2 Morris 水迷宫实验 Morris 水迷宫实验分为定位航行实验和空间探索实验两部分。定位航行实验:连续5 d 将大鼠依次从4 个象限的中点面壁入水,视频跟踪系统记录120 s 内找到隐蔽平台所需时间(逃避潜伏期:s),无论大鼠能否找到隐蔽平台允许其在平台停留15 s。空间探索实验:第6 d,撤掉平台,将大鼠从第2 象限中点面壁入水,视频跟踪系统记录大鼠在目标象限停留时间及120 s 内穿过原平台所在位置的次数。
1.2.3 组织取材 行为学实验结束后,每组取6 只大鼠常规经麻醉、冲洗、固定后取脑,后固定24 h 后取上丘与视交叉之间组织,并沿正中矢状位一分为二,左侧用于免疫组织化学染色观测海马区SYN 和PSD95的表达,右侧用于Golgi 染色观测海马区第2、3 级顶树突树突棘的变化;其余5 只麻醉后断头取脑,分离两侧海马,左侧用于Western blot 检测SYN 和PSD95的表达,右侧用于透射电子显微技术观测超微结构。
1.2.4 免疫组织化学染色 每个组织取6 张海马不同部位的切片,按照免疫组织化学染色步骤完成抗SYN(1:250)和抗PSD95(1:1000)免疫组织化学染色。海马CA1 区在400 倍镜下摄片,并用IPP 软件测量SYN 和PSD95 的平均光密度。
1.2.5 Western blot 海马经蛋白提取和浓度测定后计算上样量。蛋白加热变性后经SDS-PAGE 电泳,湿转膜,5%BSA 封闭2 h,加入一抗(兔抗SYN 抗体1:50000、兔抗PSD95 抗体1:500、β-actin 1:10000)4 ℃孵育过夜,加入二抗孵育2 h,ECL 显影和凝胶成像系统曝光,最后用IPP 软件测量各蛋白条带的光密度值。
1.2.6 Glogi 染色 组织块按照石蜡切片神经元高尔基法(GOLGI-COX)染色试剂盒说明书染色。每个组织块取3 张海马不同部位切片在1000 倍镜下选择海马CA1 区完全浸渍的神经元测量第2、3 级顶树突长度(µm),由两位研究人员独立计数树突棘的数目并求均数,然后计算树突棘密度(数目/μm)。
1.2.7 透射电子显微技术 组织块经2.5%戊二醛溶液4 ℃过夜固定后,参考Paxinos 脑立体定位图谱于体视显微镜下切取海马CA1 区。1%锇酸4 ℃后固定2 h,梯度乙醇脱水,丙酮置换,丙酮、包埋剂不同比例浸渍,包埋剂包埋,制备超薄切片(70 nm),醋酸双氧铀和醋酸铅染色各10 min。在Tecnai G2 Spirit 透射电子显微镜下观察超微结构,并从中随机拍摄3 张照片清晰的切片(放大13000 倍)。在每张照片上随机绘制1 个方形的区域,定义为1 个计数框架。根据突触确认标准识别突触,并按照体视学“禁线法”计数突触。使用体视学方法和图像分析系统计算突触数密度(Nv,number/m3)和面密度(Sv,m2/m3)。
1.3 统计学分析
运用SPSS22.0 统计软件对实验数据进行统计分析。计量资料用表示。逃避潜伏期比较用重复测量的多因素方差分析;其余实验数据比较采用单因素方差分析,差异有统计学意义时,两两间行LSD 检验,P<0.05 表示差异有统计学意义。
表1 大鼠逃避潜伏期(,s)Tab.1 Comparison of escape latency of rats in three groups (Mean±SD,s)

表1 大鼠逃避潜伏期(,s)Tab.1 Comparison of escape latency of rats in three groups (Mean±SD,s)
*P>0.05,#P<0.01,与C 组比较Compared with C group,*P>0.05,#P<0.01
2 结果
2.1 Morris 水迷宫实验结果
各组大鼠逃避潜伏期随实验天数增加逐渐缩短,但就同一训练日而言,与C 组比较,A-LD 组逃避潜伏期延长,但差异无统计学意义(P>0.05),而A-HD 组大鼠逃避潜伏期明显延长,差异有统计学意义(P<0.01)。空间探索实验中,与C 组比较,A-LD 组在目标象限停留时间和穿越平台次数都减少,但差异无统计学意义(P>0.05),而A-HD 组大鼠在目标象限停留时间明显缩短,穿越平台次数明显减少,差异具有统计学意义(P<0.01),见表2。
表2 大鼠目标象限停留时间和穿越平台次数()Tab.2 Comparison of the time spent in target quadrant and the number of platform crossings in three groups of rats(Mean±SD)

表2 大鼠目标象限停留时间和穿越平台次数()Tab.2 Comparison of the time spent in target quadrant and the number of platform crossings in three groups of rats(Mean±SD)
*P>0.05,#P<0.01,与C 组比较Compared with C group,* P>0.05,#P<0.01
2.2 免疫组织化学染色结果
免疫组织化学染色显示SYN 免疫反应产物呈棕黄色,分布于神经毡区,其中C 组染色深,A-HD 组染色明显变浅,3 组平均光密度值经统计分析显示:ALD 组低于C 组,但差异无统计学意义(P>0.05),而AHD 组明显低于C 组,差异有统计学意义(P<0.01);PSD95 免疫反应产物呈棕色,分布于神经元胞浆和突起,C 组阳性细胞数量最多,A-HD 组最少,3 组平均光密度值经统计分析显示:A-LD 组与C 组差异无统计学意义(P>0.05),而A-HD 组明显低于C 组,差异有统计学意义(P<0.01),见图1、表3。

图1 免疫组织化学染色检测大鼠海马CA1 区SYN 和PSD95 表达(n=6)A1、A2:C 组B1、B2:A-LD 组C1、C2:A-HD 组A1、B1、C1:检测SYN 表达A2、B2、C2:检测PSD95 表达Fig.1 The expression of SYN and PSD95 in hippocampal CA1 region of rats in each group(n=6,immunohistochemical staining)A1,A2:C group;B1,B2:A-LD group;C1,C2:A-HD group; A1,B1、C1:SYN expression;A2,B2,C2:PSD95 expression
表3 大鼠SYN、PSD95 平均光密度()Tab.3 Comparison of the mean optical density of SYN and PSD95 of rats in three groups(Mean±SD)

表3 大鼠SYN、PSD95 平均光密度()Tab.3 Comparison of the mean optical density of SYN and PSD95 of rats in three groups(Mean±SD)
*P>0.05,#P<0.01,与C 组比较Compared with C group,*P>0.05,#P<0.01
2.3 Western blot 结果
通过Western blot 检测海马区SYN 和PSD95 的表达,与C 组比较,A-LD 组大鼠海马SYN 和PSD95 表达均减少,但差异无统计学意义(P>0.05),而A-HD组大鼠海马SYN 和PSD95 表达明显减少,差异有统计学意义(P<0.01),见图2、表4。

图2 Western blot 检测大鼠海马SYN 和PSD95蛋白条带Fig.2 SYN and PSD95 protein bands in hippocampus of rats in each group detected by Western blot
表4 大鼠SYN、PSD95 累积光密度()Tab.4 Comparison of integrated optical density of SYN and PSD95 of rats in three groups(Mean±SD)

表4 大鼠SYN、PSD95 累积光密度()Tab.4 Comparison of integrated optical density of SYN and PSD95 of rats in three groups(Mean±SD)
*P>0.05,#P<0.01,与C 组比较Compared with C group,* P>0.05,#P<0.01
2.4 Golgi 染色结果
通过Golgi 染色检测海马CA1 区神经元第2、3 级顶树突树突棘情况,C 组大鼠树突棘密集,规整,AHD 组大鼠树突棘稀疏,排列不规整。统计分析发现,与C 组大鼠比较,A-LD 组树突棘密度减少,但差异无统计学意义(P>0.05),而A-HD 组大鼠树突棘密度明显减少,差异有统计学意义(P<0.01),见图3、表5。
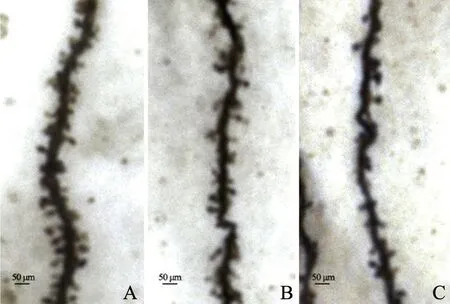
图3 Golgi 染色检测大鼠海马CA1 区神经元第2、3 级顶树突A:C 组B:A-LD 组C:A-HD 组Fig.3 The secondary and tertiary apical dendrites in the hippocampal CA1 region neurons of rats in each group detected by Golgi stainingA:C group;B:A-LD group;C:A-HD group
2.5 透射电子显微镜结果
透射电子显微镜观察各组大鼠海马CA1 区超微结构,见图4。通过体视学方法及图像分析系统计算Nv 和Sv,统计分析发现,A-LD 组大鼠海马CA1 区Nv和Sv 低于C 组,但差异无统计学意义(P>0.05),但AHD 组大鼠海马CA1 区Nv 和Sv 明显低于C 组大鼠,差异有统计学意义(P<0.01),见表5。
表5 大鼠树突棘密度、Nv、Sv()Tab.5 Comparison of the dendritic spine density,Nv,Sv of rats in three groups(Mean±SD)

表5 大鼠树突棘密度、Nv、Sv()Tab.5 Comparison of the dendritic spine density,Nv,Sv of rats in three groups(Mean±SD)
*P>0.05,#P<0.01,与C 组比较Compared with C group,*P>0.05,#P<0.01

图4 透射电子显微技术显示大鼠海马CA1 区超微结构 A:C 组B:A-LD 组C:A-HD 组Fig.4 Ultrastructure of hippocampal CA1 region of rats in each group detected by transmission electron microscopy A:C group;B:A-LD group;C:A-HD group
3 讨论
咖啡因是一种甲基黄嘌呤物质,存在于咖啡、茶、巧克力、软饮料和某些药物中,是世界上消费量最大的精神活性物质之一,机体吸收后广泛分布于脑和身体其他部位。因此,咖啡因对生物功能和人体健康的急慢性影响是基础和临床研究的重要课题。安钠咖是临床常用的一种中枢兴奋药,其发挥药效作用的主要成分为咖啡因,但咖啡因难溶于水,而苯甲酸钠易溶于水,故按1:1 比例配制以起到助溶作用,便于人体吸收[6]。在我国,安钠咖属于严格管制的精神类药品,原因在于其兼有另外一重身份:毒品,俗称“白粉”或“白面”,长期滥用会对人体诸多器官、系统造成伤害,严重影响人体的健康。
目前,关于咖啡因对学习、记忆功能的影响尚存在争议。一些研究表明咖啡因对阿尔茨海默病、帕金森病、亨廷顿病等多种神经退行性疾病具有保护作用,可以通过抗炎、抗氧化和抗凋亡等机制改善认知缺损[7,8]。然而许多研究发现咖啡因导致学习、记忆受损[9~15]。出生后第1 周接受咖啡因治疗(1~9 mg/kg)的大鼠成年后空间操作性学习任务受损[9]。生后早期(PN2~6)接受咖啡因治疗(PN2:20 mg/kg,PN3~6:15 mg/kg)的SD 大鼠成年后(PN35~37)在穿梭被动回避实验中24 h 后的记忆保持力显著降低[10]。母鼠在妊娠期(第4 d 开始)服用含咖啡因的自来水(75 mg/L),子代大鼠在新物体识别实验中的24 h 记忆保持和八臂迷宫实验中的空间学习记忆能力受损[11]。妊娠SD大鼠于第4~21 d 皮下注射咖啡因(20 mg/kg,2 次/日),其雄性子代饲养至4 月龄行Morris 水迷宫实验显示学习记忆能力下降[12]。Urushihata 等[13]为评估咖啡因对盐趋化性学习的影响,将秀丽隐杆线虫置于不同浓度(0.01%、0.1%、0.3%、1.0%)的咖啡因与NaCl 混合液中,发现预先暴露于0.3%咖啡因的线虫表现出对盐趋化性学习的抑制。Almosawi 等[14]将雄性BLC57 小鼠分为对照组、中剂量组和大剂量组,中、高剂量组小鼠分别按照20 mg/kg 和200 mg/kg 的标准服用咖啡因,7 d 后通过Morris 水迷宫检测各组小鼠的学习记忆能力,结果表明中等剂量咖啡因增强记忆,而高剂量导致学习记忆受损。Sallaberry 等[15]研究发现,成年雌性Wistar 大鼠在交配前15 d 开始应用咖啡因(低剂量:0.1 g/L;中剂量:0.3 g/L),其后代于21 d断奶后饮用与母代相同剂量的咖啡因,新物体识别实验显示,低剂量咖啡因对雌性后代记忆没有影响,然而中剂量咖啡因导致雌性后代长期记忆受损。本实验中通过Morris 水迷宫检测各组大鼠的学习记忆能力,结果发现,与C 组比较,小剂量安钠咖灌胃对学习记忆能力的影响没有差异,但大剂量安钠咖灌胃不仅造成学习能力受损,而且记忆能力降低,表现为定位航行实验中大鼠逃避潜伏期明显延长,空间探索实验中目标象限停留时间和穿越原平台所在位置次数明显减少,这与路海霞等[5]的研究结果大剂量安钠咖对记忆能力没有产生影响不同,造成这种差异的原因可能是由于安钠咖的时间效应,路海霞用20 d 制备安钠咖吸食模型,本实验制备安钠咖吸食模型为期60 d。
海马是人类的陈述性或显性记忆以及动物的空间/情境学习的关键脑区[16],突触可塑性是学习记忆的基础。动物和人体的一些实验研究咖啡因对突触可塑性的影响,大鼠海马脑片的初步数据表明,摄入咖啡因后长时程增强(long-term potentiation,LTP)降低[17];3 周内服用咖啡因可减少动物海马体LTP 的诱导[18];Hanajima 等[19]研究咖啡因对人类初级运动皮层可塑性的影响,发现咖啡因摄入降低了四脉冲经颅刺激在显著应答者中诱导的LTP。树突棘是神经元树突上的棘状突起,是突触形成的最主要部位,其形态和数量的变化都可以影响到突触可塑性[20]。本实验通过Golgi 染色检测海马CA1 区的树突棘的分布,结果发现,与C 组比较,A-LD 组大鼠树突棘密度差异没有统计学意义,但A-HD 组大鼠树突棘密度明显减少,表明大剂量吸食安钠咖减少了突触的数量,降低了海马突触可塑性。为证实吸食安钠咖对突触数量的影响,还通过透射电子显微镜和体视学方法检测海马CA1 区Nv 和Sv,与树突棘密度结果一致,小剂量安钠咖并没有造成Nv 和Sv 的太大变化,但大剂量安钠咖明显减少Nv 和Sv。SYN 是位于突触囊泡膜上的一种糖蛋白,通过调节轴、树突的分化与生长进而影响突触的结构,其表达可以反映突触的分布与密度;PSD95 是位于突触后膜上的骨架蛋白,参与突触连接和形成,维持突触可塑性[21]。作为突触可塑性的两种标志物,笔者通过免疫组织化学实验和Western blot 检测海马区二者的表达,结果发现,与C 组比较,A-LD 组大鼠海马两种蛋白的表达都没有差异,而AHD 组大鼠海马两种蛋白的表达都明显降低。综上所述,大剂量安钠咖降低大鼠海马突触可塑性,结合行为学实验结果,分析认为大剂量安钠咖通过降低海马突触可塑性进而损伤学习记忆能力。
关于大剂量安钠咖降低海马区突触可塑性的机制尚未完全明确,可能与拮抗腺苷A2A受体有关。咖啡因是一种非选择性腺苷A1和A2A受体拮抗剂,它对A2A受体亲和力高于A1受体[22],在海马,选择性A1受体拮抗剂促进LTP[23],而选择性腺苷A2A受体拮抗剂减 弱LTP[24~26]。Sekino 等[27]和Kessey 等[28]发现 将特 异性腺苷受体拮抗剂直接应用于海马神经元可防止破伤风诱导的LTP。腺苷A2A受体与促进睡眠密切相关,睡眠会加强大脑的神经联系即突触,突触的增加加强了大脑存储记忆的能力[9],而睡眠剥夺或缺乏睡眠作为生理应激源会损害突触可塑性,使神经联系达不到应有的强度,进而导致记忆存储率较低。咖啡因摄入会扰乱正常的睡眠-觉醒周期,诱导觉醒,因此大剂量安钠咖可能通过A2A受体拮抗作用降低海马突触可塑性,进而导致学习记忆能力下降。
