基于Th1/Th2细胞因子网络调控机制探索汉防己甲素片治疗Ⅱ期尘肺的临床研究
2022-07-29龚享文黄玉梅刘春云肖新发李志腾陈谦袁项英许德昌刘辉
龚享文,黄玉梅,刘春云,肖新发,李志腾,陈谦,袁项英,许德昌,刘辉
(赣州市第五人民医院呼吸与危重症医学科/赣州市呼吸病研究所,江西 赣州 341000)
尘肺病是由于长期吸入致病性粉尘,且粉尘在体内无法吸收或生物降解,长期滞留肺组织内,从而引起肺泡细胞弥漫性纤维化的一类职业性疾病,主要包括矽肺、煤工尘肺、石墨尘肺等类型[1]。尘肺病患者早期通常无明显临床症状,患者易忽视对致病因素的预防,然而随着病情的进展,肺组织发生纤维化病理性结构改变,肺功能下降,逐渐表现出不同程度的咳嗽、胸闷胸痛和呼吸困难等临床症状,甚至出现咳血等症状[2]。由于尘肺病病程漫长,久治不愈,严重影响患者生活质量。因此,探寻能有效改善尘肺病患者呼吸系统临床症状,缓解病情进展的治疗方法,是近年来呼吸内科临床研究的热点课题之一。基于此,本研究选取2016年4月至2019年4月本院收治的80例Ⅱ期尘肺病患者作为研究对象,旨在探究汉防己甲素片通过调节Th1/Th2细胞因子网络机制治疗Ⅱ期尘肺的临床疗效,现报道如下。
1 资料与方法
1.1 临床资料 选取2016 年4 月至2019 年4 月赣州市第五人民医院呼吸内科收治的80 例Ⅱ期尘肺病患者作为研究对象,按照随机数字表法分为研究组和对照组,每组40例。两组临床资料比较差异无统计学意义,具有可比性,见表1。本研究已通过本院伦理委员会审核批准。

表1 两组临床资料比较Table 1 Comparison of clinical data between the two groups
1.2 纳入及排除标准 纳入标准:符合Ⅱ期尘肺病的临床诊断标准;年龄18~70岁;患者及家属均对本研究知情同意并签署知情同意书。排除标准:经检查证实由肿瘤、结核、真菌等因素所致的咳喘及尘肺病合并严重并发症者;合并其他严重的心、肺疾病、内分泌疾病、自身免疫疾病或慢性消耗性疾病者;合并肝、肾和造血系统等严重原发病者;治疗过程中及治疗前使用潘生丁、肝素等影响血小板功能药物者;对治疗药物过敏者;存在严重精神障碍性疾病者。
1.3 方法 治疗组给予汉防己甲素片(浙江众益药业有限公司,国药准字H33022163,规格:20 mg/片)口服治疗,每次60 mg,每天3次,连续服用6 d,停药1 d,为1 个治疗周期。对照组给予乙酰半胱氨酸泡腾片(意大利赞邦集团,批准文号H20140449,规格:600 mg/片)口服治疗,每次600 mg,每天3次。两组均连续治疗6个月。
1.4 观察指标 ①于治疗前后分别抽取患者空腹静脉血5 ml,使用美国贝克曼库尔特Allegra X-22型离心机3 500 r/min 离心5 min,取上层血清,使用意大利ALISEI 全自动酶标仪,采用酶联免疫法测定血清肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)、白细胞介素(interleukin,IL)-8、干扰素-γ(interferon-γ,IFN-γ)、IL-2、IL-4 和IL-10 水平,检测IL-10试剂盒购自上海朗顿生物技术有限公司;②使用美国贝克曼Cytoflex 流式细胞仪测定CD4+、CD8+、CD4+/CD8+、免疫球蛋白M(immunoglobulin M,IgM)、免疫球蛋白G(immunoglobulin G,IgG)等免疫功能指标;③于治疗前后,使用雷度ABL80 型血气分析仪测定动脉血氧分压(arterial partial pressure of oxygen,PaO2)、动脉血二氧化碳分压(arterial carbon dioxide partial pressure,PaCO2)和动脉血氧饱和度(oxygen saturation,SaO2)等血气指标;④于治疗前后,使用PICCO2容量监测仪检测最大通气量(maximum minute ventilation,MVV)、第1 秒用力吸气容积(forced expiratory volume in one second,FEV1)、用力肺活量(forced vital capaci-ty,FVC)、第1 秒用力吸气容积/用力肺活量(FEV1/FVC)等呼吸功能指标;⑤使用圣乔治呼吸问卷(St George's respiratory questionnaire,SGRQ)评估患者生命质量,评分0~100 分,分值越高表示患者生命质量越差。
1.5 统计学方法 采用SPSS 13.0统计学软件分析数据,计量资料以“±s”表示,组间比较采用t检验,计数资料以[n(%)]表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组治疗前后巨噬细胞相关因子水平比较 治疗前,两组血清TNF-α和IL-8水平比较差异无统计学意义;治疗后,两组血清TNF-α和IL-8水平均显著低于治疗前,且研究组明显低于对照组(P<0.05),见表2。
表2 两组治疗前后巨噬细胞相关因子水平比较(±s,ng/L)Table 2 Comparison of macrophage related factor levels between the two groups before and after treatment(±s,ng/L)
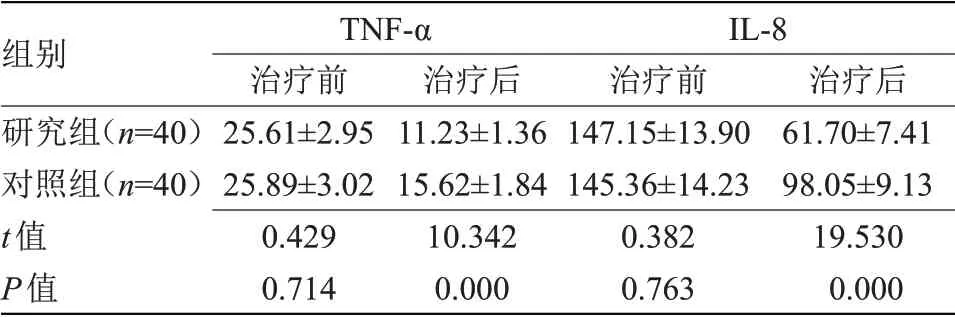
表2 两组治疗前后巨噬细胞相关因子水平比较(±s,ng/L)Table 2 Comparison of macrophage related factor levels between the two groups before and after treatment(±s,ng/L)
注:TNF-α,肿瘤坏死因子-α;IL-8,白细胞介素-8
组别研究组(n=40)对照组(n=40)t值P值TNF-α治疗前25.61±2.95 25.89±3.02 0.429 0.714治疗后11.23±1.36 15.62±1.84 10.342 0.000 IL-8治疗前147.15±13.90 145.36±14.23 0.382 0.763治疗后61.70±7.41 98.05±9.13 19.530 0.000
2.2 两组治疗前后Th1/Th2相关细胞因子水平比较治疗前,两组血清IFN-γ、IL-2、IL-4和IL-10水平比较差异均无统计学意义;治疗后,两组血清IFN-γ和IL-2水平均明显低于治疗前(P<0.05);IL-4、IL-10水平与本组治疗前比较差异无统计学意义,且研究组IFNγ和IL-2水平均明显低于对照组(P<0.05),两组IL-4和IL-10水平比较差异无统计学意义,见表3。
表3 两组治疗前后Th1/Th2相关因子水平比较(±s,ng/L)Table 3 Comparison of th1/th2 related factors between the two groups before and after treatment(±s,ng/L)

表3 两组治疗前后Th1/Th2相关因子水平比较(±s,ng/L)Table 3 Comparison of th1/th2 related factors between the two groups before and after treatment(±s,ng/L)
注:IFN-γ,干扰素-γ;IL-2,白细胞介素-2;IL-4,白细胞介素-4;IL-10,白细胞介素-10
组别研究组(n=40)对照组(n=40)t值P值IFN-γ治疗前5.61±0.61 5.79±0.58 0.521 0.624治疗后3.02±0.34 4.17±0.46 9.253 0.000 IL-2治疗前48.65±5.03 48.27±4.90 0.327 0.816治疗后27.45±3.36 34.18±4.12 7.518 0.000 IL-4治疗前41.82±4.72 41.54±4.86 0.462 0.681治疗后43.49±5.02 42.75±4.93 0.721 0.425 IL-10治疗前35.17±4.41 34.96±4.58 0.408 0.736治疗后37.26±4.73 36.19±4.69 0.994 0.317
2.3 两组治疗前后免疫功能指标比较 治疗前,两组血清CD4+、CD8+和CD4+/CD8+水平比较差异均无统计学意义;治疗后,研究组血清CD4+和CD4+/CD8+水平明显高于治疗前,CD8+水平低于治疗前,且研究组CD4+和CD4+/CD8+水平均显著高于对照组,CD8+水平明显低于治疗前,差异均有统计学意义(P<0.05);两组治疗前后血清IgM 和IgG水平比较差异均无统计学意义,见表4。
表4 两组治疗前后免疫功能指标比较(±s)Table 4 Comparison of immune function indexes between the two groups before and after treatment(±s)

表4 两组治疗前后免疫功能指标比较(±s)Table 4 Comparison of immune function indexes between the two groups before and after treatment(±s)
注:IgM,免疫球蛋白M;IgG,免疫球蛋白G
组别研究组(n=40)对照组(n=40)t值P值CD4+(%)治疗前18.93±2.27 19.14±2.35 0.492 0.651治疗后26.41±2.75 19.79±2.49 8.043 0.000 CD8+(%)治疗前35.42±4.12 35.59±4.31 0.426 0.719治疗后24.23±2.60 34.74±4.25 10.952 0.000 CD4+/CD8+治疗前0.53±0.06 0.54±0.07 0.235 0.883治疗后1.09±0.11 0.57±0.06 16.518 0.000 IgM(mg/L)治疗前105.17±11.41 104.96±10.58 0.399 0.743治疗后103.26±12.73 103.79±11.62 0.517 0.624 IgG(mg/L)治疗前89.06±8.27 90.34±8.45 0.549 0.603治疗后87.23±8.52 88.49±8.60 0.820 0.337
2.4 两组治疗前后血气指标比较 治疗前,两组PaO2、PaCO2和SaO2比较差异无统计学意义;治疗后,两组PaO2和SaO2均高于治疗前,PaCO2低于治疗前,且研究组PaO2和SaO2均高于对照组,PaCO2低于对照组,差异有统计学意义(P<0.05),见表5。
表5 两组治疗前后血气指标比较(±s)Table 5 Comparison of blood gas indexes between the two groups before and after treatment(±s)

表5 两组治疗前后血气指标比较(±s)Table 5 Comparison of blood gas indexes between the two groups before and after treatment(±s)
注:PaO2,动脉血氧分压;PaCO2,动脉血二氧化碳分压;SaO2,动脉血氧饱和度
组别研究组(n=40)对照组(n=40)t值P值PaO2(mmHg)治疗前68.94±3.57 69.13±3.61 76.82±3.73 73.59±3.81 0.455 0.691治疗后3.517 0.000 PaCO2(mmHg)治疗前41.94±2.84 42.16±2.76 0.392 0.752治疗后34.59±2.66 37.03±2.71 5.074 0.000 SaO2(%)治疗前85.74±2.94 85.35±3.11 0.487 0.654治疗后94.63±3.25 91.76±3.37 4.847 0.000
2.5 两组治疗前后呼吸功能指标比较 治疗前,两组MVV、FEV1、FVC 和FEV1/FVC 比较差异无统计学意义;治疗后,两组MVV、FEV1、FVC和FEV1/FVC均高于治疗前,且研究组高于对照组(P<0.05),见表6。
表6 两组治疗前后呼吸功能指标比较(±s)Table 6 Comparison of respiratory function indexes between the two groups before and after treatment(±s)
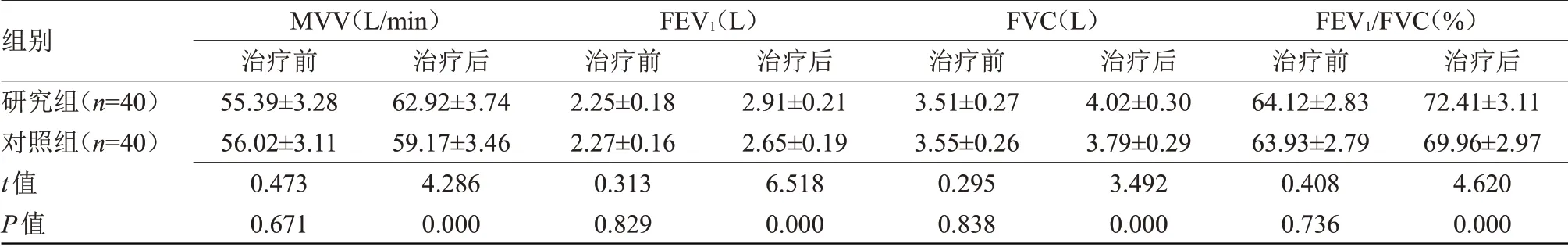
表6 两组治疗前后呼吸功能指标比较(±s)Table 6 Comparison of respiratory function indexes between the two groups before and after treatment(±s)
注:MVV,每分钟最大通气量;FEV1,第1秒用力呼气容积;FVC,用力肺活量
组别研究组(n=40)对照组(n=40)t值P值MVV(L/min)治疗前55.39±3.28 56.02±3.11 0.473 0.671治疗后62.92±3.74 59.17±3.46 4.286 0.000 FEV1(L)治疗前2.25±0.18 2.27±0.16 0.313 0.829治疗后2.91±0.21 2.65±0.19 6.518 0.000 FVC(L)治疗前3.51±0.27 3.55±0.26 0.295 0.838治疗后4.02±0.30 3.79±0.29 3.492 0.000 FEV1/FVC(%)治疗前64.12±2.83 63.93±2.79 0.408 0.736治疗后72.41±3.11 69.96±2.97 4.620 0.000
2.6 两组治疗前后生命质量比较 治疗前,两组SGRQ评分[(72.19±8.04)分vs.(73.26±8.17)分]比较差异无统计学意义(t=0.639,P=0.514);治疗后,两组SGRQ评分均低于治疗前,且研究组低于对照组[(54.07±6.11)分vs.(61.84±6.95)分](t=5.310,P<0.05)。
3 讨论
尘肺病是我国主要的职业病类型之一,由于致病因素明确,原则上可有效防控,然而由于部分企业对职业病防控措施不足,且职工本身缺乏自我保护意识,导致尘肺病患病率较高。流行病学研究显示,2017 年我国共报告约85 万例尘肺病病例,占当年职业病报告总数的90%,成为我国危害程度最高且患病率最高的职业病类型,不仅对患者造成较为严重的身心痛苦,也会对社会造成严重的医疗经济负担[3]。尘肺病进展过程中,肺组织纤维是一种不可逆理性病变,目前,尚缺乏治疗可逆转尘肺病患者肺组织纤维化的有效方法,以预防呼吸道感染,缓解临床症状,提高机体免疫功能,延缓肺组织纤维化速度的药物康复治疗为主[4]。
尘肺病的发病机制较为复杂,病理学研究显示,含硅、矽等元素的致病性粉尘长期滞留于下呼吸道毛细支气管和肺泡内,诱发巨噬细胞持续性释放TNF-α、IL-8 等炎症介质和T 细胞趋化因子,导致Th1/Th2 细胞因子网络调控机制失衡,表现为Th1 优势状态,Th0 向Th1 细胞分化趋势增加,Th1细胞合成分泌IFN-γ、IL-2 等细胞因子水平上调,细胞免疫强度增加,同时,CD4+细胞含量比例下降、CD8+细胞含量比例升高、CD4+/CD8+数值减小;而TH0 向Th1 细胞分化趋势减缓,Th1 细胞合成分泌IL-4 和IL-10 等细胞因子水平下调,体液免疫强度下降,IgM、IgG 等免疫球蛋白水平下降。因此,Th1/Th2 细胞因子网络调控机制失衡,是导致机体免疫功能失调,造成肺组织纤维化持续加剧,增加呼吸道感染等并发症风险的重要机制[5-7]。
汉防己甲素片是中医治疗尘肺病的传统药物,其有效成分为双苄基异喹啉结构的汉防己甲素生物碱,临床研究显示,该化合物具有抗炎止痛等功效,通过降低炎症反应减少肺组织损伤,且可抑制胶原蛋白mRNA 的转率过程,降低胶原蛋白的合成效率,缓解肺组织纤维化[8-13]。然而,目前临床对于汉防己甲素对尘肺病患者Th1/Th2 细胞因子网络机制失衡的调节作用及免疫功能改善作用研究尚不明确。本研究结果显示,治疗后,研究组PaO2和SaO2均明显高于对照组(P<0.05),研究组Pa-CO2明显低于对照组;研究组MVV、FEV1、FVC 和FEV1/FV 均C 明显高于对照组(P<0.05);研究组SGRQ 评分明显低于对照组(P<0.05),说明与乙酰半胱氨酸泡腾片比较,汉防己甲素片对Ⅱ期尘肺病患者血气状况和呼吸功能的改善作用更显著,更有助于缓解呼吸系统症状,提高患者的生活质量。本研究显示,治疗后,研究组TNF-α 和IL-8 水平均明显低于对照组(P<0.05),说明汉防己甲素片可有效抑制Ⅱ期尘肺病患者巨噬细胞诱导的非特异性炎症反应;且研究组IFN-γ 和IL-2 水平均明显低于对照组(P<0.05),CD4+和CD4+/CD8+均明显高于对照组,CD8+明显低于对照组(P<0.05),说明汉防己甲素片可通过调节细胞免疫途径,抑制Ⅱ期尘肺病患者Th1 优势,在一定程度上有助于调节Th1/Th2 细胞因子网络功能失衡状态,改善免疫功能。然而,本研究还发现,汉防己甲素片对Th1/Th2 细胞因子网络中的IL-4、IL-10 水平及血清IgM和IgG 含量改善作用不明显,说明该药物对Ⅱ期尘肺病患者体液免疫功能调节作用有限。马冬梅等[14-15]研究报道显示,汉防己甲素片可通过提高CD4+和CD4+/CD8+改善尘肺病患者细胞免疫平衡,而对IgG 等体液免疫指标改善作用并不明显,与本研究结论相似。
综上所述,汉防己甲素片可通过调节细胞免疫,纠正Ⅱ期尘肺病患者Th1/Th2 细胞因子网络功能失衡状恢复免疫功能平衡,改善患者血气及呼吸功能,提高患者生存质量,值得临床推广使用。由于本研究仅为单中心研究,且研究时间较短,纳入研究的病例数量有限,后续有待通过多中心相互合作的研究方式,对汉防己甲素片用于尘肺病治疗的临床疗效和药理学机制进行深入评价和剖析,以期为临床提供借鉴。
