时序释放血管内皮生长因子和转化生长因子β1的功能化生物补片在修复大鼠腹壁部分缺损中的应用
2022-07-29刘正尼郭彦平
刘正尼 郭彦平 汤 睿
应用补片材料修复腹壁缺损是腹壁疝的标准治疗方式[1]。随着生物补片猪小肠黏膜下层(small intestinal submucosa, SIS)在临床应用的增加,专科医师发现其植入后多数新生血管及胶原仅停留在补片表面,故组织重塑不充分造成修复部位力学支撑减弱,导致术后疝复发率较高[2]。有学者认为,在补片制备中引入生长因子,并在补片植入后对其进行活性释放或可改善相关组织内源性再生。补片植入后的初期为急性炎症期,局部持续释放的血管内皮生长因子(vascular endothelial growth factor,VEGF)可促进早期新生血管生成,但对远期力学的促进作用有限。组织进入增殖阶段后,TGF-β1可以诱导成纤维细胞为主的宿主细胞大量长入组织与补片的结合处,增殖、分泌胶原并沉积于交界处,加强该区域的力学强度[3]。进入腹壁重塑阶段后,SIS构成的细胞外基质(extracellular matrix,ECM)逐渐被新生胶原替代,这是一个由边缘修复逐渐向中央区域过渡的重塑过程,若中央区域缺乏有效融合,则ECM 的迅速降解可导致修复失败;而此过程能否顺利完成与 TGF-β1水平密切相关[4]。研究[5]显示,低水平TGF-β1可协同VEGF诱导,加速血管的生成与成熟化。此外,TGF-β1亦是异物植入后重要的免疫调节因子[6]。据此,本课题组将携带 TGF-β1纳米球与 VEGF通过同轴静电纺丝技术纺入丝素(silk fibroin, SF)纤维中形成可时序释放2种因子的SF膜,模拟组织再生过程中的信号有序表达;通过将SF膜嵌入两层SIS中,形成功能化生物补片,以减少SIS植入后的排异反应;并实验性桥接、修补Sprague-Dawley(SD)大鼠的腹壁缺损,加速其成熟血管网络形成和胶原结构重塑;在补片植入28 d后,对模型大鼠进行组织重塑评估;探索VEGF 和TGF-β1在血管成熟化及胶原沉积过程中的表达情况,阐明两者在组织修复过程中的生物学关系。
1 材料与方法
1.1 实验材料与试剂 SIS由本团队制备而成[7]。SF蛋白由浙江省桐乡第二纺丝公司合成。人重组VEGF、TGF-β1、TNF-α和IL-6细胞因子及其ELISA试剂盒均购自美国R&D公司。小鼠单克隆抗体抗血小板-内皮细胞黏附分子(platelet endothelial cell adhesion molecule-1,PECAM-1/CD31)、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、胶原(collagen)Ⅰ和Ⅲ、纤连蛋白(fibronectin)、TGF-β1 抗体均购自美国Abcam公司。小鼠抗CD68+和CD15+抗体购自美国Santa Cruz公司。
1.2 SF膜制备及生长因子释放检测 SF膜制备温度为25~28 ℃,湿度≥60%。将10 μg VEGF溶解于2 mL SF水溶液(质量分数为35%)中作为壳相溶液,含有TGF-β1质量分数为2%的SF纳米球作为核相溶液,分别装载于独立针筒内用于同轴静电纺丝。纺丝针头内径0.8 mm, 外径 2.0 mm,核、壳相推注速度分别为0.4和1.2 mL/h,针尖距离接收装置12 cm,电压维持于18~20 kV。将制备好的SF膜置于真空条件、35 ℃的乙醇蒸汽中处理60 min后在空气中干燥。应用上述方法制备3种携带生长因子的SF膜:携带VEGF的SF膜(VSF膜),携带TGF-β1的SF膜(TSF膜),携带VEGF和TGF-β1的SF膜(VTSF膜)以检测2种因子的释放模式。将200 mg SF膜浸泡于10 mL PBS中匀速震荡(37 ℃, 100 次/min)。每天提取1 mL上清液用于检测,并补充1 mL PBS。通过ELISA试剂盒检测相关SF膜7 d内VEGF及14 d内TGF-β1的释放量,计算2种蛋白质的装载率和累计释放率。将制备好的SF膜嵌于两层SIS间,采用质量分数为5%的SF凝胶粘合各层形成SIS浆膜层朝外的3层结构(即实验用补片)。并将其置于PBS中于 4 ℃下浸泡 2 h,过夜冻干后采用辐照射线消毒(25 kGy; 60Co),储存于-80 ℃备用。
1.3 补片植入及术后处理 根据补片携带生长因子不同,分为VEGF(V组),TGF-β1(T组),VEGF和TGF-β1(VT组)及对照组(不含生长因子)。本研究经同济大学医学院动物伦理委员审查、批准(SYXK2020-0002)。实验流程严格按照实验室动物使用和管理健康指南及术后管理标准(NIH N01-OD-4-2139, Rev.2)进行操作。48只雄性、8周龄SD大鼠,每只250~300 g,购于上海斯莱克国家实验动物种子中心。大鼠术前禁食、禁水6 h,对应相应补片,随机分为4组,每组12只。操作流程:以0.1 mg/g的1%戊巴比妥溶液予大鼠腹腔内注射,术中根据麻醉效果适当增加剂量至0.2 mg/g。取腹壁正中切口,切开皮肤及皮下组织,向两侧钝性分离,显露肌层。在腹直肌外侧切除包含腹外斜肌、腹内斜肌和腹横肌的腹壁肌群,单侧建立3 cm×1 cm的腹壁部分缺损模型,保留腹横筋膜和腹膜完整性。将5 cm×4 cm的4种补片随机植入实验大鼠两侧缺损处,短轴平行于腹白线,补片覆盖缺损边缘1 cm。以3-0普理林线间断缝合、固定补片与缺损边缘肌肉组织,5-0 薇乔线间断缝合皮肤及皮下组织,无菌纱布覆盖伤口。术后将大鼠分笼饲养,观察其活动及进食情况。
1.4 大体观察和组织学分析 术后7、14、28 d分批对大鼠腹腔内注射硫喷妥钠溶液(40 mg/kg),取材样本为植入的补片及其周围0.5 cm的正常组织,以进行大体观察和组织学分析。①记录大鼠手术区域的感染、血肿、血清肿、腹壁膨出和疝的复发情况。②术后第7天,收集各组大鼠腹腔内渗液,离心后检测TNF-α和IL-6水平。③分别采用抗CD15(1∶200)和抗CD68(1∶200)抗体进行免疫组织化学染色,检测中性粒细胞和巨噬细胞水平。④行免疫荧光CD31(1∶100)染色评价植入补片区域的新生血管生成情况,即阳性染色血管数(个)/组织观察区域面积(mm2);抗CD31(1∶100)和抗α-SMA(1∶100)双抗体免疫荧光染色评价成熟血管生成情况,即CD31和α-SMA双抗体染色阳性血管数/CD31染色阳性血管数;每个样本均随机取10个高倍镜视野进行计算;根据文献[8]方法计算血管直径和分类。⑤采用抗胶原Ⅰ(1∶100)、胶原 Ⅲ(1∶100)及抗纤连蛋白(1∶100)抗体行免疫荧光染色,评价补片植入后修复区域的ECM重塑情况;以胶原Ⅰ与胶原Ⅲ的比值评价胶原成熟度。⑥取材补片植入的中央区域行胶原Ⅰ免疫荧光染色,通过双光子激光扫描显微镜进行三维成像分析。数据分析由两位研究员独立应用ImageJ软件进行计算。
1.5 调节蛋白质表达检测 将植入28 d后的组织匀浆处理并提取蛋白质。采用免疫印迹实验检测组织中VEGF、TGF-β1、CD31、胶原Ⅰ(一抗稀释比例分别为1∶500、1∶200、1∶500、1∶1 000)蛋白质水平,以GAPDH(1∶1 000)作为对照计算上述指标的灰度值,定量再生区域相关蛋白质的表达。
1.6 力学性能检测 对植入28 d后的组织取材,剪裁成30 mm × 10 mm条带状用于纵向力学测试。测试指标包含应力-应变曲线、拉伸强度、杨氏模量及断裂伸长。未植入的补片浸入PBS 2 h以维持材料湿态,作为对照组进行上述力学测试。在湿态条件下将样本置于model 5542电子织物强力仪(东华大学),两端夹持长度为10 mm,拉伸速率为10 mm/min直至断裂,计算和记录拉伸过程中相关数据。
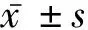
2 结 果
2.1 VEGF和TGF-β1装载率及累计释放率 VSF膜和VTSF膜对VEGF的装载率分别为(33.0±2.2)% 和(35.3±3.8)%,差异无统计学意义(t=1.04,P>0.05),7 d内两种膜的累计释放率为(80.0±4.8)%。TSF膜和VTSF膜对TGF-β1的装载率分别为(51.0±7.5)%和(45.3±5.8)%,差异无统计学意义(t=1.20,P>0.05),14 d内两种膜的TGF-β1累计释放率分别为(39.5±2.6)% 和(32.5±2.3)%,差异无统计学意义(t=4.03,P>0.05)。
2.2 补片植入后大体观察及组织表面纤维化情况 各组补片被植入缺损位置进行桥接修补。观察期间无大鼠死亡及切口感染发生。术后14 d,对照组大鼠出现1例腹壁疝,经解剖发现在补片-组织结合处发生破裂。大体观察显示:术后7 d各组大鼠修复区域组织变薄,呈半透明状(白色虚线标记,图1A~1D);植入V组补片的大鼠在修复区域形成小脓肿(白色箭头所示,图1B),其余补片组未见脓肿形成。术后14 d,与V、T及VT组相比,对照组大鼠的腹壁组织修复程度最小(白色虚线标记,图1E-1H)。术后28 d,对照组大鼠中央区域部分纤维化(黄色箭头所示,图1I-1L)。
2.3 补片植入后宿主组织炎症反应情况 术后7 d,V组的CD15+水平显著高于T组(t=2.82,P<0.05)和对照组(t=2.12,P<0.05),但在术后14、28 d,3组CD15+水平均降低,差异无统计学意义(F=2.00,P>0.05),见图2A。术后7 d,含因子补片(V、T、VT组)的CD68+表达水平显著高于对照组(F=17.60,P<0.05, 图2B);同时间点的TNF-α和IL-6的表达水平均显著高于对照组(F=20.39,P<0.05,图2C;F=87.52,P<0.05, 图2D)。术后28 d,T组和VT组CD68+表达水平均显著低于V组及对照组(F=27.60,P值均<0.05, 图2B),排异反应显著减轻。
2.4 补片植入后组织血管化情况 CD31免疫荧光染色结果显示(图3A),术后28 d,VT组新生血管数量(5.5±0.4)显著多于T组(3.6±0.5,t=4.21,P<0.05)、V组(3.0±0.5,t=4.23,P<0.05)及对照组(2.9±0.4,t=5.93,P<0.05),后3组间的差异均无统计学意义(F=4.85,P>0.05)。CD31与α-SMA双荧光染色合并结果显示(图3B),VT组在术后28 d形成的成熟血管数量较V组[(41.6±5.8)比(27.6±5.2),t=5.83,P<0.05]和T组显著增加[(41.6±5.8)比(24.7±5.00),t=7.26,P<0.05],主要由毛细血管、小静脉和小动脉组成。各组毛细血管数量在成熟血管中占比的差异无统计学意义(F=1.09,P>0.05)。VT组的小动、静脉数量占成熟血管的比例为0.457,均显著高于V组(0.385,t=5.09,P<0.05)和T组(0.326,t=5.09,P<0.05)。VT组的血管成熟度比例最高,为0.65。
A 补片植入术后7、14和28 d取材中央区域新生血管(即CD31阳性染色的血管)数量(n=4, ①P<0.05) B 补片植入术后28 d后取材中央区域成熟血管(即α-SMA/CD31双荧光染色阳性)数量及其血管类型组成统计(n=4, ①P<0.05)
2.5 ECM重塑情况 术后28 d,与对照组及V、T组[(3.0±0.4)]%、(3.3±0.5)%和(4.6±0.6)%]相比,VT组的胶原Ⅰ荧光染色阳性的面积最大为(7.5±0.5)%,差异有统计学意义(F=3.30,P<0.05,图4A)。VT组的胶原Ⅰ/Ⅲ比值为2.1,均显著高于V组、T组和对照组(1.3、1.6、1.0,F=18.57,P值均<0.05,图4B),但仍低于人体腹直肌前鞘的生理数值(7.0)[8]。与对照组相比,V、T、VT组纤连蛋白染色阳性比例均显著增加(P值均<0.05);同时,VT组显著高于V组(t=6.83,P<0.05),与T组间的差异无统计学意义(t=2.67,P>0.05,图4C)。

A 补片植入术后7、14和28 d取材中央区域胶原Ⅰ阳性染色定量分析(n=4, ①P<0.05) B 补片植入术后28 d胶原Ⅰ/Ⅲ比值定量分析(n=4, ①P<0.05) C 纤连蛋白阳性染色定量分析(n=4, ①P< 0.05)。
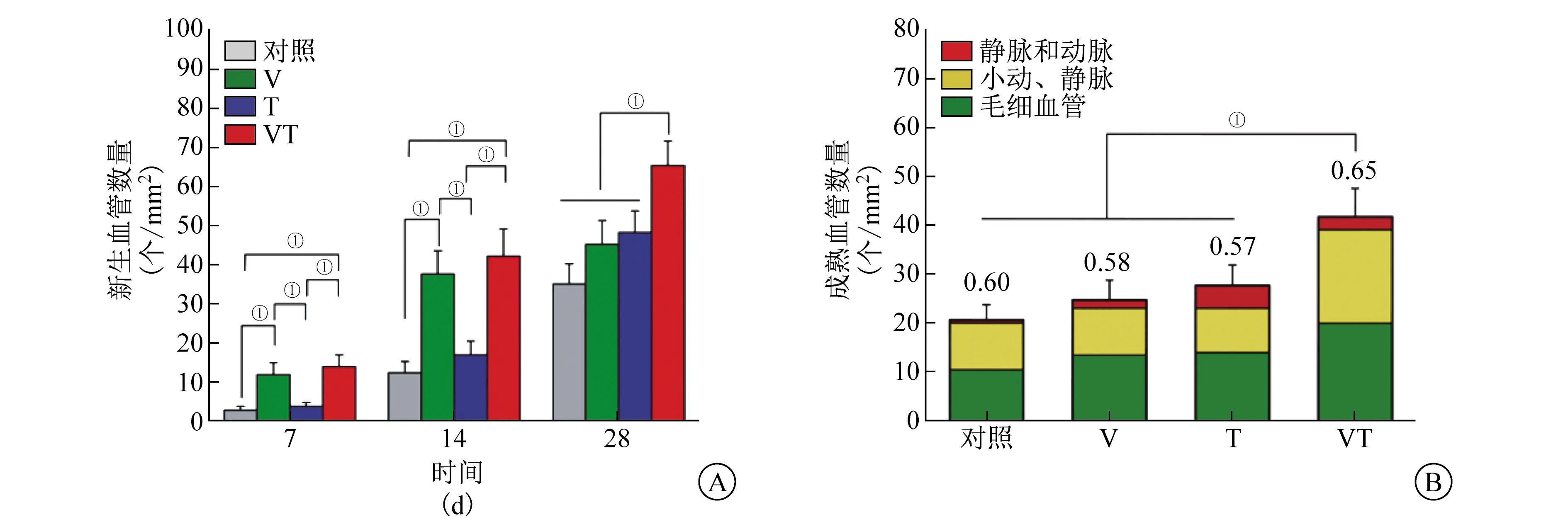
在胶原Ⅰ染色的三维成像中,VT组呈现出大量胶原纤维集中、汇拢成束,相互紧密交织形成有序网状结构,对照组则表现为松散、稀疏紊乱的结构(图5A)。VT组的胶原化体积[(46.9±6.3)×104mm3,t=4.10,P<0.05]和面积[(13.9±1.2)×104mm2,t=3.29,P<0.05]均显著高于对照组[(14.3±4.5)×104mm3和(8.8±0.6)×104mm2](图5B、5C)。表明VT组形成了更稳固的ECM重塑,有利于抵抗动态腹内压的力学支撑。
A~C 补片植入术后28 d取材中央区域的胶原Ⅰ染色(绿)三维成像示意图及比较分析(n=4, ①P<0.05)
2.6 调节蛋白质的表达水平 术后28 d,除TGF-β1外,V、T、VT组的蛋白质水平均显著高于对照组(P值均<0.05,图6)。V组VEGF蛋白质水平(0.30±0.03)显著高于T组(0.13±0.01,t=10.48,P<0.05),V组CD31蛋白质水平(0.22±0.03)与T组(0.15±0.02)的差异无统计学意义(t=0.42,P>0.05)。T组TGF-β1(0.23±0.02)及胶原Ⅰ(0.42±0.05)蛋白质水平均显著高于V组[(0.09±0.01)、(0.24±0.03),P值均<0.05]。基于VEGF和TGF-β1的协同作用,VT组的CD31和胶原Ⅰ的蛋白质表达水平均显著高于V、T和对照组(P值均<0.05)。

1 V组 2 VT组 3 T组 4 对照组 A、B 补片植入后28 d不同补片取材组织中相关蛋白质的表达示意图及定量分析,其中CD31和胶原Ⅰ以GAPDH为基准计算灰度值(n=4, ①P<0.05)
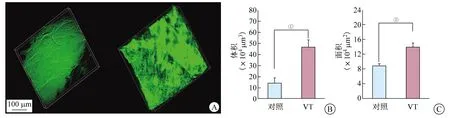
2.7 力学性能比较 T组和VT组应力-应变曲线形态相似,而VT组的拉伸强度高于V组(t=8.53,P<0.05)和对照组(t=8.26,P<0.05,图7A、7B)。较V组和对照组,T组和VT组分别具有更高的杨氏模量和更低的断裂伸长率(P值均<0.05,图7C、7D)。
A 应力-应变曲线(n=4) B 拉伸强度(n=4, ①P< 0.05) C 杨氏模量(n=4, ①P< 0.05) D 断裂伸长率(n=4, ①P< 0.05)
3 讨 论
与传统组织间缝合的修补法相比,应用补片修补腹壁疝术后患者疾病复发率显著降低[8]。补片的作用是恢复腹壁形态、提供足够的力学支撑以对抗腹内压。SIS是一种无免疫原性、富含胶原的脱细胞基质。在植入宿主体内后,需要通过诱导组织融合和重塑以替代原修补材料,从而提供力学支撑[9]。在前期研究[10]中,本团队发现,未交联的双层SIS在植入术后2周因快速降解力学强度降至最低;因其重塑发展缓慢,术后4周力学强度才逐渐开始回升。在此过程中,一旦原先结构崩塌,组织内源性再生不足将导致修复失败。
组织的修复及再生是一个需要多种细胞因子和生长因子等信号分子时序参与的复杂、有序过程。释放外源性生长因子有利于细胞与基质间的信息传递,加速引导新生胶原沉积和组织结构重塑,从而加强修复区域的力学支撑。对于组织再生而言,时序释放具有协同性的两种生长因子可减少单一因子的用量,缩短修复和再生过程,避免因不规律地突释因子所造成的不良修复结局[11]。生长因子的导入和控释需要相关载体,采用静电纺丝技术可以制备适用于活性蛋白的装载和释放的多层结构。核层材料可通过包封的方式保护蛋白活性。壳层材料不仅可以延缓核层蛋白的释放,同时也可以装载活性蛋白,从而实现多种活性蛋白的时序释放,为SIS的功能化改性提供技术支持[12]。
补片植入后的宿主融合是一个复杂但有序的过程。突释VEGF可引起急性炎症反应激发明显的中性粒细胞浸润,其促炎作用是通过增加内皮细胞通透性,促进内皮细胞黏附分子表达,并作为单核细胞趋化因子募集白细胞而实现[13-14]。但在植入初期,所有含因子补片均可产生明显的免疫排异反应。一方面原因是,VEGF会加重SIS植入后的排异反应;另一方面则为,TGF-β1纳米球通过胞吞作用被巨噬细胞吞噬,因而募集和激活更多巨噬细胞,并随多核异物巨细胞形成激发免疫排异反应[15]。在本研究中,补片植入后初期TNF-α和IL-6的高水平状态也是由上述因子通过促炎巨噬细胞的极化作用所致。但是,T组和VT组在术后28 d的排异反应均已显著减轻。表明TGF-β1作为抗炎细胞因子和巨噬细胞调节因子,发挥了有效抑制炎症与减轻组织排异反应的作用。
VEGF可间接促进胶原分泌[16]。而对于TGF-β1在血管形成方面的作用仍存争议。有学者发现抑制内源性TGF-β信号可增加内皮细胞增殖和血管生成,而另一些学者的结论则恰恰相反[17-18]。有研究[19]发现,促进或抑制血管形成的信号转换取决于TGF-β水平,以及在内皮细胞上的受体及激活的信号通路类型。在完成促血管反应时,信号分子的类型和细胞间的交互作用比因子的携带量更为重要。在本研究中,VTSF膜的VEGF达到早期、快速释放,TGF-β1形成持续、缓慢释放。每张VTSF膜含VEGF 700 pg/mg, 可促进血管内皮细胞迁移、增殖和血管生成;而VTSF膜含TGF-β1与VEGF量之比被限制在1∶25,以利于形成低浓度持续表达TGF-β1的协同作用。两者的时序释放相比单一释放更有利于CD31和胶原Ⅰ的表达,加强了VEGF的促血管作用,并通过调节ECM重塑形成更为稳定和强韧的结构。但VT组的力学强度仍低于人体腹直肌前鞘的生理数值(7.0)[20]。相反,单一突释VEGF在管生长和成熟方面作用显著。
综上所述,本研究结果表明,时序释放VEGF和TGF-β1两种因子的功能化补片比单独释放VEGF或TGF-β1补片具有更多的成熟血管生成及更好的组织结构重塑,相比单独释放VEGF补片可提供更强的力学支撑。在初期释放VEGF后持续释放TGF-β1,将有助于血管生成和血管成熟;而初期释放VEGF亦有助于TGF-β1促进胶原沉积和成熟。因此,利用活性因子的协同效应或可改善生物补片的修复效果,更有助于后续相关补片内在生物化学机制的探索。
