MCP-1、IL-10、SA联合检测对儿童急性上呼吸道感染诊断和疗效评估价值*
2022-07-29李小明黎小年
李 欣,李小明,黎小年,林 杰
海南省妇女儿童医学中心儿科综合内科,海南海口 570206
在小儿上呼吸道感染疾病中,细菌及病毒的感染最为常见,其中主要以病毒感染最为常见[1],流行病学调查显示[2],由于病毒造成的上呼吸道感染的比例可高达90%以上,患儿主要表现为发热、咳嗽及鼻塞流涕。但是在疾病的进展过程中,疾病的早期缺乏特异的临床指标,近年来,对于上呼吸道感染疾病治疗中,多采用多种抗菌药物的联合治疗[3],极易造成患儿的抗菌药物滥用,所以在对患儿的治疗效果的预测分析中,及时有效对患儿治疗效果进行预测,及时开展多种治疗对于患儿的预后具有积极的意义。血清单核细胞趋化蛋白-1(MCP-1)是局部病灶的炎性反应水平变化的重要指标,白细胞介素(IL)-10是内皮损伤的重要指标,血清唾液酸(SA)是重要的免疫指标[4],本研究主要通过MCP-1、IL-10、SA联合检测对儿童急性上呼吸道感染诊断和疗效评估价值分析,为临床诊断提供科学依据。
1 资料与方法
1.1一般资料 本研究采用前瞻性研究,选取2018年12月至2020年12月在本院诊断为上呼吸道感染患儿120例(观察组)作为研究对象,其中男66例、女54例,年龄4~7岁、平均(6.09±2.06)岁,体重指数平均为(20.36±2.55)kg/m2,按照威斯康辛上呼吸道症状调查(WURSS)-21评分[5],将研究对象分为轻度、中度及重度。另选取同期在本院进行体检的健康儿童120例作为对照组,两组一般资料比较差异无统计学意义(P>0.05),见表1。所有研究对象均签署知情同意书,并经伦理委员会论证通过。

表1 两组一般资料比较
入选标准:(1)所有患儿均符合呼吸道感染诊断标准[6];(2)年龄4~7岁;(3)青霉素皮试为阴性。排除标准:(1)合并全身其他部位感染;(2)入组前已采取抗菌药物治疗;(3)免疫缺陷;(4)依从性较差。
1.2方法 血清学指标分析:于入组后清晨空腹抽取外周静脉血5 mL,3 000 r/min离心10 min取上清,-80 ℃储存。采用化学发光法对患儿的MCP-1、IL-10、SA指标进行检测,检测试剂均由上海罗氏提供,检测流程严格按照说明书进行。
1.3观察指标 (1)两组MCP-1、IL-10、SA水平比较。分别对观察组及对照组的MCP-1、IL-10、SA水平进行比较。(2)不同严重程度观察组MCP-1、IL-10、SA水平比较。分别对观察组轻度、中度及重度患儿MCP-1、IL-10、SA水平进行比较。(3)不同治疗效果患儿MCP-1、IL-10、SA水平比较。所有患儿均采取哌拉西林/他唑巴联合阿奇霉素进行治疗,根据文献[7]标准,患儿的临床症状全部消失则为痊愈,患儿的临床症状及体征显著改善则为有效,患儿的临床症状及体征好转则为进步,患儿的临床症状及体征未见好转或进步则为无效。分别对总体有效与无效患儿MCP-1、IL-10、SA水平进行比较。(4)MCP-1、IL-10、SA联合检测对上呼吸道感染及治疗效果的诊断效能。灵敏度=真阳性例数/(真阳性例数+假阴性例数)×100%;特异度=真阴性例数/(真阴性例数+假阳性例数)×100%;符合率=(真阳性例数+真阴性例数)/总例数;阳性预测值=真阳性例数/(真阳性例数+假阳性例数);阴性预测值=真阴性例数/(真阴性例数+假阴性例数)。
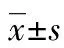
2 结 果
2.1两组MCP-1、IL-10、SA水平比较 观察组MCP-1、IL-10、SA水平显著高于对照组,差异有统计学意义(P<0.05)。见表2。

表2 两组MCP-1、IL-10、SA水平比较
2.2不同严重程度观察组MCP-1、IL-10、SA水平比较 不同严重程度观察组MCP-1、IL-10、SA水平比较差异有统计学意义(P<0.05),通过两两比较,观察组随着疾病的进展MCP-1、IL-10、SA水平显著升高,见表3。

表3 不同严重程度观察组MCP-1、IL-10、SA水平比较
2.3不同治疗效果患儿MCP-1、IL-10、SA水平比较 治疗有效患儿的MCP-1、IL-10、SA水平显著低于治疗无效患儿,差异有统计学意义(P<0.05),见表4。

表4 不同治疗效果患儿MCP-1、IL-10、SA水平比较
2.4MCP-1、IL-10、SA联合检测对上呼吸道感染及治疗效果的诊断效能 观察组MCP-1、IL-10、SA联合检测对上呼吸道感染及治疗效果的特异度显著高于单独检测,见表5。

表5 MCP-1、IL-10、SA联合检测对上呼吸道感染及治疗效果的诊断效能
2.5ROC曲线分析 通过ROC曲线分析,MCP-1、IL-10、SA联合检测对于上呼吸道感染的诊断及治疗效果的曲线下面积显著高于单独检测,针对上呼吸道感染的诊断,观察组MCP-1、IL-10、SA临界值分别为211.26 pg/mL、75.39 pg/mL及812.65 mg/L,针对治疗有效患儿,MCP-1、IL-10、SA临界值分别为195.33 pg/mL、70.03 pg/mL及799.56 mg/L,见表6、图1。

表6 ROC曲线分析

续表6 ROC曲线分析

注:A为各指标对于上呼吸道感染诊断的ROC曲线分析;B为各指标对于上呼吸道感染治疗效果的ROC曲线分析。
3 讨 论
急性呼吸道感染是临床较为常见的疾病之一,流行病学调查显示,在儿科门诊当中,急性呼吸道感染的门诊比例可达到60%以上,在季节更替的过程中,其发病呈现显著的上升趋势,疾病造成的并发症较多,严重影响患儿的生命安全[8]。目前对于上呼吸道感染患儿的诊断存在一定的局限性,分析其原因认为,患儿无法合理表达诉求,检查较为困难,血常规检查虽然能对上呼吸道感染患儿的有一定的参考价值,但是其诊断的特异度较差[9]。在临床对于上呼吸道感染患儿通过病原学的诊断可作为诊断的金标准[10],但是该项检查较为繁琐,且检测时间较长,并不能成为临床诊断的首选。
MCP-1是人体趋化因子的重要指标,通过对肺泡细胞或者支气管细胞分泌趋化活性物质的调节,通过对患儿可趋化单核巨噬细胞及T淋巴细胞的可控性调节,增强患儿在趋化活性物质吞噬作用及因此产生的诸多炎性因子[11],通过对炎性因子的合理调节,促进患儿的受损组织的恢复,在氧化应激反应过程中,局部病灶部位的内皮功能显著得到破坏,以及促进了机体的疾病进展。钟峰等[12]通过对呼吸道感染患儿血清MCP-1水平的分析,随着疾病的进展,患儿MCP-1水平呈现上升的趋势。IL-10主要是由单核巨噬细胞、成纤维细胞、血管内内皮型细胞及T细胞、B细胞共同产生[13],IL-10作为多种生活活性的细胞因子,与其他细胞因子共同构成了较为复杂的细胞因子网络,同时也有研究报道显示,IL-10可通过对患儿的T细胞产生细胞因子的显著的负性调节作用,进一步降低患儿的免疫功能,促进疾病的进展。而本研究中,随着疾病的进展,患儿IL-10呈现显著的上升趋势,李春等[14]通过对0~3岁上呼吸道感染患儿的诊断中,随着疾病的进展,患儿IL-10呈现显著的上升趋势,与本研究结果一致。SA主要是存在于真核细胞及原核细胞中,其主要通过对细胞分析的修饰作用,进一步参与疾病的进展。以往的研究多将SA水平的异常多与心血管及炎性反应相联系,在生物学的研究中,SA水平与细菌的营养学及细胞的构成相互作用,有一些细菌可通过对SA的内源性形成作用,共同能够参与细菌的营养供给,同时在细菌的生物合成,进一步对细菌的结构合成及修饰作用,以及促进机体的疾病进展,随着上呼吸道感染疾病的进展,细菌或者病毒造成的外毒素及内毒素对于机体的靶器官可造成较为严重的损伤,在机体的防御机制下,巨噬细胞在对细菌进行吞噬的作用下,大量的SA释放入血,进一步造成患儿血清SA水平的升高。苏艳等[15]在对呼吸道感染患儿进行研究发现,随着疾病的进展,患儿SA呈现显著的上升趋势,与本研究结果一致。通过对患儿的联合检测,3种指标的联合检测对于治疗效果及诊断具有重要的意义,分析认为,在疾病的进展中,通过对患儿的免疫功能、炎性因子及病原学的修饰作用的联合诊断,对于患儿的诊断及治疗效果的评价具有重要的意义。
综上所述,MCP-1、IL-10、SA联合检测对儿童急性上呼吸道感染诊断和疗效评估具有重要价值,特异度较高,建议临床推广。
