铁活化过硫酸盐降解水中污染物的研究进展*
2022-07-29黄剑,王良
黄 剑 ,王 良
(东北石油大学 化学化工学院,黑龙江 大庆 163318)
随着科技的进步,环境污染问题也愈加严重,处理水中污染物成为了人们的研究热点。传统的高级氧化技术其机理主要依赖于羟基自由基(·OH),虽然对污染物表现出良好的去除性能,但仍存在能耗高和降解能力有限等问题。

1 氧化体系状态及作用机理
铁作为一种环境友好、廉价、无毒的过渡金属元素,已被广泛应用于活化过硫酸盐降解各种水中污染物。近些年来,铁材料在活化过硫酸盐方面的应用已经从均相扩展至非均相体系,从合成铁氧化物扩展至天然铁矿物质。对各种氧化体系的作用机理进行研究将有利于选择合适的氧化体系,从而对污染物实现最大程度的降解。
1.1 均相体系
1.1.1 亚铁离子

(1)
(2)
(3)

(4)
为了最大限度地减少自由基清除作用并提高均相活化过程的效率,一种常用的方法是对PS/PMS和Fe2+采用适当的物质的量比。正如Wang等[2]发现,1∶1的比率可能是Fe2+/PS和Fe2+/PMS体系的最佳物质的量比。另一个有效的方法是将Fe2+的投加方式从一次性投加改为逐渐投加,这样可以减少副反应的发生。Ayoub等[3]发现,与一次性添加相比,反应过程中逐渐添加Fe2+虽然在前10 min对磺胺甲恶唑(SMX)的去除率较低,但是反应2 h后可使SMX的去除率提高一倍。
1.1.2 铁离子
Fe2+的低稳定性限制了Fe2+/过硫酸盐体系在高级氧化技术中的应用。据报道,Fe3+比Fe2+更稳定,因为Fe2+很容易被氧化成Fe3+。单独的Fe3+不能像Fe2+一样直接活化过硫酸盐产生自由基,研究表明,PMS可以与Fe3+反应,生成的Fe2+可以活化过硫酸盐,产生自由基降解污染物,见式(5)[4]。此外在某些有机物如醌类化合物存在或电场的条件下,Fe3+也可以还原为Fe2+。目前对Fe3+活化过硫酸盐的研究较少,主要是在不加其他还原剂或电场的条件下,Fe3+很难被还原为Fe2+。
(5)
虽然利用氧化剂和有机化合物导致的Fe2+再生可以提高降解效率,但是整个过程相当缓慢。Fe3+在系统中的积累不仅会导致反应速率的下降,而且由于其溶解度较低还会形成沉淀。在这种情况下,可以通过引入螯合剂或还原剂提高PS/PMS的活化效率。目前为止,已经报道了用于该功能的各种材料,包括乙二胺四乙酸(EDTA),(S,S)-乙二胺-N,N-二琥珀酸三钠盐(EDDS),柠檬酸(CA)和草酸(OA)等[4]。Han等[5]报道,在CA、OA和EDDS中,CA具有中等螯合能力,可以通过其分子结构产生的空间位阻效应降低Fe2+的可及性,从而提高PS的活化效率,这使得其成为最合适的螯合剂。然而,降解效率提高的同时也可能会因为引入其他试剂而对系统产生一些不利影响。例如,腐殖酸(HA)可以与自由基反应,这可能会导致自由基与目标污染物发生竞争[6]。因此,应该谨慎选择和添加螯合剂或还原剂。
1.2 非均相体系
1.2.1 零价铁


(6)
(7)
(8)
(9)

(10)

(11)

(12)
在Fe0/过硫酸盐体系中,通过Fe0表面溶解生成Fe2+的速度取决于Fe0的粒径大小。研究表明,合适的粒径可以促进Fe0表面Fe2+的释放。通常,粒径越小,比表面积越大,反应性越高。反应过程中产生的腐蚀产物可能对过硫酸盐的活化产生一定的抑制作用,这可能是因为表面形成的铁(羟基)氧化物无法有效活化过硫酸盐,并阻碍Fe0晶核与溶液的直接接触。Kim等[8]报道在Fe0活化PS的过程中,由于受到Fe3+和在Fe0外壳上形成的铁(羟基)氧化物的影响,Fe0的消耗速度减慢,PS的活化效率也大大降低。然而,也发现了腐蚀产物的一些促进作用。Cao等[9]观察到,在Fe0/PMS体系中,沉积在Fe0表面的腐蚀产物会激活PMS或直接吸附污染物。
1.2.2 含铁矿物
自然界中存在的铁矿物较多,主要存在于地球表面。这些矿物价格低廉且易获得,因而也被用作过硫酸盐的活化剂。在活化过硫酸盐的研究中,针铁矿[FeO(OH)]、赤铁矿(Fe2O3)、磁铁矿(Fe3O4)和黄铁矿(FeS2)等是主要的研究形式[4]。当电子从铁矿物转移到过硫酸盐时,需要通过一个较宽的禁带,导致其难以高效地活化过硫酸盐。然而,铁矿物对电子的传递效率较低,对Fe2+的淬灭效应可以产生一定的抑制作用,使其成为活化过硫酸盐去除污染物的极佳候选物。
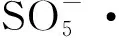
2 铁活化过硫酸盐降解水中污染物的影响因素
作为一种新型的高级氧化技术,铁活化过硫酸盐体系在降解水中污染物领域展现出了独特的优势和应用前景,但是,各种因素包括过硫酸盐的浓度、溶液pH值、反应温度和阴离子等,都会对体系中过硫酸盐的活化和污染物的降解产生影响。深入了解各种因素对反应过程的影响将有利于开发出更加高效的高级氧化体系用来降解各种水中污染物。
2.1 过硫酸盐的浓度

2.2 溶液pH值

2.3 反应温度
反应温度会在很大程度上影响反应过程的进行,温度升高可以促进溶液中的分子热运动,加速过硫酸盐自身的热活化,同时也会使催化剂活化过硫酸盐的速度加快,从而提高反应速率。Yao等[17]发现在Fe0/PMS体系中,高温极大地促进了双酚M(BPM)的降解。在t=50 ℃,经反应90 min后,BPM被完全去除,t=25 ℃时只有56.0%的BPM被去除。一般情况下,随着温度的升高,有机污染物的降解速率相应提高,但并不是所有的体系都是相同的情况。Gao等[9]研究发现,温度的升高会导致自由基之间的淬灭作用,从而影响四环素(TC)的降解速率。t=30~60 ℃时,TC的最终去除率由88.5%降低到75.9%。因此,对于不同的反应体系,要根据催化剂类型、氧化剂稳定性和处理成本选择适宜的反应温度。
2.4 阴离子


(13)
(14)

(15)

(16)
(17)
(18)

(19)
(20)
(21)

(22)
(23)
(24)
(25)
(26)
(27)
3 结束语
过硫酸盐由于氧化还原电位高、成本低、环境友好等优点被认为是降解有机污染物的高级氧化剂,特别是被各种过渡金属活化生成高活性自由基时。铁是第四丰富的无毒金属,能有效地以均相和非均相的方式活化过硫酸盐。但作为一种新型的高级氧化技术,结合目前的研究现状,铁活化过硫酸盐氧化技术仍有许多问题尚未解决,在今后的工作中,以下4个方面值得进一步研究。
(1)反应体系中,铁泥的产生是不可避免的,处理不当可能会造成环境的二次污染,将初始铁物种的损失最小化,充分利用铁泥的剩余反应性成为研究重点。此外,Fe2+容易被氧化成Fe3+,避免氧化过程的发生,提高过硫酸盐的利用率也是重中之重;
(2)不同的铁材料对过硫酸盐表现出了不同的活化效率,具有复杂分子结构的新型有机污染物不断出现,根据污染物的性质及各种实际情况选择合适的铁活化过硫酸盐体系,成为铁活化过硫酸盐氧化技术在应用中的关键问题;
(3)目前为止,大多数研究都只是停留在实验室阶段,对于实际废水的处理需要进行更多的研究,并开发相关配套的技术手段,推进铁活化过硫酸盐氧化技术的实际应用;
(4)目前对各种铁材料的安全性评价和生态毒理学效应的研究还不够。在污染物降解方面,有必要加强对目标污染物降解后副产物的水环境毒性研究。
