板栗淀粉的提取工艺优化及其性质分析
2022-07-29张增江王竹朱俊超陈玲李晓玺郑波
张增江,王竹,朱俊超,陈玲,李晓玺,郑波
(华南理工大学食品科学与工程学院,广东省天然产物绿色加工与产品安全重点实验室,华南理工大学淀粉与植物蛋白深加工教育部工程研究中心,广东广州 510640)
板栗(Castanea mollissimaBL.)隶属于壳斗科,是我国重要的经济林果作物,在中国有六千多年的栽培历史[1,2]。板栗果实含淀粉35%~50%、蛋白质7%~10%、脂肪4%~5%、总糖10%~15%以及多种维生素和磷、钾、钙、镁、铁等微量元素[3],具有预防高血压、骨质疏松和延缓衰老等功效[4,5]。虽然板栗营养成分丰富,但由于加工技术较为落后,高附加值产品少,因此对其保健功能仍有很大的开发利用空间[6,7]。近年来,随着板栗产量的逐年增加以及板栗精深加工技术的发展,加工后的板栗制品容易被人体消化吸收导致血糖急剧上升,同时板栗制品易老化导致货架期较短的缺点逐渐暴露。淀粉作为板栗仁的主要营养物质,极大地影响着板栗相关制品的品质和应用范围。可见,调控淀粉性质和消化性能与板栗及其制品的加工品质与营养特性关系密切,研究淀粉的性质如膨胀溶解性、热性质、糊性质、回生可为板栗及板栗淀粉性质的深入研究奠定基础。如何高效从板栗中提取淀粉并对其性质进行研究,有助于提高板栗及其相关制品的附加值和开发利用空间,为后续板栗相关制品的开发与创制提供高效方法。
目前淀粉的提取方法主要有碱法、酶法和表面活性剂法等。碱法和酶法是利用碱或酶的作用将与淀粉结合的蛋白质和纤维素等成分水解,进而释放淀粉,提高淀粉的得率。研究表明碱法提取淀粉会降低淀粉中直链淀粉的分子量,并增加淀粉的吸水性和膨胀度[8]。表面活性剂法是利用烷基苯磺酸钠等表面活性剂与蛋白质结合,使得蛋白质变性形成络合物从而与淀粉分离,达到提取淀粉的目的[9]。然而目前利用三种方法对板栗淀粉进行提取的对比研究暂未见报道。板栗熟化后口感细腻,甘甜且有风味,受到广泛大众的喜爱,但熟化后的板栗具有更高含量的快消化淀粉,容易被人体消化,引起高血糖应答,不利于人体的健康。Pizzoferrato 等[10]对欧洲板栗分析中发现熟化的板栗淀粉中具有较高的快消化淀粉(RDS),抗性淀粉(RS)含量却很低。Zhang 等[11]对九个品种的板栗淀粉进行分析得出了类似的结果,糊化之后的板栗淀粉RDS 含量很高,达到79.60%~89.50%,而RS 含量仅为7.10%~17.40%。由此可知,深入了解板栗淀粉的性质,可为拓宽板栗淀粉的应用以及推动我国板栗产业的发展提供基础数据。
本研究通过酶法、表面活性剂法和碱法三种提取方法对板栗淀粉进行提取,获得适合板栗淀粉的提取方法并对提取工艺进行优化,以期建立板栗淀粉的高效提取方法。进一步通过最佳提取工艺方法提取三个品种的板栗淀粉并对其性质进行对比研究。研究结果可为板栗淀粉的高值利用和板栗产业的发展提供基础数据。
1 材料与方法
1.1 材料与仪器
油榛板栗、东岳早丰板栗和大峰板栗,食品级;碱性蛋白酶(30 U/mg),食品级,河南万邦实业有限公司;氢氧化钠,天津科密欧化学试剂有限公司;烷基苯磺酸钠、硫酸钾,天津市致远化学试剂有限公司;石油醚,天津市富宇精细化工有限公司;硫酸,北京化工厂;硼酸、盐酸,广州化学试剂厂;硫酸铜,天津市化工三厂有限公司;甲基红、溴甲酚绿,天津市天新精细化工开发中心。所有试剂均为国产分析纯。
JYL-Y15 破壁打浆机,九阳股份有限公司;DF-101S 集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司;TDZ5-WS 离心机,湘仪离心机有限公司;HH-1 数显恒温水浴锅,常州澳华仪器有限公司;8400 凯氏定氮仪,上海瑞玢国际贸易有限公司;SOI406 索氏提取仪,济南海能仪器股份有限公司;DHS20-1 快速水分测定仪,德国Sartorius 公司。
1.2 试验方法
1.2.1 淀粉提取工艺的筛选
本研究以油榛板栗为例进行提取工艺的筛选,参照孔露等[12]的方法将新鲜板栗去壳后,称取300 g 果实研磨粉碎,并通过运用索氏抽提法使用石油醚抽提6 h 以除去脂肪,将脱脂后的板栗淀粉按照1:4(g/mL)的料液比加入蒸馏水。
a) 碱法:加入3 g NaOH,搅拌均匀后放置在冰箱中冷藏24 h。
b) 酶法:加入0.6 g NaOH,搅拌均匀后放置在40 ℃恒温水浴锅中恒温30 min 后,加入0.9 g 碱性蛋白酶,恒温水浴锅中40 ℃酶解2 h。
c) 表面活性剂法:加入0.6 g 烷基苯磺酸钠固体,搅拌均匀后放置在冰箱中冷藏24 h。
将料液过4 层纱布过滤,收集滤液,以转速4000 r/min 离心5 min,用勺子去除上层杂质,加250 mL去离子水水洗并离心,重复洗涤3 次。加无水乙醇250 mL 醇洗并离心(4000 r/min)两次,再用无水乙醇抽滤后,烘箱中50 ℃干燥20 h,装袋保存。
1.2.2 酶法提取淀粉的单因素实验
1.2.2.1 不同酶解时间对淀粉提取率的影响
参照孔露等[12]的方法,以60、90、120 和150 min酶解时间为变量,研究不同酶解时间对淀粉提取率的影响。
1.2.2.2 不同酶用量对淀粉提取率的影响
参照孔露等[12]的方法,以0.10%、0.20%、0.40%、0.60%和0.80%酶用量为变量,研究不同酶用量对淀粉提取率的影响。
1.2.2.3 不同酶解温度对淀粉提取率的影响
参照孔露等[12]的方法,以30、40、50 和60 ℃的酶解温度为变量,研究不同酶解温度对淀粉提取率的影响。
1.2.3 酶法提取板栗淀粉的响应面实验
依据单因素实验结果及响应面实验设计基本原理筛选出合适的因素水平范围,并以酶解时间、酶用量和酶解温度为变量,淀粉提取率为响应值,探究不同实验因素对板栗淀粉提取率的影响,确立酶法提取板栗淀粉的最佳实验条件,并通过对响应面结果进行验证确立最佳实验条件。响应面实验因素水平设置如表1 所示。
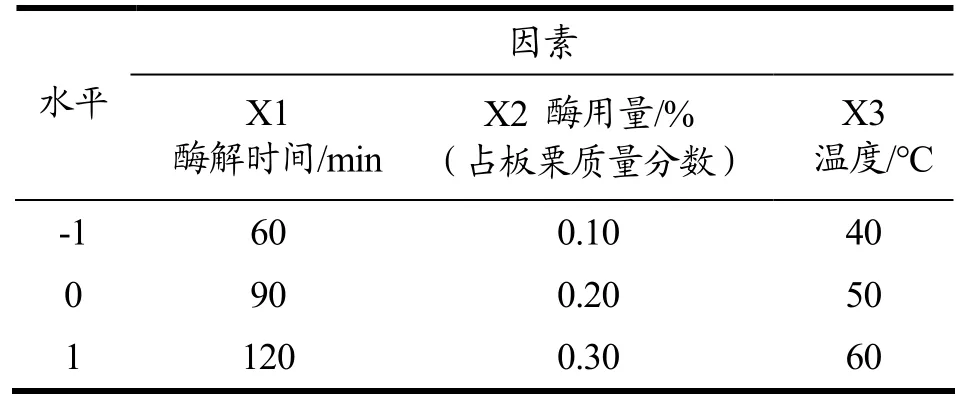
表1 响应面实验因素与水平Table 1 Factors and levels of response surface methodology
1.2.4 试验指标测定方法
1.2.4.1 提取率计算
按公式1 对板栗淀粉提取率进行计算
其中:
G——淀粉提取率;
Mi——淀粉质量;
M0——板栗质量;
C0——板栗中淀粉含量。
1.2.4.2 水分含量测定
取约1 g 淀粉置于铝制托盘中铺平,通过105 ℃加热的方法使用快速水分含量测定仪测定样品水分含量。
1.2.4.3 脂肪含量测定
根据GB 5009.6-2016 和楚屹然等[13]方法稍加修改,对铝杯进行高温干燥恒重处理,准确称量其质量,精确到0.01 mg。准确称取均匀样品2~5 g(精确到0.01 mg),装入滤纸筒内,折叠好滤纸筒转入滤纸筒架,在铝杯内加入50 mL 石油醚进行加热抽提5 h。蒸去铝杯中剩余石油醚,高温干燥至恒重后准确称量其质量,精确到0.01 mg。
1.2.4.4 蛋白质含量测定
根据GB 5009.5-2016 方法[14],准确称取试样2 g(精确到0.01 mg),带滤纸包移入消化管中。往其中加入0.20 g 硫酸铜、6 g 硫酸钾和10 mL 浓硫酸。将消化管移入消化炉消化4 h,消化完成后继续加热0.5 h,取下放冷。使用自动凯氏定氮仪对样品进行蒸馏,取蒸馏液体使用0.01 mol/L 盐酸进行滴定,计算蛋白质含量。
1.2.4.5 理化性质的测定
参照李梁等[15]的方法,对板栗淀粉的溶解度、膨胀度和冻融稳定性进行测定。准确称取一定量的淀粉,配置成质量分数5%的淀粉乳,在50 ℃下水浴加热并搅拌20 min,再以4000 r/min 离心20 min,分离上清液和下层沉淀物,将上清液烘干至恒重,称重为m1,按式(2)计算其溶解度S。离心管中沉淀物质量m2,按式(3)计算其膨胀度B。
式中:
m1——上层清液烘干恒重后的质量,g;
m——淀粉的干重,g;
m2——离心后下层沉淀物的质量,g。
将质量分数3%的淀粉乳放置在沸水浴中加热糊化并持续保温15 min,使淀粉糊保持体积不变,再将其冷却至室温,放置在冰箱中冷冻24 h 后取出,在自然条件下解冻,再放置在冰箱中冷冻,重复上述操作1 次,解冻后,以4000 r/min 离心15 min(若无水析出,继续反复冻融,直到有水析出为止),称取沉淀物质量,按式(4)计算析水率。
式中:
m3——淀粉糊的质量,g;
m4——沉淀物的质量,g。
1.2.4.6 板栗淀粉消化性能的测定
参照刘坤等[16]的方法,通过使用5 mL 猪胰α-淀粉酶和葡萄糖苷酶混合酶对1 g 干基淀粉进行酶解,在充分反应20 min和120 min后分取0.5 mL反应液于20 mL 70%的乙醇水溶液中进行灭酶,并使用GOPOD试剂盒测定酶解液中葡萄糖含量以计算淀粉的消化性能。
式中:
At——测试溶液的吸光值;
Vt——测试溶液的总体积,mL;
C——标准浓度,mg 葡萄糖/mL;
D——稀释倍数;
As——标准葡萄糖的吸光值;
Wt——样品的质量,g。
式中:
G20、G120——酶水解20 min、120 min 后的总葡萄糖含量;
FG——酶解处理前样品中葡萄糖含量(以0 计);
TS——总淀粉质量,g。
1.3 数据处理
本研究采用Excel 2019 软件建立数据库,所有数据均用X±SD 表示,采用SPSS 22 对数据进行单因素方差分析(one-way ANOVA)统计分析,组间比较采用Duncan 法,p<0.05 为差异有统计学意义,采用Design-Expert 软件进行响应面设计。
2 结果与讨论
2.1 不同提取方法的板栗淀粉提取率
由表2 可以得出,对同一品种板栗,酶法的提取率为92.11%,远高于碱法(64.27%)和表面活性剂法(78.45%),可以推断碱性蛋白酶在一定条件下对于板栗中蛋白的分解作用高于碱和表面活性剂对板栗中蛋白的分离作用,能较为高效地提取板栗中的淀粉,因此选取酶法进行单因素和响应面实验进行优化。

表2 不同提取方法的板栗淀粉提取率Table 2 Crude extraction rate of chestnut starch by different extraction methods
2.2 酶法提取淀粉的单因素实验结果
2.2.1 不同酶解时间对板栗淀粉提取率的影响
由图1a 可以看出,在酶解条件为板栗100 g,料液比1:4(g/mL)、酶用量0.40%、酶解温度40 ℃时,当酶解时间处于90 min 附近时,提取率最大,当酶解时间超过90 min 后,板栗淀粉提取率略有下降。这可能是因为淀粉颗粒中的结合蛋白在90 min 内被蛋白酶完全水解,由于氢氧化钠的存在会对淀粉起到微弱的降解作用,延长反应时间致使淀粉含量下降,淀粉提取率有所降低[9]。
2.2.2 酶用量对于板栗淀粉得率的影响
图1b 可以看出,在酶解条件为板栗100 g,料液比1:4(g/mL)、酶解温度50 ℃、酶解时间120 min 时,当酶用量在0.20%附近时,提取率最高。在一定范围内,提取率随着酶用量增多而增大,但超过0.20%后,提取率下降并趋于平缓,这可能是由于当酶用量低于最佳值时,体系中酶含量逐渐升高可促进底物与酶反应位点的有效结合,进而使得提取率升高。但酶用量超过一定量之后,酶之间相互竞争底物,同时与酶的底物结构相同的分子占据活性中心,对蛋白酶产生一定的抑制作用[17]。因此最佳的酶用量在0.2%附近。
2.2.3 酶解温度对于板栗淀粉得率的影响
由图1c 可知,在酶解条件为板栗100 g,料液比1:4(g/mL)、酶用量0.40%、酶解时间120 min 时,当酶解温度在50 ℃附近时,提取率最大,在温度从30 ℃升到50 ℃时,提取率不断升高,超过50 ℃后提取率开始下降。这是由于本研究使用的蛋白酶最适温度为45~55 ℃,在最适温度条件下酶活性最高,当实际温度与最适温度偏离越远时,活性越低。因此提取率在最适温度附近最高,偏离最适温度后酶活不断降低[9]。
2.3 酶法提取板栗淀粉的响应面实验结果
2.3.1 Box-Behnken 试验回归模型的建立及显著性检验
响应面实验以单因素实验为基础,以淀粉提取率为响应值,利用Design-Expert 软件优化板栗淀粉提取工艺,固定料液比为1:4(g/mL),通过17 次实验得到板栗淀粉提取率,响应面设计及结果见表3。
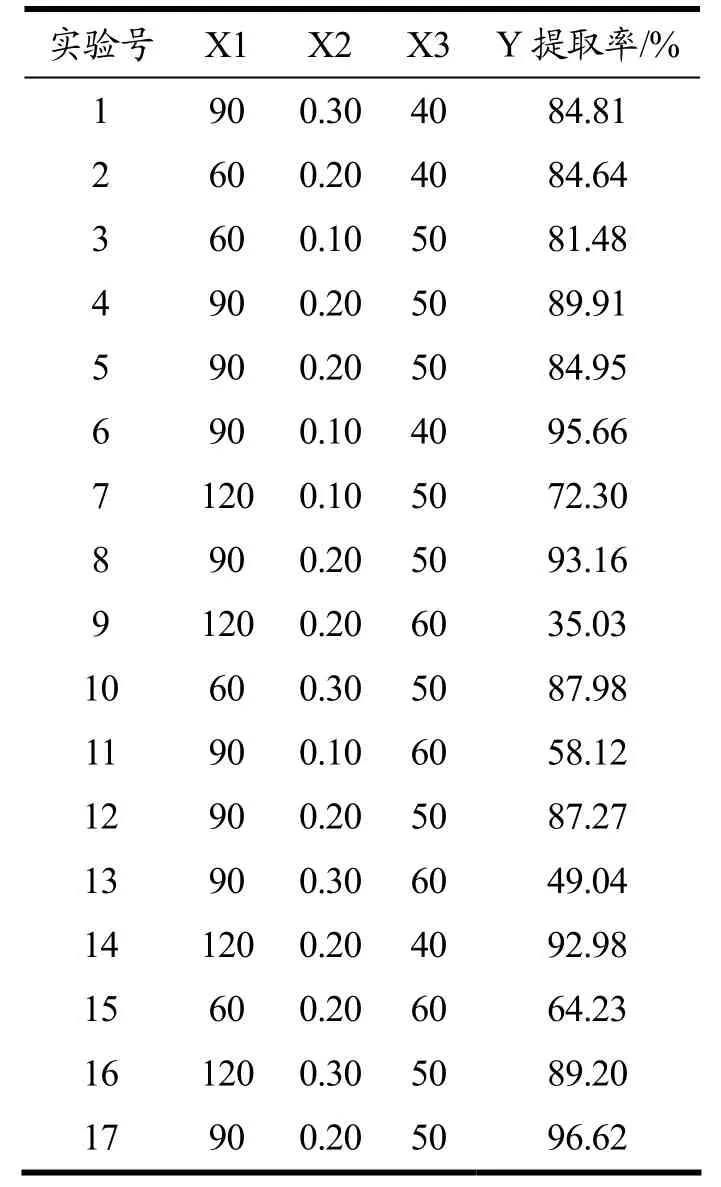
表3 响应面实验设计与结果Table 3 Experimental design and results of response surface methodology
2.3.2 回归模型的有效性及显著性分析
利用Design-Expert 8.0 软件对表3 数据进行多元回归拟合,获得酶解温度、酶解时间、酶用量与板栗淀粉提取率之间的二次多项回归方程:
该模型的方差分析结果见表4。
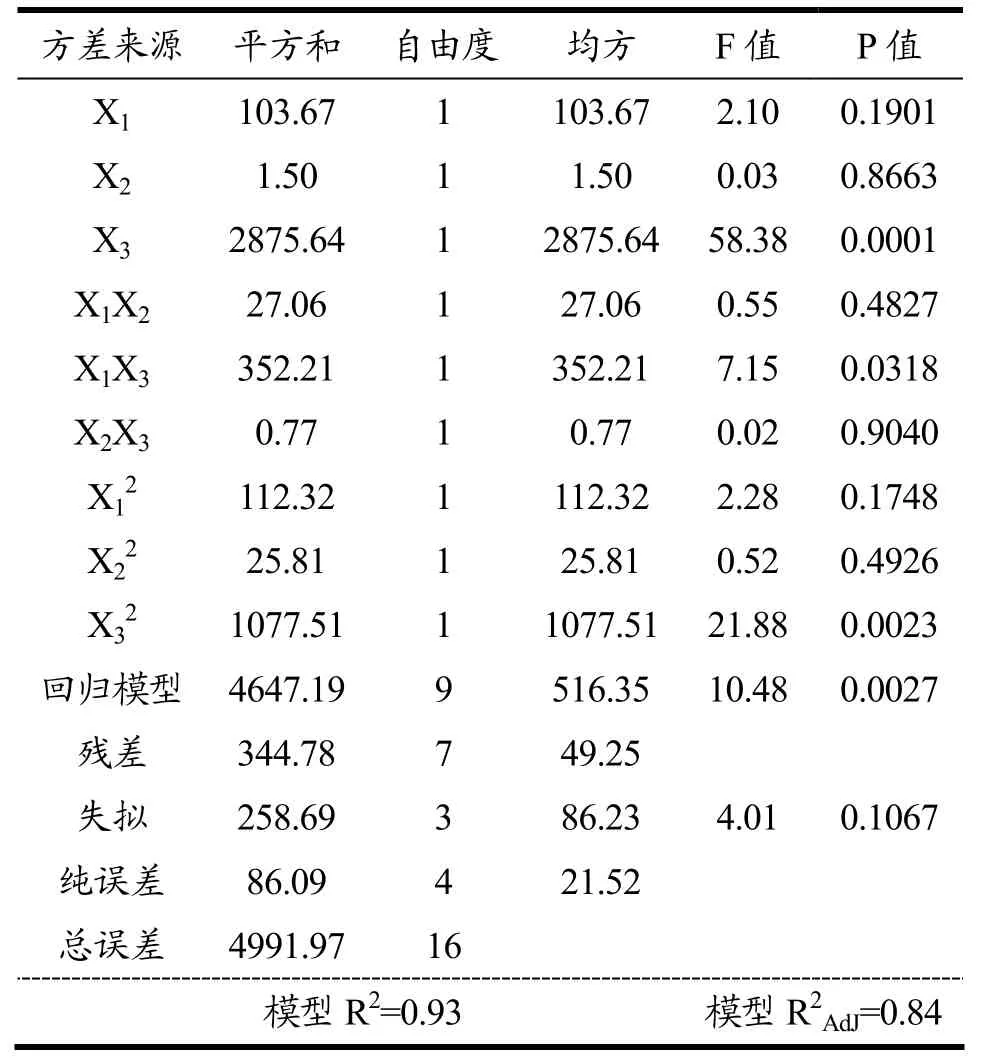
表4 回归方程的方差分析Table 4 Analysis of variance of regression equation
由表4 可知,淀粉提取率整体模型的F=10.48,模型回归值p<0.01,表明该回归模型极显著,通过对X1(酶解时间)、X2(酶用量)、X3(酶解温度)的F值的比较,可知三因素对淀粉提取率的影响从大到小依次为:X3(酶解温度)>X1(酶解时间)>X2(酶用量)。失拟项可以用来表示模型与试验的拟合程度,表现出二者的差异程度。本试验中,失拟项F=4.01,p=0.1067,失拟项不显著,表示该模型对于试验有良好的一致性[18]。模型中调整系数R2AdJ=0.84,说明84%的响应值的变化可以通过该模型解释,相关系数R2=0.93,表明模型与试验的拟合度较好,可以用来分析预测板栗淀粉的提取率。
2.3.3 响应面分析
为进一步分析酶添加量、酶解时间和酶解温度对于板栗淀粉提取率的影响,将三因素中的一个固定为0 水平,对其余两个因素进行交互作用影响的作图,可得到其相互作用的响应面图,如图2a、2b 和2c 所示。响应面图可以直观地反映出三因素交互作用对于淀粉提取率的影响,反映出自变量交互效应的强度。
由软件计算得到板栗淀粉提取率最高的提取条件为酶解时间99.65 min,酶用量0.22%,酶解温度43.16℃,提取率为96.73%,结合实际应用,确定板栗淀粉的最佳提取条件为酶解时间100 min,酶用量0.22%,酶解温度43 ℃。
2.3.4 响应面实验结果验证
以响应面优化后得到的实验条件对板栗淀粉进行提取以验证模型的有效性,结果如表5 所示。所提取的板栗粗淀粉中水分、脂肪、蛋白质及纯淀粉含量分别为9.86%、0.21%、0.31%和89.62%。1 g 干基粗淀粉中纯淀粉的含量用淀粉纯度表示。本研究中淀粉纯度为99.28%,淀粉的提取率为96.61%,与响应面模型预测结果96.73%仅有0.12%的偏差。这说明响应面模型具有高度可靠性,所优化得到的提取条件能高效地提取板栗中的淀粉。谭宏渊等[19]利用微波辅助提取板栗淀粉,其最高提取率为14.96%,根据其提取率计算方法,本文使用的提取方法提取率能达到19.71%,说明本文优化的板栗淀粉提取方法更加高效。

表5 板栗淀粉纯度及提取率Table 5 The starch extraction rate of different chestnuts extracted under the optimal conditions
2.3.5 板栗淀粉溶解度、膨胀度和冻融稳定性评价
以优化后的最佳提取条件分别提取另外两个品种的板栗(东岳早丰和大峰)淀粉并对三种板栗淀粉的溶解度、膨胀度、冻融稳定性进行测试,结果表6 所示。淀粉的溶解度和膨胀度分别指淀粉在水中溶解能力的大小和淀粉悬浮液在特定加热条件下的水合能力与在一定条件下离心后的持水能力。不同品种板栗淀粉的溶解度和膨胀度有一定的差异,东岳早丰的溶解度最大(2.13%),但是膨胀度最小(11.52%);大峰的溶解度最小(0.67%)但是膨胀度最大(13.44%),油榛则都居中。冻融稳定性反映了淀粉糊冻融后的脱水程度,脱水率越低,冻融稳定性越好,淀粉越难老化。在相同的冻融次数下,大峰的析水率最大(67.33%),其冻融稳定性最差,而油榛和东岳早丰的析水率相近(64.52%和64.23%),稳定性一致且较好。与李梁等[15]的实验结果相比,马铃薯淀粉的溶解度(18.41%)和膨胀度(22.34%)均高于板栗淀粉,而冻融稳定性(61.55%)则低于板栗淀粉。

表6 板栗淀粉的溶解度、膨胀度和冻融稳定性Table 6 Solubility,swelling degree and freeze-thaw stability of chestnut starch
2.3.6 板栗淀粉消化性能

表7 板栗淀粉的消化特性Table 7 Digestive characteristics of chestnut starch
淀粉的消化性能体现了淀粉颗粒结构对淀粉酶的敏感性。淀粉颗粒表面的致密程度、有无孔洞、多尺度有序结构对淀粉酶作用位点的屏蔽效果和对淀粉酶的抵御作用决定了淀粉颗粒的消化性能。由表中可以看到三种板栗淀粉中抗消化淀粉含量均占比最高,占60%以上。其中大峰抗消化淀粉含量最高,高达74.44%,这可能与其淀粉内部具有相对较高的有序结构有关[20]。同时,东岳早丰和油榛慢消化淀粉(SDS)含量占25%以上,高于大峰。与唐煜括[21]的研究结果相比,马铃薯淀粉的RDS 和SDS 含量(分别为31.62%和44.43%)均高于板栗淀粉,而RS 含量(23.95%)则远低于板栗淀粉。这说明板栗淀粉多尺度结构对酶的抵抗性强于马铃薯淀粉。由此可知,通过对三个品种板栗淀粉的消化性能进行对比分析可见,大峰品种的板栗抗消化性能最高,更适合用于抗消化食品的开发与利用。
3 结论
本研究通过对比三种提取方法对板栗淀粉进行提取发现酶法相对表面活性剂法和碱法能更加高效提取板栗淀粉,且最佳工艺条件为酶解时间100 min,酶用量0.22%,酶解温度43 ℃,最佳理论提取率和实际提取率理分别达到96.73%和96.61%,所提取的淀粉纯度达到99.42%。通过对比不同品种板栗淀粉理化性质发现不同品种的板栗淀粉的理化性质存在较大差异,其中大峰板栗淀粉的抗消化淀粉含量最高,达到了74.44%,可进一步进行营养健康板栗制品的创制。该研究可为高品质高附加值的板栗淀粉及板栗深加工产品的开发和创制提供基础数据。
