内镜黏膜下剥离术在结直肠早癌及癌前病变治疗中的应用效果
2022-07-29秦佳敏杨亚玲
秦佳敏 蒋 奕 杨亚玲
四川绵阳四〇四医院1消化内科,2感染科 四川 绵阳 621000
结直肠肿瘤是临床上常见的消化道肿瘤,居世界肿瘤发病率第3 位,其死亡人数占总癌症死亡的10%左右[1,2]。早期结直肠癌指浸润深度局限于黏膜及黏膜下层的任意大小的结直肠上皮性肿瘤,无论有无淋巴结转移。肿瘤浸润局限于黏膜层者称为黏膜内癌(M 期),浸润至黏膜下层但未侵犯固有肌层者称为黏膜下癌(SM 期)[3]。随着内镜技术的发展,目前结直肠早癌及癌前病变内镜下治疗(内镜黏膜切除术和内镜黏膜下剥离术等)已经取代了传统外科手术治疗。内镜下黏膜下切除术(endoscopic mucosal resection,EMR)是一种由内镜息肉切除术和内镜黏膜注射术发展而来的内镜切除技术,其深度可达黏膜下组织,通过大块切除部分黏膜有效治疗黏膜下病变,主要适用于直径<2 cm 的胃肠道黏膜下肿瘤[4]。内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)是在EMR 术基础上发展成的一种新型内镜辅助切除技术,其通过高频电刀对病变所在的黏膜剥离而达到治疗黏膜病变的目的,多用于消化道早癌和癌前病变的内镜切除[5]。炎症与应激反应是机体遭受创伤时常见的防御性表现,既往研究发现,手术作为有创性治疗手段,不可避免地引起大量免疫因子进入血液,引起不同程度的应激反应,且手术创伤性越大,产生的应激反应就越剧烈,机体免疫抑制时间也就越长,免疫应激不仅会延缓术后康复进程,也会加大术后并发症发生风险,故而临床术式的选择应充分考虑其创伤性[6],既往研究多集中于两种术式的切除效果及并发症,而对术后应激反应的影响未见报道。基于此,本研究拟探讨ESD 与EMR 两种术式对结直肠早癌及癌前病变的治疗效果及对机体应激反应的影响,以期为临床治疗中术式的选择提供参考,现报道如下。
1 资料与方法
1.1 一般资料回顾性分析2017 年3 月至2018 年10 月四川绵阳四〇四医院收治的结直肠早癌及癌前病变患者资料,纳入标准:①采用TNM 分期,结肠镜、组织活检结果根据其浸润肠壁深度分期为M 期(黏膜内癌)和SM 期(黏膜下癌);②癌前病变包括腺瘤、腺瘤病及炎症性肠病相关的异型增生;③无淋巴转移现象;④研究经院方伦理会批准,所有受试者均签署知情同意书。排除标准:①合并严重脏器功能障碍者;②良性病变或中晚期结直肠癌患者;③合并免疫系统功能障碍或精神疾病患者。根据治疗方案的不同(EMR 或ESD)将患者分为EMR 组和ESD组,经倾向性匹配评分法排除性别、年龄、疾病类型、癌组织分型等混杂因素,最终获得EMR 组60 例,ESD 组61 例。
其中,ESD 适应证为:疑为结直肠早期浸润性癌;病灶直径>20 mm 的结直肠上皮内病变;伴发纤维性病变,如炎症性肠病偶发的腺瘤;内径切除后复发或残留的病变组织(组织内径>10 mm)。EMR 适应证为:消化道黏膜病变常规活检后未确诊者;病灶直径<20 mm,浸润较浅的消化道早期癌、癌前病变、扁平息肉、部分黏膜基层或黏膜下层肿瘤。
1.2 治疗方法
1.2.1EMR 组 行EMR 治疗[7],具体如下:(1)术前肠道准备:患者于术前4~6 h 开始服用聚乙二醇电解质散溶液进行肠道准备,分次服用,每次服用250 mL,直至排出水样清便;(2)染色定位:在病变部位喷撒靛胭脂对其进行染色定位;(3)病变部位切除:在病变基底部位注射医用生理盐水,使其抬起突出,采用圈套器将病变部位切除,病灶直径较大者,则可先在肠镜前端加套透明帽,利用负压吸引,再收紧圈套器切除病变部位;(4)创面处理:采用电凝止血法对术后出血点及微血管进行止血处理。
1.2.2ESD 组 行内镜黏膜下剥离手术[8],具体如下:(1)术前肠道准备,采用电解质溶解液清理肠道残存物,每次服用250 mL,直至排出水样清便;(2)电凝标记:采用氩离子凝固术对病变0.5~1 cm处进行标记;(3)黏膜下注射,采用生理盐水加肾上腺素、靛胭脂、玻璃酸钠于标记外侧行多点注射,直至病灶抬起;(4)切开病灶黏膜,采用一次性黏膜切开刀(Dual 刀,Olympus,日本)从病灶远端开始,沿外缘切开黏膜;(5)黏膜下剥离:采用Dual 刀沿病灶下方对黏膜进行剥离,操作过程中保持视野清晰,直至完成剥离;(6)对术后出血点及微血管行电凝止血处理。
术后处理:术后平卧,24 h 内禁食禁水,给予常规止血、抗感染、补液治疗。密切观察患者体征、排气、排便情况,如无消化道穿孔、刺激及便血现象,术后第2 天可进水,术后第3 天进食少量流食。
复查、随访:分别于术后3 月、6 月来院复查肠镜、腹部CT,观察是否有复发及肿瘤转移等现象,之后每年来院进行一次肠镜复查。术后随访2 年,通过电话或门诊方法了解患者出院后恢复情况。
1.3 观察指标(1)基线资料。(2)手术指标:记录并比较两组手术时间、术中出血量、标本厚度、创面直径大小及病变最大直径切除率。(3)术后并发症比较:记录并比较两组术后并发症。(4)应激反应:分别于手术前1 d 及手术后1 d 抽取患者空腹静脉血3~5 mL,采用酶联免疫吸附测定法检测两组血清C-反应蛋白(C-reaction protein,CRP)、皮质醇(Cortisol,Cor)、促肾上腺皮质激素(Adrenocorticotropic hormone,ACTH)水平。(5)术后随访生存率、复发率:术后随访2 年,随访日期截止到2020 年10月,分别比较两组术后1 年、2 年消化道阳性症状、复发状况及生存情况。
1.4 疗效评估根据术后病理结果评估两组疗效[9]。(1)完全切除:①手术后病灶经染色后证实病变已全部切除,标本切缘经病理学检查均为正常组织;②标本切缘2 mm 内未见病变细胞。(2)整块切除:病灶部位被一次性切除,且获得单块标本。(3)不完全切除:切除标本经病理检查证实标本边缘有术前病变细胞,或标本边缘与切缘距离<2 mm。(4)病灶残留:术后6 个月以内复查,取手术位置组织进行病理检查,标本发现有与术前病理类型相同病变,或切口位置1 cm 以内发现病变细胞。(5)病灶复发:术后12 个月以后复查肠镜,取手术瘢痕组织进行病理学检查,标本发现有与术前病理类型相同细胞或发现继发性病灶。
1.5 统计学方法采用统计学软件SPSS 23.0 处理数据,根据二元Logistic 回归建立倾向性匹配评分模型,将两组资料进行匹配评分后,共有121 例结直肠早癌及癌前病变患者基线差异无统计学意义。年龄、病程、手术时间、术中出血量等计量资料以±s表示,组间比较采用独立样本t检验,组内治疗前后比较采用配对t检验;性别、疗效、不良反应等计数资料用频数(例)和率(%)表示,采用χ2检验或秩和检验。以P<0.05 表示差异有统计学意义。
2 结果
2.1 基线资料比较两组患者性别、年龄、疾病类型、癌组织分型等基线资料比较,差异均无统计学意义(P>0.05),见表1。

表1 两组患者一般临床资料比较
2.2 临床疗效比较两组整块切除、完全切除率比较差异均无统计学意义(P>0.05),见表2。

表2 两组患者临床疗效比较[例(%)]
2.3 手术指标比较ESD 组手术时间、术中出血量、标本直径、标本厚度、创面直径大小均显著大于EMR 组(P<0.05),整块切除及治愈性切除直径≥2 cm 病灶比较,差异无统计学意义(P>0.05),见表3。
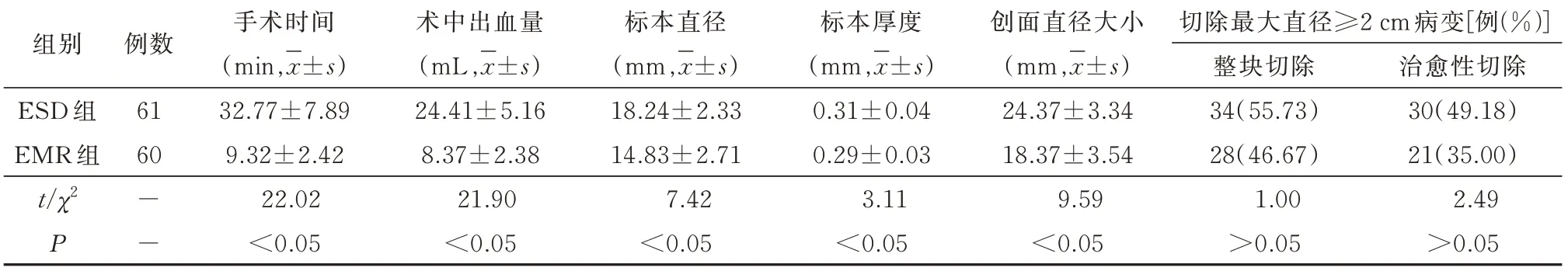
表3 两组患者手术指标比较
2.4 术后并发症比较两组创面感染、迟发性出血、迟发性穿孔发生率均无显著差异(P>0.05),总并发症发生率无显著差异(P>0.05),见表4。

表4 两组患者术后并发症比较[例(%)]
2.5 应激反应比较手术后两组患者血清CRP、Cor、ACTH 水平均显著增加(P<0.05),且ESD 组术后水平显著高于EMR 组(P>0.05),见表5。
表5 两组患者应激反应指标比较(±s)

表5 两组患者应激反应指标比较(±s)
与同组术前比较,*P<0.05
组别例数ACTH(pmol/L)术前1 d 8.37±2.64 7.81±2.27 1.25>0.05 ESD 组EMR 组术后1 d 12.52±2.49*10.26±2.37*5.11<0.05 61 60-tP CRP(mg/L)术前1 d 4.94±1.71 4.63±1.47 1.07>0.05术后1 d 24.99±6.16*18.94±5.25*5.81<0.05 Cor(mg/dL)术前1 d 16.39±2.17 15.76±2.04 1.64>0.05术后1 d 22.65±4.11*20.53±4.46*2.72<0.05
2.6 预后比较术后1 年ESD 组和EMR 组消化道阳性症状率分别为6.56%、1.67%,复发率分别为1.64%、0;术后2 年消化道阳性症状率分别为14.75%、8.33%,复发率分别为1.64%、3.33%,组间对比差异均无统计学意义(P>0.05),两组均无失访及死亡病例,复发病例均再次进行内镜或者外科治疗,见表6。

表6 两组患者预后情况比较[例(%)]
3 讨论
原发性结直肠癌肿瘤是消化道恶性肿瘤之一,其癌变过程一般经历腺瘤、腺瘤伴上皮内瘤变、早癌(黏膜内癌)、浸润癌等几个阶段,据报道,结直肠癌发病率可达2%~10%,晚期转移患者治疗后远期预后较差[10]。有研究表明,尽早发现并摘除早期病变组织可降低70%以上的癌变率及50%以上的死亡率[11],因此,提高早期结肠癌及癌前病变的治疗效果对根治结肠癌尤为重要。手术作为一种创伤性治疗方式,其术后并发症不容忽视,报道显示,手术应激反应是影响患者术后康复及预后的重要影响因素[12],故而,临床治疗中术式的选择还需考虑应激反应水平。
近年,随着内镜技术的不断发展,消化道早癌和癌前病变的内镜下微创治疗技术应用越来越广泛,内镜下治疗技术不仅可为操作者提供较为清晰的视野,而且手术创伤性更小,安全性更高,治疗成本较低,因而临床应用较为普遍。EMR 术和ESD术均内镜微创手术,被广泛应用于早期消化道肿瘤及病变的治疗中[13]。两种术式原理大致相同,即通过行黏膜下注射,将黏膜层与黏膜下层分离,再将病变组织切除或剥离。其中EMR 术是在内镜息肉切除术及内镜下黏膜注射术的基础上发展而来的一种新型术式,可于内镜下切除癌前病变组织及早期癌组织,手术简单,耗时短,对消化道组织内壁损伤较小,术后并发症少,此外,还可根据其切除的组织标本行临床病理分析,确定组织病变范围及深度,以提高完全切除率,降低癌症复发率[14]。ESD术是在EMR 术基础上发展起来的一种新型术式,与EMR 术不同的是,ESD 术是通过剥离病变组织以达到治疗疾病的目的,其优点在于采用Dual 刀(或IT 刀)可实现对病灶的完整切除,减少组织残留,对面积较大、渗透更深的病变组织切除效果也较好。然而操作过程中易受到内镜视野的干扰,加之剥离术操作更为复杂,耗时较长,具有一定的组织损伤风险,故而出血、穿孔等并发症发生率及术后复发率较高[15]。本研究结果中,两种术式整体临床疗效均较高,但EMR 术在手术时间、术出血量、手术创面直径方面略有优势,这是由于EMR 术操作简单,对直径较小的病变组织切除效率较高,故而创面直径更小。ESD 术切除的标本直径、厚度均大于EMR 术,直径≥2 cm 的整块切除率和治愈性切除率方面略高于EMR 术,说明ESD 术切除范围更广,更适用于面积较大病变组织切除。
在术后并发症方面,ESD 术术后并发症发生率为18.33%,EMR 组为8.33%,ESD 组的创面感染、迟发性出血、迟发性穿孔发生率均大于EMR 组,提示ESD 术对消化道组织内壁创伤性更强,然而两组总并发症发生率差异无统计学意义。而在何祎等[16]的研究中,ESD 组并发症显著高于EMR 组,结果略有不同,分析可能是患者年龄、肿瘤类型、病灶大小、位置等因素差异所致。
应激反应是评估手术创伤程度的重要指标,为探究两种术式对患者应激反应的影响,本研究分别于术前1 d 及术后1 d 测定患者血清应激性指标CRP、Cor、ACTH 水平,其中CRP 是炎症应激特征性指标,参与多种炎症反应[17];Cor 是术后重要的应激素指标,可使机体在压力状态下维持正常机能[18];ACTH 由脑垂体前叶分泌,可通过刺激肾上腺皮质促进糖皮质类固醇的分泌,有研究报道,应激反应状态下机体交感-肾上腺髓被激活,促进Cor、ACTH 大量释放,进而产生急性应激蛋白并引起发热反应,加重手术部位损伤,影响术后组织修复[19]。本研究结果表明,与EMR 组相比,ESD 组患者术后应激反应因子水平较高,提示该术式对机体损伤较大,或加大术后并发症风险,与上述研究结果一致。
预后情况方面,术后1 年及2 年内,ESD 组消化道阳性症状率和复发率均略大EMR 组,对比差异无统计学意义,与何祎等[16]研究结果一致,这与剥离过程中仪器设备受到空间局限造成的内镜视野干扰有关,故而笔者认为,临床上还需结合患者的病灶直径、深度、病变位置等多种因素充分考虑,选择适合的术式进行治疗才可最大限度保证手术的安全性和有效性。
综上所述,ESD 术与EMR 术治疗结直肠早癌及癌前病变均具有较好疗效,而ESD 术更适合病灶最大径≥2 cm 的早期患者,但手术操作要求高,创伤及应激反应较大,需根据患者情况选择。
