异牛肝菌素对人肝癌细胞增殖、凋亡影响及其与PI3K/Akt通路的关系
2022-07-28徐彦楠赵青赵俊霞周娜静高品周晨明
徐彦楠,赵青 ,赵俊霞,周娜静,高品,周晨明
1河北医科大学教学实验中心,石家庄 050017;2河北医科大学第四医院眼科;3河北医科大学细胞生物教研室;4河北医科大学大型科研仪器设备共享服务平台
肝癌是常见的恶性肿瘤之一,病死率较高,严重威胁患者生命健康安全[1]。尽管近年来乙肝疫苗得到普及、人们生活水平明显提高,但我国肝癌发病率仍相对较高[2]。临床治疗肝癌以化疗为主要手段,但不良反应较重、易产生耐药性,治疗效果不佳[3],迫切需要寻找和研发新型高效的抗肝癌药物。近年来研究发现,一些中药提取物能通过影响肿瘤细胞凋亡而表现出抗肿瘤作用,且呈多靶点作用,毒性较小,特异性强[4]。异牛肝菌素是一种从褐环粘盖牛肝菌中分离得到的单体化合物,与之前研究发现的牛肝菌素是同分异构体,属于聚异戊二烯酚类化合物[5]。临床研究表明,异牛肝菌素对多种肿瘤细胞具有抑制作用,如人胃癌BGC-823细胞株、人肺腺癌A549细胞株、人慢性髓系白血病K562细胞株等,且对正常淋巴细胞无毒性作用[6-8]。但异牛肝菌素对人肝癌HepG2细胞株的作用及机制鲜有报道。2021年1月—12月,本研究观察了异牛肝菌素对人肝癌细胞株HepG2增殖和凋亡的影响,并基于磷脂酸肌醇-3-激酶/蛋白激酶B(PI3K/Akt)通路探讨相关作用机制,为新型抗肿瘤药物的研制提供参考。
1 材料与方法
1.1 细胞与主要实验材料 人肝癌细胞株HepG2购于北京晶莱华科生物技术有限公司。异牛肝菌素由河北师范大学生命科学学院提供,浓度≥98%,实验前用完全培养液稀释为50.0µg/mL;PI3K/Akt通路激活剂Fumonisin B1购于上海源叶生物科技有限公司;DMEM培养基购于美国Invitrogen公司;胎牛血清购于美国Gibco公司;青霉素、链霉素购于上海依赫生物科技有限公司;鼠抗人Bax单克隆抗体购于艾美捷Trevigen公司;鼠抗人Bcl-2单克隆抗体购于上海翌圣生物科技股份有限公司;兔抗人Caspase-3单克隆抗体购于北京百奥博科技有限公司;兔抗人PI3K、pPI3K、pAkt单克隆抗体购于英国Abcam公司;辣根过氧化物酶标记的羊抗兔二抗购于石四药-翰林生物公司;乙二胺四乙酸(EDTA)购于美国Sigma公司;内参兔β-actin多克隆抗体购于武汉博士德生物工程有限公司。MTT试剂盒购于上海齐源生物科技有限公司;Hoechst333258购于上海士锋生物科技有限公司;RIPA裂解液购于上海康郎生物科技有限公司;BCA蛋白浓度测定试剂盒购于武汉伊莱瑞特生物科技股份有限公司;细胞培养箱(型号AHW-80L)购于上海目尼实验设备有限公司;振荡器(型号ZW-A)购于苏州市国飞实验室仪器有限公司;全自动酶标仪(型号ELX900)购于美国Bio-Tek公司;Odyssey双色红外荧光成像系统购于美国LI-COR公司;BX51荧光倒置显微镜购于日本Olympus公司。
1.2 细胞分组与异牛肝菌素用法 HepG2接种于含 10%FBS、青霉素(100 U/mL)、链霉素(100 U/mL)的DMEM培养基,置于细胞培养箱中培养,培养箱条件为适宜饱和湿度、37℃、5% CO2。定期更换培养液,待细胞培养至80%~90%密度时,弃培养液,用PBS洗涤细胞2次,加入0.04%EDTA消化液5 mL,混匀后吸去胰酶溶液,37℃下放置5 min,再加入2 mL含10%FBS的新鲜DMEM培养液终止消化,反复吹打使细胞形成单细胞悬液,传代培养至80%~90%密度待用。将细胞分为异牛肝菌素组、激活剂组、对照组。取第三代对数生长期的HepG2细胞,调整细胞浓度至6×107/L,胰酶消化,接种于96孔培养板、100µL/孔,每组设置6个复孔。将接种好的培养板置入培养箱(适宜饱和湿度、37℃、5% CO2)中培养,待细胞完全贴壁后,弃去旧培养液。异牛肝菌素组加入50µg/mL的异牛肝菌素;激活剂组加入50µg/mL的异牛肝菌素和20µg/mL的Fumonisin B1;对照组为细胞悬液,仅加入等容量生理盐水,不加任何药物。
1.3 细胞增殖抑制率测算 各组细胞培养24、48、72 h后弃去培养液,每孔加入新鲜培养液100µL,避光条件下加入5 mg/mL的MTT液10µL,避光条件下孵育4 h,每孔加入DMSO 150µL,然后置于振荡器上,于室温下振荡10 min。采用酶标仪于450 nm波长处检测光密度(OD)值,重复测量3次。计算HepG2细胞增殖抑制率。增殖抑制率(%)=(1-实验组平均OD值/对照组平均OD值)×100%。
1.4 细胞凋亡情况观察 各组细胞培养72 h后弃去培养液,采用4%中性甲醛固定细胞20 min,弃去固定液,PBS洗涤2次,吸尽液体;每孔加入Hoechst333258染液100 µL,室温下染色10 min,吸尽染液,PBS洗涤2次;每孔加入适量荧光淬灭剂,于荧光倒置显微镜下观察并拍照,细胞核明显浓缩为凋亡细胞,计算细胞凋亡率。细胞凋亡率(%)=凋亡细胞数/总细胞数×100%。
1.5 细胞中凋亡相关蛋白及PI3K/Akt通路相关蛋白检测 采用Western blotting法。各组细胞培养72 h后弃去培养液,终止培养,收集细胞,用PBS洗涤2次,吸尽液体;加入事先预冷的RIPA裂解液,于4℃下裂解细胞30 min;提取各组细胞总蛋白,将蛋白质溶液与等量上样缓冲液混合,经10% SDSPAGE电泳后转至NC膜上,5%脱脂奶粉37℃封闭3 h;分别加入 Bax、Bcl-2、Caspase-3、PI3K、pPI3K、pAkt单克隆抗体,在4℃下孵育过夜,TBS漂洗1次;添加辣根过氧化物酶标记的羊抗兔二抗,于37℃下孵育2 h,TBS漂洗3次;滴加事先按1∶1混合好的化学发光液,室温孵育3 min,吸去多余的化学发光试剂,将NC膜放入凝胶成像系统中进行发光、照相,测定各蛋白条带的积分光密度(IOD)值。以目的蛋白条带IOD值与β-actin条带IOD值的比值表示目的蛋白相对表达量。实验重复3次,取平均值。
1.6 统计学方法 采用SPSS19.0统计软件。采用K-W检验分析计量资料正态分布性,符合正态分布的计量资料以±s表示,多组比较采用单因素方差分析,进一步两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞OD值与增殖抑制率比较 干预24、48、72 h后,异牛肝菌素组细胞OD值低于激活剂组与对照组,细胞增殖抑制率高于激活剂组与对照组(P均<0.05)。随时间延长,异牛肝菌素组OD值呈降低趋势,细胞增殖抑制率呈升高趋势;对照组与激活剂组OD值呈增高趋势(P均<0.05)。详见表1。
表1 干预不同时间各组细胞OD值及增殖抑制率比较(±s)

表1 干预不同时间各组细胞OD值及增殖抑制率比较(±s)
注:与同组干预24 h后相比,aP<0.05;与同组干预48 h后相比,bP<0.05;与同时点对照组、激活剂组相比,cP<0.05。
组别异牛肝菌素组激活剂组对照组OD值增殖抑制率(%)72 h 87.68±0.51abc 0.00±0.00 0.00±0.00 24 h 0.302±0.001c 1.239±0.002 1.241±0.003 48 h 0.258±0.001ac 1.392±0.002a 1.394±0.002a 72 h 0.179±0.001abc 1.441±0.002a 1.443±0.003a 24 h 76.37±1.12c 0.00±0.00 0.00±0.00 48 h 81.56±0.89ac 0.00±0.00 0.00±0.00
2.2 各组细胞凋亡率及凋亡相关蛋白表达比较 异牛肝菌素组、激活剂组、对照组细胞凋亡率分别为68.37% ±2.16%、6.01% ±0.69%、6.12% ±0.72%,异牛肝菌素组细胞凋亡率高于激活剂组和对照组(P均<0.05)。异牛肝菌素组细胞Bax、Caspase-3蛋白表达高于激活剂组和对照组,Bcl-2蛋白表达低于激活剂组和对照组(P均<0.05)。见表2、图1。
表2 各组细胞中Bax、Bcl-2、Caspase-3蛋白表达比较(±s)
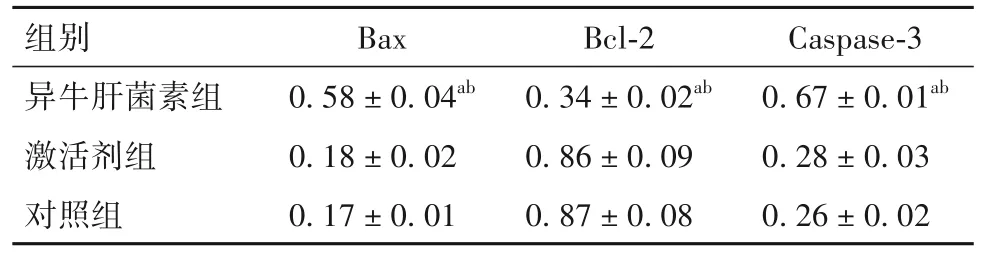
表2 各组细胞中Bax、Bcl-2、Caspase-3蛋白表达比较(±s)
注:与对照组相比,aP<0.05,与激活剂组相比,bP<0.05。
组别异牛肝菌素组激活剂组对照组Caspase-3 0.67±0.01ab 0.28±0.03 0.26±0.02 Bax 0.58±0.04ab 0.18±0.02 0.17±0.01 Bcl-2 0.34±0.02ab 0.86±0.09 0.87±0.08
图1 各组细胞中Bax、Bcl-2、Caspase-3蛋白表达情况
2.3 各组细胞中PI3K/Akt通路相关蛋白表达比较 异牛肝菌素组PI3K、pPI3K、pAkt蛋白表达低于激活剂组和对照组(P均<0.05)。见表3、图2。
表3 各组细胞中PI3K、pPI3K、pAkt蛋白表达比较(±s)
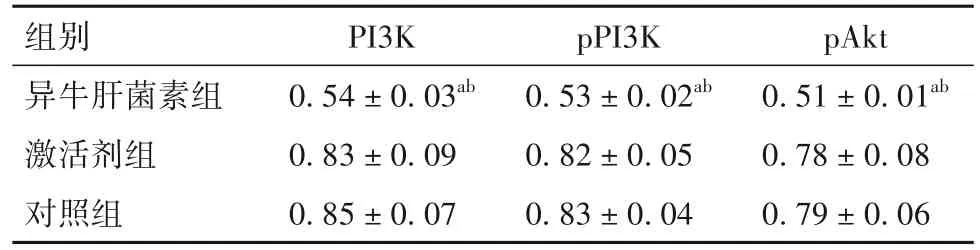
表3 各组细胞中PI3K、pPI3K、pAkt蛋白表达比较(±s)
注:与对照组相比,aP<0.05,与激活剂组相比,bP<0.05。
组别异牛肝菌素组激活剂组对照组PI3K 0.54±0.03ab 0.83±0.09 0.85±0.07 pPI3K 0.53±0.02ab 0.82±0.05 0.83±0.04 pAkt 0.51±0.01ab 0.78±0.08 0.79±0.06

图2 各组细胞中PI3K、pPI3K、pAkt蛋白表达情况
3 讨论
肝癌是是常见的消化道恶性肿瘤,病死率较高,严重危及患者生命安全,因此肝癌的防治工作仍任重道远[9]。早期肝癌患者可接受外科手术切除治疗,效果相对较好,5年生存率在40%~70%。但肝癌起病较为隐匿,早期通常没有症状或症状不典型,确诊时多已发展至中晚期,导致患者失去手术治疗的机会[10-12]。中晚期肝癌治疗以化疗为主,但化疗会产生严重的不良反应,有30%~80%的患者出现肿瘤耐药[13]。基于此,寻找新型、高效、毒性低的抗肝癌药物具有重要意义。
肝癌细胞无限生长的原因在于肿瘤细胞增殖失控与凋亡受阻。细胞凋亡是维持机体正常生命活动必不可少的程序,而肿瘤细胞凋亡障碍能较大程度地影响肿瘤的发生发展。如何促使肿瘤细胞凋亡在肿瘤治疗中意义重大[14]。通过诱导肿瘤细胞凋亡而控制肿瘤生长,是目前多数抗肿瘤药物的主要作用机制之一。褐环粘盖牛肝菌是一种食用兼药用的大型真菌,异牛肝菌素是从其中提取的一种天然化合物。异牛肝菌素表现出较强的生物活性,其在体外能通过诱导肿瘤细胞凋亡发挥抗肿瘤作用[15]。本研究观察了异牛肝菌素对人肝癌HepG2细胞增殖的影响,结果显示,异牛肝菌素组随用药时间延长而OD值减小、细胞增殖抑制率升高,且异牛肝菌素组细胞增殖抑制率高于激活剂组和对照组。同时,Hoechst333258荧光染色结果显示,对照组与激活剂组细胞形态正常,呈蓝色荧光,分布均匀,异牛肝菌素组同一视野下细胞数目明显减少,被染成亮蓝色,核固缩,染色质凝聚,有凋亡小体出现,呈现细胞凋亡的形态学改变。异牛肝菌素组细胞凋亡率高于激活剂组和对照组。上述研究结果提示,异牛肝菌素对人肝癌HepG2细胞具有较强的抑制效果,有成为新型抗肿瘤药物的可能。
研究表明,Bcl-2家族蛋白和Caspase家族蛋白与细胞凋亡密切相关。Bcl-2蛋白存在于线粒体膜,能保护膜通透性,同时能与Bax形成异源二聚体,抑制Bax的促凋亡活性。因此,Bax/Bcl-2比值能反映Bcl-2家族蛋白对细胞凋亡的调控作用[16]。Caspase家族中的Caspase-3蛋白参与细胞凋亡启动和执行过程,其表达量能反映Caspase家族蛋白对细胞凋亡的调控作用,亦是参与细胞凋亡最重要的调控蛋白[17]。本研究结果显示,异牛肝菌素组细胞中Bax、Caspase-3蛋白表达高于激活剂组和对照组,Bcl-2蛋白表达低于激活剂组和对照组,这提示异牛肝菌素可能通过调控Bax、Bcl-2、Caspase-3蛋白表达从而发挥促进肝癌细胞凋亡的作用。
PI3K/Akt信号通路是参与细胞生长、代谢、凋亡及转移的重要调节通路,其在多数肿瘤细胞内表达失调[18]。临床研究表明,肝癌的发生发展与PI3K/Akt信号通路关系密切[19]。PI3K 是 PI3K/Akt信号通路的核心,能够特异性催化磷酸肌醇-3-位羟基磷酸化,产生肌醇脂物质,进一步激活或募集通路下游靶蛋白产生一系列信号级联反应。Akt被激活后能从胞质转移至胞膜,并促进磷酸化的发生,进而激活或抑制PI3K/Akt信号通路的下游靶蛋白,从而调节细胞增殖或凋亡过程[20]。鉴于此,本研究基于PI3K/Akt信号通路探讨异牛肝菌素对人肝癌细胞增殖、凋亡的调控机制,结果显示,异牛肝菌素组细胞PI3K、pPI3K、pAkt蛋白表达低于激活剂组和对照组,提示异牛肝菌素抑制肝癌细胞增殖并诱导其凋亡的作用可能与抑制PI3K/Akt信号通路相关。同时,激活剂组与对照组PI3K、pPI3K、pAkt蛋白表达无统计学差异,提示PI3K/Akt通路被激活后,异牛肝菌素无法再发挥诱导细胞凋亡的作用。结合上述研究结果,我们认为,异牛肝菌素可抑制HepG2细胞增殖并诱导其凋亡,作用机制可能与抑制PI3K/Akt通路有关。
