秦皮甙对幼鼠肺炎链球菌肺炎的改善作用及机制
2022-03-29张鹏张宇晨王润智
张鹏,张宇晨,王润智
(1.平煤神马医疗集团总医院儿科,河南平顶山 467000;2.河南省开封市人民医院药剂科,河南开封 475000)
肺炎是常见的肺部感染性疾病,包括终末气道、肺泡腔及肺间质等在内的肺实质炎症[1-2]。肺炎链球菌肺炎属于细菌性肺炎,由肺炎链球菌引起。肺炎链球菌属于革兰氏阳性菌,正常情况下该菌定植在人体上呼吸道,当机体被病毒感染或免疫力低下时,引起败血症、肺炎、中耳炎、脑膜炎[3]。据世界卫生部门统计,每年约有160万人死于肺炎链球菌肺炎,其中,5岁以下儿童是肺炎链球菌感染率最高的群体,每年死于肺炎链球菌感染的5岁以下儿童约为100万人[4]。肺炎链球菌肺炎常使用抗生素治疗,随着其对抗生素耐药性的增加,寻找非抗生素类药物治疗肺炎链球菌肺炎十分重要。秦皮是木犀科植物苦枥白蜡树Fraxinus rhynchophyllaHance、白 蜡 树Fraxinus chinensisRoxb.、尖叶白蜡树Fraxinus chinensisRoxb.var.acuminata Lingelsh.或宿柱白蜡树Fraxinus stylosaLingelsh.的枝皮或干皮,味苦、涩,性寒,入大肠、肝、胆经,可清热燥湿,祛痰止咳,凉肝明目。秦皮甙是从秦皮中提取的一种香豆素类化合物,具有抗炎、抗氧化等药理作用[5]。既往有动物实验研究表明,秦皮甙有明显地改善脂多糖诱导的肺炎、因肺炎克雷伯菌导致的重症肺炎的作用[6-7]。这提示其在肺炎治疗中具有潜在的应用价值。但目前关于秦皮甙在肺炎链球菌肺炎患儿中的应用研究少有报道。因此,本研究通过建立肺炎链球菌肺炎幼鼠模型,探讨其对肺炎链球菌肺炎肺部的保护功能及抗炎作用,以期为临床肺炎链球菌肺炎患儿治疗提供实验支持,现将研究结果报道如下。
1 材料与方法
1.1 实验动物SPF级SD雄性大鼠50只,3周龄,体质量(50±5)g,由上海杰思捷实验动物有限责任公司提供,生产许可证号:SCXK(沪)2018-0004。幼鼠购入后饲养于河南大学医学院,使用许可证号:SYXK(豫)2016-0006,保持环境清洁通风,室内温度(23±2)℃、湿度(60±5)%、明暗周期12 h/12 h循环,适应性饲养7 d。
1.2 药物、菌株、试剂与仪器秦皮甙(纯度≥98%;分子式:C16H18O10;分子量:370.31;规格:20 mg/支;成都曼斯特生物科技有限公司生产,批号:191117)。肺炎链球菌菌株CMCC(B)31693(中国医学菌种保藏中心)。Janus激酶(JAK)/信号转导和转录激活因子(STAT)通路激活剂RO8191(美国MedCheme Express);白细胞介素(IL)-1β、IL-6、IL-10酶联免疫吸附分析(ELISA)试剂盒(美国Sigma公司);兔抗鼠JAK2、p-JAK2、STAT1、p-STAT1、STAT5、p-STAT5、细胞因子信号转导抑制因子(SOCS3)单克隆抗体,辣根过氧化物酶标记的山羊抗兔免疫球蛋白(IgG)(美国Abcam公司)。RM2145型自动切片机(德国徕卡公司);DM-35TV光学显微镜(江西道美智能科技有限公司)。
1.3 分组与建模将50只幼鼠随机分为正常组、模型组、秦皮甙组、激活剂组、激活剂+秦皮甙组,每组10只。除正常组外,其他各组幼鼠参照
文献研究[8]建立肺炎链球菌肺炎模型。具体方法:采用3%戊巴比妥钠按30 mg/kg腹腔注射麻醉,用无菌针头刺破鼻黏膜后,从鼻腔缓慢滴入0.5麦氏浓度(1.5×108CFU/mL)链球菌菌液50 μL,待其自动吸入。正常组幼鼠刺破鼻黏膜后,从鼻腔滴入50 μL生理盐水。前期经预实验行肺组织病理切片证实造模成功与否。
1.4 干预方法建模2 d后,参照药理实验中动物间的等效剂量换算方法[9],依据Ma等[10]的用量,秦皮甙组灌胃20 mg/kg秦皮甙,激活剂组灌胃30 mg/kg RO8191,激活剂+秦皮甙组灌胃30 mg/kg RO8191和20 mg/kg秦皮甙,正常组与模型组灌胃等体积生理盐水。每天1次,连续给药7 d。
1.5 观察指标与方法
1.5.1 肺湿质量/干质量(W/D)比值干预1周后,麻醉幼鼠,剖开颈部与胸腔,分离左肺与右肺,清洗干净后备用。各组取左肺(5只),称湿质量(W),然后转移至65℃烘箱干燥48 h,称干质量(D),计算湿质量/干质量(W/D)比值。
1.5.2 ELISA法检测肺组织匀浆IL-1β、IL-6、IL-10水平取右肺组织(5只),剪碎,加入9倍体积的生理盐水,于匀浆管中,充分研磨,使组织匀浆化,以3 000 r/min(离心半径8 cm)、4℃离心15 min,取上清液。按照IL-1β、IL-6、IL-10 ELISA试剂盒说明书加样,用全自动酶标仪测定450 nm波长处的吸光度(OD)值,通过绘制标准曲线计算得出IL-1β、IL-6、IL-10的浓度。
1.5.3 肺组织病理学变化及肺损伤评分取左肺(5只),4%多聚甲醛固定48 h,梯度乙醇脱水、石蜡包埋、切片(厚度4 μm),HE染色,中性树脂封片,显微镜下观察肺组织病理学变化并进行肺损伤评分。评分标准[11]见表1。总分为12分,得分越高,病理变化越严重。每张切片取5个视野,求平均值作为病理评分。

表1 肺损伤评分标准Table 1 Scoring criteria of lung injury
1.5.4 蛋白免疫印迹(Western Blot)法检测肺组织JAK2、p-JAK2、STAT1、p-STAT1、STAT5、p-STAT5、SOCS3蛋白相对表达水平取剩余右肺组织80 mg,研磨后,加蛋白提取裂解液,冰上裂解,离心,取上清;二喹啉甲酸(BCA)法进行蛋白定量,100℃水浴使蛋白变性;进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,将蛋白电转至聚偏氟乙烯(PVDF)膜;50 g/L脱脂牛奶室温封闭2 h;洗膜后分别加入1∶1 000稀释的
JAK2、p-JAK2、STAT1、p-STAT1、STAT5、p-STAT5、SOCS3等一抗,4℃孵育过夜;洗膜后加入1∶4 000稀释的辣根过氧化物酶标记的二抗,室温孵育1 h;洗膜后加入ECL发光液显影,采用ImageJ软件分析图像。以β-actin为内参,目的蛋白相对表达量以目的蛋白条带灰度值/β-actin蛋白条带灰度值表示。
1.6 统计方法采用SPSS 25.0统计软件分析数据,计量资料以均数±标准差(±s)表示,多样本计量资料比较采用单因素方差分析,两两样本比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组幼鼠一般情况比较干预1周后,观察各组幼鼠的一般情况。正常组幼鼠精神良好,皮毛光亮,进食、饮水及活动正常;模型组、激活剂组幼鼠体型消瘦、精神倦怠,活动减少;激活剂+秦皮甙组、秦皮甙组幼鼠精神状况较模型组好,活动增加。
2.2 各组幼鼠肺组织W/D比值比较肺组织W/D比值组间比较,差异有统计学意义(P<0.05)。与正常组比较,模型组、秦皮甙组、激活剂组、激活剂+秦皮甙组肺组织W/D比值升高(均P<0.05);与模型组比较,秦皮甙组、激活剂+秦皮甙组肺组织W/D比值降低,激活剂组W/D比值升高(均P<0.05),且秦皮甙组肺组织W/D比值低于激活剂+秦皮甙组(P<0.05)。具体结果见表2。
表2 各组幼鼠肺组织湿质量/干质量(W/D)比值比较Table 2 Comparison of W/D ratio of young rat lung tissues in various groups (±s)

表2 各组幼鼠肺组织湿质量/干质量(W/D)比值比较Table 2 Comparison of W/D ratio of young rat lung tissues in various groups (±s)
①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与秦皮甙组比较;④P<0.05,与激活剂组比较
W/D 2.65±0.51 5.82±0.71①4.10±0.49①②6.76±0.73①②③4.78±0.58①②③④21.772<0.001组别正常组模型组秦皮甙组激活剂组激活剂+秦皮甙组F值P值鼠数/只5 5 5 5 5
2.3 各组幼鼠肺组织匀浆IL-1β、IL-6、IL-10水平比较肺组织匀浆IL-1β、IL-6、IL-10水平组间比较,差异均有统计学意义(P<0.05)。与正常组比较,模型组、秦皮甙组、激活剂组、激活剂+秦皮甙组IL-1β、IL-6水平升高,IL-10水平降低(均P<0.05);与模型组比较,秦皮甙组、激活剂+秦皮甙组IL-1β、IL-6水平降低,IL-10水平升高,激活剂组IL-1β、IL-6水平升高,IL-10水平降低(均P<0.05);且秦皮甙组IL-1β、IL-6水平低于激活剂+秦皮甙组,IL-10水平秦皮甙组高于激活剂+秦皮甙组(P<0.05)。具体结果见表3。
表3 各组幼鼠肺组织匀浆IL-1β、IL-6、IL-10水平比较Table 3 Comparison of IL-1β,IL-6 and IL-10 levels in lung tissue homogenates in various groups of young rats (s,ng·L-1)

表3 各组幼鼠肺组织匀浆IL-1β、IL-6、IL-10水平比较Table 3 Comparison of IL-1β,IL-6 and IL-10 levels in lung tissue homogenates in various groups of young rats (s,ng·L-1)
①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与秦皮甙组比较;④P<0.05,与激活剂组比较
组别正常组模型组秦皮甙组激活剂组激活剂+秦皮甙组F值P值IL-10 90.55±9.24 36.78±6.41①66.15±7.32①②24.32±6.02①②③53.58±6.27①②③④13.458<0.001鼠数/只5 5 5 5 5 IL-1β 126.48±13.66 213.59±21.34①147.37±15.46①②240.28±24.51①②③175.25±18.15①②③④34.556<0.001 IL-6 208.45±24.75 319.55±32.12①223.15±25.41①②342.13±35.46①②③287.01±28.02①②③④25.672<0.001
2.4 各组幼鼠肺组织病理学变化比较HE染色显示:正常组幼鼠支气管黏膜结构正常,排列整齐,肺泡壁正常;模型组、激活剂组支气管黏膜上皮脱落或坏死,肺泡壁增厚并水肿,肺泡腔内有大量渗出物,肺泡间隔内毛细血管弥漫性扩张并充血;激活剂+秦皮甙组肺泡间隔内少量水肿,肺泡腔内少量渗出物;秦皮甙组幼鼠支气管黏膜结构无明显水肿充血,黏膜上皮有少量脱落、坏死。具体结果见图1。

图1 各组幼鼠肺组织病理学变化比较(HE染色,×200)Figure 1 Comparison of pathological changes of young rat lung tissues in various groups(by HE staining,×200)
2.5 各组幼鼠肺组织病理学评分比较肺组织病理学评分组间比较,差异有统计学意义(P<0.05)。与正常组比较,模型组、秦皮甙组、激活剂组、激活剂+秦皮甙组肺组织病理学评分升高(均P<0.05);与模型组比较,秦皮甙组、激活剂+秦皮甙组肺组织病理学评分降低,激活剂组肺组织病理学评分升高(均P<0.05),且秦皮甙组肺组织病理学评分低于激活剂+秦皮甙组(P<0.05)。具体结果见表4。
表4 各组幼鼠肺组织病理学评分比较Table 4 Comparison of lung histopathological score in various of young rats groups (±s,分)
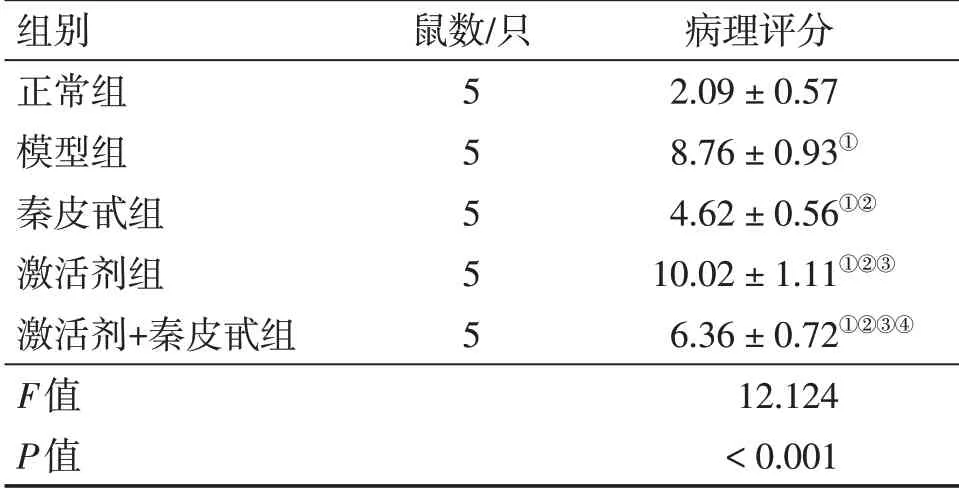
表4 各组幼鼠肺组织病理学评分比较Table 4 Comparison of lung histopathological score in various of young rats groups (±s,分)
①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与秦皮甙组比较;④P<0.05,与激活剂组比较
病理评分2.09±0.57 8.76±0.93①4.62±0.56①②10.02±1.11①②③6.36±0.72①②③④12.124<0.001组别正常组模型组秦皮甙组激活剂组激活剂+秦皮甙组F值P值鼠数/只5 5 5 5 5
2.6 各组幼鼠肺组织JAK2、p-JAK2、STAT1、p-STAT1、STAT5、p-STAT5、SOCS3蛋 白 相 对表达水平比较p-JAK2、p-STAT1、p-STAT5、SOCS3蛋白相对表达水平组间比较,差异均有统计学意义(P<0.05)。与正常组比较,模型组、秦皮甙组、激活剂组、激活剂+秦皮甙组p-JAK2、p-STAT1、p-STAT5蛋白相对水平升高,SOCS3蛋白相对表达水平降低(均P<0.05);与模型组比较,秦皮甙组、激活剂+秦皮甙组p-JAK2、p-STAT1、p-STAT5蛋白相对表达水平降低,SOCS3蛋白相对表达水平升高,激活剂组p-JAK2、p-STAT1、p-STAT5蛋白相对表达水平升高,SOCS3蛋白相对表达水平降低(均P<0.05),且秦皮甙组p-JAK2、p-STAT1、p-STAT5蛋白相对表达水平低于激活剂+秦皮甙组,SOCS3蛋白相对表达水平高于激活剂+秦皮甙组(均P<0.05)。JAK2、STAT1、STAT5蛋白相对表达水平组间比较,差异均无统计学意义(P>0.05)。具体结果见表5、图2。
表5 各组幼鼠肺组织JAK2、p-JAK2、STAT1、p-STAT1、STAT5、p-STAT5、SOCS3蛋白相对表达水平比较Table 5 Comparison of relative protein expression levels of JAK2,p-JAK2,STAT1,p-STAT1,STAT5,p-STAT5,SOCS3 in yong rat lung tissues of various groups
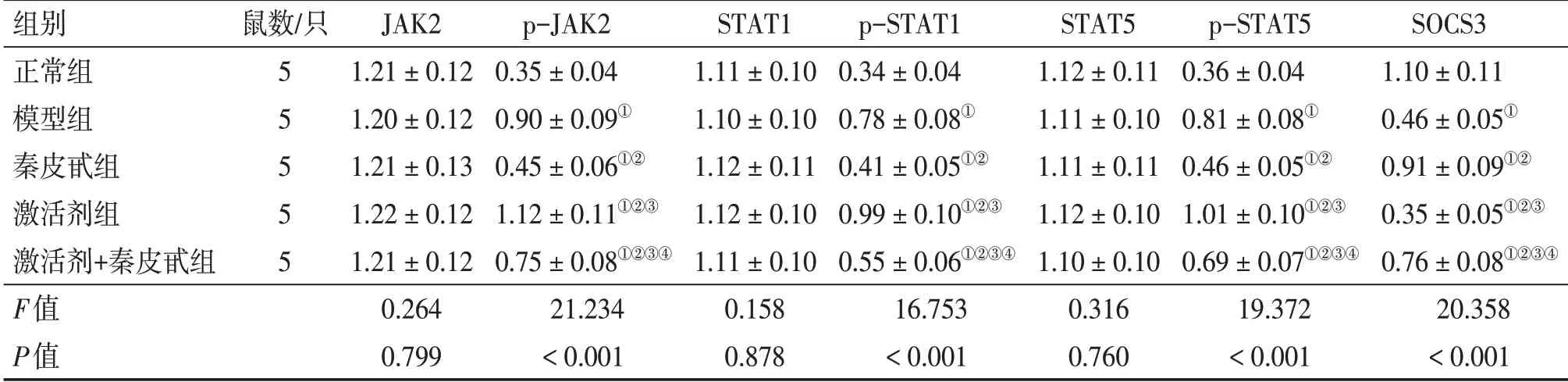
表5 各组幼鼠肺组织JAK2、p-JAK2、STAT1、p-STAT1、STAT5、p-STAT5、SOCS3蛋白相对表达水平比较Table 5 Comparison of relative protein expression levels of JAK2,p-JAK2,STAT1,p-STAT1,STAT5,p-STAT5,SOCS3 in yong rat lung tissues of various groups
①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与秦皮甙组比较;④P<0.05,与激活剂组比较
组别正常组模型组秦皮甙组激活剂组激活剂+秦皮甙组F值P值SOCS3 1.10±0.11 0.46±0.05①0.91±0.09①②0.35±0.05①②③0.76±0.08①②③④20.358<0.001鼠数/只5 5 5 5 5 JAK2 1.21±0.12 1.20±0.12 1.21±0.13 1.22±0.12 1.21±0.12 0.264 0.799 p-JAK2 0.35±0.04 0.90±0.09①0.45±0.06①②1.12±0.11①②③0.75±0.08①②③④21.234<0.001 STAT1 1.11±0.10 1.10±0.10 1.12±0.11 1.12±0.10 1.11±0.10 0.158 0.878 p-STAT1 0.34±0.04 0.78±0.08①0.41±0.05①②0.99±0.10①②③0.55±0.06①②③④16.753<0.001 STAT5 1.12±0.11 1.11±0.10 1.11±0.11 1.12±0.10 1.10±0.10 0.316 0.760 p-STAT5 0.36±0.04 0.81±0.08①0.46±0.05①②1.01±0.10①②③0.69±0.07①②③④19.372<0.001

图2 各组幼鼠肺组织JAK2、p-JAK2、STAT1、p-STAT1、STAT5、p-STAT5、SOCS3的Western Blot电泳条带灰度值比较Figure 2 Comparison of gray levels of JAK2,p-JAK2,STAT1,p-STAT1,STAT5,p-STAT5,SOCS3 in lung tissues in various groups of young rats by Western Blot
3 讨论
炎症因子异常表达是引起肺炎及其并发症的主要原因,其中,IL-1β和IL-6是主要促炎因子。临床上常以IL-1β表达水平的高低来判断肺损伤的程度[12]。IL-6不仅能够反映肺损伤的严重程度,且对急性肺损伤患者预后具有较高的预测价值[13]。有研究[14]表明,肺炎链球菌肺炎小鼠肺组织IL-6的含量明显升高。而IL-10是机体常见的抑炎因子,通过调控抑炎因子的表达,能够平衡机体的炎症反应[15]。
本研究结果显示,秦皮甙治疗后的肺炎链球菌肺炎幼鼠精神状况明显改善、活动量增加,肺组织W/D值降低,肺组织匀浆IL-1β和IL-6水平降低,IL-10水平升高,表明秦皮甙具有抗肺炎链球菌肺炎作用,且通过抑制促炎因子表达,促进抑炎因子表达发挥作用。本研究中,秦皮甙治疗后的肺组织病理学损伤改善,肺组织病理评分降低,表明秦皮甙治疗对肺炎链球菌肺炎幼鼠肺部具有保护作用。
JAK/STAT信号通路包括JAKs家族和STATs家族,JAKs细胞因子与其受体结合,JAKs激酶聚集,相邻JAKs彼此磷酸化而被激活,激活后的JAKs使受体产生STATs结合区域,STATs磷酸化形成二聚体,进行信号传递[16]。SOCS家族是JAK/STAT通路的负调控蛋白,肿瘤坏死因子等多种细胞因子可以通过JAK/STAT通路诱导SOCS蛋白家族的表达,SOCS又特异性地负反馈抑制JAK/STAT通路的活化,形成细胞因子信号转导反馈调节环[17]。炎症介质过度表达是肺炎链球菌肺炎的主要发病机制之一,IL-6、IL-1β是引起肺炎链球菌肺炎器官损伤的重要炎性介质,JAK/STAT信号通路是调控炎症基因表达的枢纽,在肺炎发病过程中发挥重要作用。JAK/STAT信号通路活化后可促进IL-6、IL-1β等炎性介质释放,通过促炎因子相互诱生和炎症级联放大反应,导致肺损伤。因此,抑制JAK/STAT信号通路,可作为减轻肺炎链球菌肺炎肺损伤的重要途径[18]。
本研究应用JAK/STAT信号通路特异性激活剂干预肺炎链球菌肺炎幼鼠,结果显示,肺组织p-JAK2、p-STAT1、p-STAT5蛋白相对表达水平较模型组明显升高,而SOCS3蛋白相对表达水平明显降低,同时促炎因子IL-6、IL-1β水平升高,肺组织损伤进一步加重,表明激活JAK/STAT信号通路,可促进肺炎链球菌肺炎病情加重;而秦皮甙组p-JAK2、p-STAT1、p-STAT5蛋白相对水平低于模型组,SOCS3蛋白相对表达水平高于模型组,表明秦皮甙可能参与调控JAK/STAT信号通路;在使用激活剂激活该通路基础上联合使用秦皮甙,结果显示秦皮甙的治疗作用明显减弱,证实了秦皮甙对JAK/STAT信号通路的抑制作用,表明秦皮甙对肺炎链球菌肺炎幼鼠的改善作用可能与抑制JAK/STAT信号通路有关。
综上所述,秦皮甙可明显抑制肺炎链球菌肺炎幼鼠的炎症反应,减轻肺组织损伤,发挥肺保护作用,其机制可能与抑制JAK/STAT信号通路有关。
