血府逐瘀汤辅助XELOX化疗治疗对晚期肝癌患者血清HIF-1α及TSP-1表达的影响
2022-07-28孟田田张桐桐赵跃萍
原发性肝癌(肝癌)是我国消化系统发病率最高的恶性肿瘤,因早期无特异性症状,且侵袭性高、发展迅速等特点,发现时多为中晚期,因此只能采取保守治疗,以化疗药物对抗肿瘤细胞,以获得延长生存期的目的
。但较多患者在化疗期间出现不同程度不良反应大大影响了治疗效果,因此,急需一种更为安全有效的化疗方案
。据相关研究表明
,含奥沙利铂(OXA)和新型氟尿嘧啶类药物卡培他滨(CAP)组成的XELOX化疗方案在晚期肝癌的治疗中取得不错效果,且不良反应较小,而血府逐瘀汤是近年来在抗癌治疗取得不错进展的中药方剂。基于此,我们开展随机对照研究血府逐瘀汤辅助XELOX化疗治疗晚期肝癌患者,观察其临床疗效及对血清HIF-1α、TSP-1表达的影响,旨在为临床治疗提高可靠指导依据。
1 资料与方法
1.1 一般资料 选取我院2017年10月至2018年10月收治的70例晚期肝癌患者,年龄35~76岁,平均(56.32±4.57)岁;男38例,女32例,按照随机数表法将其分为观察组和对照组,每组35例。纳入标准:①符合《原发性肝癌诊疗规范》中诊断标准,经病理检查确诊为晚期肝癌者,年龄>18岁;②临床资料完整;③肝肾功能及血常规等指标正常者;④无化疗药物过敏史者;⑤患者知情且签署知情同意书。排除标准:①合并其他恶性肿瘤者;②合并全身性疾病者;③合并严重心肾功能障碍者;④合并凝血功能障碍;⑤认知功能障碍或精神疾病者;⑥拒绝或不配合研究者。本研究获得我院伦理委员会批准。两组患者性别、年龄、病因类型、合并症、肝功能Child-Pugh分级、肝癌临床分期等均线资料比较差异无统计学意义(
>0.05),具有可比性,见表1。

1.2 方法
对照组患者予以XELOX方案化疗。方法如下:第1天予以静脉滴注OXA(江苏奥赛康药业股份有限公司,批号20110408)135 mg/m
,2 h内完成滴注。滴注完成后当天及接下来14 d均每天口服CAP(美国Roche Phama Ltd,批号20100521)1 000 mg,2次/d。4周为1个周期。治疗3个周期。
试验流程如图4所示。试验取矿样100 g装入球磨机中,再加入铁球或瓷球,向磨罐中倒入一定量的CaO和去离子水(或pH缓冲液)。其中,CaO和去离子水(或pH缓冲液)用量根据试验相应改变。将罐口封好后在83 r/min的转速下开始磨矿,根据试验需要确定磨矿时间。磨矿完静置1 min后,直接在磨罐中测量矿浆电位,测量时间为2 min。
观察组患者在对照组基础上联合血府逐瘀汤辅助治疗。血府逐瘀汤药方:黄芪60~120 g,桃仁、红花、当归各15 g,川穹、甘草各6 g,生地12 g,牛膝10 g,白芍20 g,1剂/d,水煎取汁300 ml,分2次服用。若瘀血明显可适当加入土鳖虫、蜈蚣,根据患者症状进行加减施治。均治疗3个月。
当前,国际社会处于大发展大变革大调整之中,各国既面临科技进步日新月异、区域合作方兴未艾等前所未有的重要机遇,也面临大国对抗风险上升、非传统安全威胁日益增多的全球性挑战。人类又一次站在了历史的十字路口,是单打独斗还是携手合作,是以邻为壑还是互利共赢,这是各国必须面对的时代选择。
1.3 观察指标 分别于治疗前和治疗3个月后,取患者空腹静脉血约5 ml,3 000 r/min,离心10 min,取上清液置于-70℃储存,进行免疫指标、血清HIF-1α及TSP-1水平等指标评估及测定。
1.3.1 临床疗效 根据实体瘤疗效评价标准进行疗效评估,治疗后临床症状基本消失,且可测病灶消失维持4周为完全缓解;治疗后临床症状明显改善,可测病灶缩小50%维持4周为部分缓解;治疗后临床症状有所改善,且病灶缩小不到50%为疾病稳定;治疗后临床症状无改善或加重,病灶增大或出现新病灶组织则为疾病进展。(完全缓解+部分缓解+疾病稳定)/总例数×100%=总缓解率。
诺贝丽斯(Novelis)是全球领先的铝压延产品制造商,以及全球最大的铝回收利用公司。诺贝丽斯的运营覆盖全球10个国家,拥有约11 000名员工,其2017财年的收入约为100亿美元。诺贝丽斯为北美洲、欧洲、亚洲和南美洲的运输、包装、建筑、工业和消费电子市场提供优质铝板和铝箔产品。诺贝丽斯是铝和铜领域全球领导者印度铝工业有限公司(Hindalco Industries Limited)的子公司。
颅脑正常早产儿的纳入标准:(1)有胎盘异常、胎膜早破、羊水污染或黄疸等病史,经MRI检查排除HIE;(2)无抽搐、意识改变等神经系统功能异常;(3)排除先天性疾病、严重低血压等疾病。本研究通过医院伦理委员会批准。MRI检查前均获得监护人的同意并签署知情同意书。
1.3.5 不良反应 参照抗癌药急性及亚急性毒性反应分度标准记录两组患者肠道反应、肝肾毒性、神经毒性、骨髓抑制、手足综合征等不良反应发生情况。
(1)横杆最大应力为1379.5kN,最小应力为—1696.1kN,最大、最小应力比为10:1;竖杆最大应力为531.6kN,最小应力为-2525.1kN,最大、最小应力比为7.1:1;斜杆最大应力为1170.6kN,最小应力为-2138.4kN,最大、最小应力比为4.3:1。
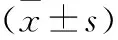
2.2 两组患者临床疗效 见表3。
由于各评价因子对建设开发的影响或限制程度不同,如生态红线、优质基本农田对建设开发的限制程度较高;因此将选取的评价因子进行强制性和较强制性因子的筛选,并建立适宜性评价指标体系(见表1)。
1.3.2 免疫指标 流式细胞仪测定两组患者血清CD3
、CD4
、CD8
水平值,并计算CD4
/CD8
值。
2.1 两组患者治疗前后免疫指标水平 见表2。
1.3.3 血清HIF-1α和血清TSP-1 采用酶联免疫吸附试验测定患者血清缺氧诱导因子-Iα(HIF-1α)水平,试剂盒为美国R&D公司配套试剂盒,操作按说明书进行。采用双抗体夹心酶联免疫吸附试验测定患者血清凝血酶敏感蛋白1(TSP-1)水平,试剂盒为Cusabio公司配套试剂盒,操作按说明书进行。
2 结果
1.3.6 生存率 随访1年内两组患者死亡、存活情况,并统计生存率。

1.3.4 卡氏评分 采用Larnofsky功能评分(卡氏评分)对两组患者生存质量进行评价,总分100分,分值与健康状况成正比。

2.3 两组患者治疗前后血清HIF-1α、TSP-1水平 见表4。

2.4 两组患者治疗前后卡氏评分 见表5。
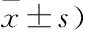
2.5 两组患者不良反应发生情况 见表6。
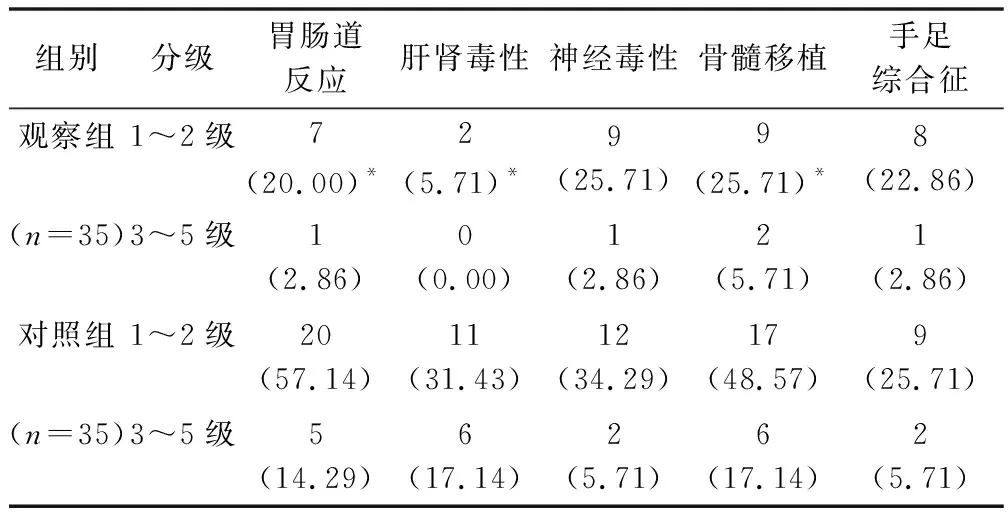
2.6 两组患者生存质量 见表7。
3 讨论
随着肝癌发病率的逐渐升高,病死率逐年增加,严重威胁人们健康安全,早期肝癌患者可进行手术切除或进行肝脏移植即可改善预后。而晚期肝癌患者往往已经失去手术机会,只能采取保守治疗,如通过化疗药物进行治疗
。但晚期肝癌患者由于肝细胞损伤以及肝功能损害,其对化疗药物的代谢及降解作用下降,使得化疗效果大打折扣,并且药物毒副作用也在一定程度上影响了化疗效果
。临床研究显示中药辅助化疗治疗肝癌,可有效提高临床症状和病灶缓解率,调节免疫,抑制肿瘤细胞生长,降低并发症提高晚期肝癌患者生命质量,提高临床疗效。
我们通过对70例晚期肝癌患者予以血府逐瘀汤辅助XELOX化疗,研究结果表明,治疗后两组患者临床症状均得到显著改善,且观察组患者治疗总缓解率显著优于对照组的,说明血府逐瘀汤辅助XELOX化疗可有效提高晚期肝癌患者临床症状改善情况,并消除病灶,提高疾病缓解率,更好地控制疾病进展。究其原因,OXA是一种新型铂类抗癌药物,具有抗细胞毒性和肿瘤活性的作用,可阻止癌细胞增殖,诱导癌细胞凋亡
。而CAP是一种新型氟尿密啶类药物,在肿瘤组织中与胸腺磷酸化酶发挥细胞毒性作用。OXA和CAP组成的XELOX化疗方案对于晚期肝癌治疗可发挥其抗肿瘤作用,抑制肝癌细胞生长,缓解病情
。血府逐瘀汤是一种具有活血化瘀、行气止痛功效的中药方剂,对于活化血管,疏通瘀血具有较好效果,对于改善晚期肝癌患者肝区疼痛、腹胀、纳差等临床症状具有积极促进作用
。因此,与XELOX化疗联用,可促进治疗效果的提高。治疗后,观察组患者血清CD3
、CD4
较对照组更低,而CD8
、CD4
/CD8
较对照组更高,说明血府逐瘀汤辅助XELOX化疗可有效改善晚期肝癌患者免疫水平,增强治疗效果。这主要是因为血府逐瘀汤中黄芪、当归、川芎、甘草等有助提高白细胞水平,促进免疫力的提高,改善免疫状态,提高机体抗病能力,进而促进机体微循环的改善,有助于肝功能的恢复
。治疗后,观察组血清HIF-1α水平显著低于对照组,而观察组血清TSP-1水平显著高于对照组,说明血府逐瘀汤辅助XELOX化疗可调降血清HIF-1α水平,调升血清TSP-1水平,从而抑制肿瘤因子增殖、新生,促进疾病控制。HIF-1α是一种缺氧时的转录激活因子,较高水平HIF-1α可促进肿瘤血管新生和肿瘤生长、迁移
。TSP-1是一种内源性血管生成抑制因子,较低水平的TSP-1会促进肿瘤细胞的增殖和迁移、降解血管生成
。经治疗调降血清HIF-1α,调升TSP-1水平,有助于抑制肿瘤血管生成,阻止肿瘤生长、转移,发挥其抗肿瘤作用,控制疾病,为临床指导治疗提供了依据,可作为临床治疗效果评估指标。另外,观察组患者卡氏评分显著高于对照组,且观察组胃肠道反应、肠肝肾毒性、1~2级骨髓抑制不良反应发生率均低于对照组。说明血府逐瘀汤辅助XELOX化疗有助于提高患者生命质量,降低不良反应发生率。究其原因,血府逐瘀汤与XELOX化疗的联合应用大大提高了临床治疗效果改善了患者临床症状。有研究表明
,OXA和CAP均对肝肾毒性和神经毒性较低,但对胃肠道影响较大。而血府逐瘀汤,药性温和,且可根据患者进行加减施治,对肝肾毒性较低,对胃肠道影响较小,因此其不良反应更低。治疗后,观察组患者生存期、中位生存期、中位疾病进展时间及无进展时间较对照组更高,说明血府逐瘀汤辅助XELOX化疗有助于提高晚期肝癌患者生存期,延长无进展生存期,这与之较好的抗肿瘤治疗效果和免疫调节密切相关。
[1]高春蕾.补肺化瘀汤联合新辅助化疗对非小细胞肺癌中缺氧诱导因子-1α、诱导型一氧化氮合酶的影响[J].中药药理与临床,2018,34(3):175-178.
[2]刘磊,韩文豪,陈涛,等.晚期肝癌患者血清转化生长因子β1在肝动脉化疗栓塞术前后变化及对预后的意义[J].中国普通外科杂志,2018,27(1):94-100.
[3]窦锡彬,唐汉庆,赵玉峰,等.血府逐瘀汤对冠心病动物模型血脂和心肌酶学的影响[J].广东医学,2019,40(6):767-771.
[4]李红志,邵珊珊,邵卫玲,等.XELOX和FOLFOX化疗方案对中晚期胃癌患者生活质量的影响及毒副反应[J].川北医学院学报,2019,34(5):578-581.
[5]Yu YJ,Jeong WJ,Sung WL,
.Circulating pro- and anti-angiogenic factors in multi-stage liver disease and hepatocellular carcinoma progression[J].Sci Rep,2019,9(1):9137.
[6]叶善平,李太原,钟武,等.结直肠癌组织ERCC1表达水平对患者术前XELOX方案新辅助化疗疗效的影响[J].山东医药,2018,58(29):55-57.
[7]Wang CY,Ding HZ,Tang X,
.Comparative analysis of immune function,hemorheological alterations and prognosis in colorectal cancer patients with different traditional Chinese medicine syndromes[J].Cancer Biomark,2018,21(3):701-710.
[8]Chen T,Niu X,Si Y,
.Application of Traditional Chinese Medicine Four-diagnostic auxiliary apparatus in evaluation of health status and clinical treatment[J].J Tradit Chin Med,2018,38(3):447-451.
[9]蒋锐沅,王同彪,满婷婷,等.敷和备化方联合肝动脉化疗栓塞术治疗肝郁脾虚型原发性肝癌患者的近期疗效及其对血浆血管生成因子水平的影响研究[J].中国全科医学, 2020,23(33): 4214-4221.
[10]李建华,唐小万.XELOX辅助化疗对老年结肠癌根治术后患者治疗效果、生存质量及免疫功能的影响[J].中国老年学杂志,2018,3:587-589.
[11]Liu Z,Chen J,Fang Y,
.The efficacy and safety of apatinib treatment for patients with unresectable or relapsed liver cancer: a retrospective study[J].J Cancer,2018,9(16):2773-2777.
[12]燕彩霞,满孝蕊,王健.化痰散结汤对晚期胃癌化疗增效,毒副反应及免疫功能的影响[J].四川中医,2020,38(10):113-116.
[13]Li Y,Li GX,Chu ZH,
.Conversion chemotherapy with capecitabine and oxaliplatin for colorectal cancer with potentially resectable liver metastases: A phase II,open-label,single-arm study[J].J Cancer Res Ther,2018,14(4):772-779.
[14]叶善平,李太原,钟武,等.结直肠癌组织ERCC1表达水平对患者术前XELOX方案新辅助化疗疗效的影响[J].山东医药,2018,58(29):55-57.
[15]Chen HH,Lin JK,Chen JB,
.Neoadjuvant therapy of bevacizumab in combination with oxaliplatin and capecitabine (XELOX) for patients with metastatic colorectal cancer with unresectable liver metastases: a phase II,open-label,single-arm,noncomparative trial[J].Asia Pac J Clin Oncol,2018,14(1):61-68.
[16]袁云,徐国辉.XELOX方案治疗晚期原发性肝癌的效果及对血清肿瘤标志物水平的影响[J].解放军医药杂志,2017,29(6):44-47.
[17]曹琳,李瑞林,李鲁明,等.养正消积胶囊防治原发性肝癌化疗毒副反应25例临床观察[J].中国药业,2017,26(23):53-55.
