早期重度中暑巴马小型猪肾组织病理学特点及相关炎症因子表达
2022-07-27何嘉骐
何嘉骐,张 静,倪 军
(1.新乡医学院,河南 新乡 453003;2.中国人民解放军陆军第八十三集团军医院肾脏内分泌科,河南 新乡 453000)
重度中暑是指在高温环境中长时间暴露或剧烈运动后导致机体核心温度高于40 ℃,并出现中枢神经系统异常,如神志不清、抽搐或昏迷的急性疾病。重度中暑患者常出现广泛的组织损伤、横纹肌溶解、弥散性血管内凝血和多器官功能障碍[1-3]。重度中暑是危及生命的一种疾病,随着全球气温的升高,其病死率逐年增加[4-5]。有研究表明,重度中暑是一种与全身炎症反应密切相关的高热状态,会导致包括急性肾损伤(acute kidney injury,AKI)在内的多器官功能障碍[6]。白细胞和肾小管细胞在AKI患者受损的肾脏中会释放白细胞介素(interleukin,IL)-6和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等一系列促炎细胞因子,从而加重肾功能损伤[7-10]。有研究发现,将雄性巴马小型猪进行约4 h的严重热暴露后,巴马小型猪出现自主行为异常、核心体温升高、生理反射迟钝或消失等重度中暑早期症状[11]。目前,关于重度中暑的相关研究主要是以小鼠为模型,以大型动物为模型的相关研究较少。基于此,本研究旨在探讨早期重度中暑巴马小型猪肾组织病理学变化及相关炎症因子的表达,以期为重度中暑患者的早期预防和临床研究提供参考。
1 材料与方法
1.1 实验动物健康雄性巴马小型猪12只,体质量10~15 kg,购自泰州泰和生物科技有限公司动物实验中心,生产许可证号:SCXK(苏)2017-0010,饲养于中国人民解放军陆军第八十三集团军医院动物实验室,温度(24.92±0.41)℃,12 h交替自然光照射,间断通风,普通饲料适应性喂养1周。
1.2 主要试剂与仪器兔抗IL-1α多克隆抗体、兔抗TNF-α多克隆抗体购自北京Affinity Biosciences公司,山羊抗兔免疫球蛋白G购自北京中杉金桥生物技术有限公司,盐酸艾司氯胺酮注射液购自江苏恒瑞医药股份有限公司,苏木精-伊红(hematoxylin-eosin,HE)试剂盒购自上海生物工程科技有限公司。改良型F800-Z恒温恒湿气候舱购自广东富宸电器有限公司,全自动生物化学分析仪购自美国贝克曼库尔特公司,全自动尿液分析仪购自爱威科技股份有限公司,高灵敏度电子体温计购自湖南省瑞博科技有限公司,高精度专业电子计数秤购自永州衡器有限公司,光学显微镜购自厦门麦克奥迪有限公司。
1.3 方法
1.3.1 实验分组及早期重度中暑模型构建将12只巴马小型猪按随机数字表法分为对照组和模型组,每组6只。2组巴马小型猪适应性喂养1周后,禁食、禁水12 h,将模型组巴马小型猪于温度42~45 ℃,湿度70%~80%透明恒温恒湿箱中进行热暴露;每间隔30 min记录1次模型组巴马小型猪的核心体温、结膜颜色、角膜反射、提睾反射、精神状态,当核心体温达 42 ℃,结膜充血,提睾反射、角膜反射明显减弱或消失即为造模成功[11]。对照组巴马小型猪不做任何处理。本研究经中国人民解放军第八十三集团军医院动物伦理委员会审核批准。
1.3.2 2组巴马小型猪血清肌酐、尿素氮及尿蛋白水平检测造模成功后,立即在室温下用20 mg·kg-1盐酸艾司氯胺酮注射液(江苏恒瑞医药股份有限公司,国药准字H20193336)耳后注射麻醉2组巴马小型猪,麻醉后将2组巴马小型猪固定于动物解剖实验台上,采集腹腔静脉血及膀胱内尿液送检,然后处死。取2组巴马小型猪腹腔静脉血10 mL,3 500 r·min-1离心3 min,分离血清,使用全自动生物化学分析仪测定血清肌酐及尿素氮水平。取2组巴马小型猪膀胱内尿液10 mL,使用全自动尿液分析仪检测尿液中尿蛋白水平。
1.3.3 免疫组织化学染色法检测2组巴马小型猪肾组织中TNF-α和IL-1α 表达2组巴马小型猪处死后立即随机取一侧肾脏,生理盐水灌注后用中性甲醛缓冲液固定,送医院病理科进行常规石蜡包埋、切片(厚 4 μm)。取肾组织切片,烤片脱蜡、水化;浸入酸碱度为6.0的柠檬酸盐缓冲液中并在压力锅内加热进行抗原热修复4 min,蒸馏水冲洗2次,磷酸盐缓冲溶液冲洗2次,每次3 min;再将切片浸泡于体积分数3%内源性过氧化物酶封闭,室温静置20 min,磷酸盐缓冲溶液冲洗 3 次,每次 5 min;滴加兔抗IL-1α多克隆抗体(滴度1100)和兔抗TNF-α多克隆抗体(滴度1100),4 ℃孵育过夜,滴加山羊抗兔免疫球蛋白G室温孵育30 min;二氨基联苯胺显色、苏木精复染,梯度乙醇脱水、二甲苯透明、中性树胶封片,置于光学显微镜下观察染色情况。染色强度分为未染色(阴性)、淡黄色(弱阳性)、黄色 (阳性)、棕黄色 (强阳性)[12-15]。光学显微镜下(×400)随机取5个视野,计数每个视野内TNF-α、 IL-1α强阳性及阳性细胞数及视野内总细胞数,取均值。阳性细胞比例=(强阳性细胞数+阳性细胞数)/视野内总细胞数×100%。
1.3.4 HE染色法观察2组巴马小型猪肾组织病理学改变取肾组织切片,将切片经二甲苯脱蜡、梯度乙醇水洗、苏木精和伊红溶液依次染色、常规脱水、透明后,用中性树胶封片,晾干后于光学显微镜下(×400)随机选取5个视野观察并拍照。分别计算每个视野下中性粒细胞浸润、组织间隙水肿、肾小管坏死、淤血和微血栓所占面积的百分率,取均值,百分率越高表示肾组织病理学改变程度越严重。
1.3.5 Paller评分法评估2组巴马小型猪肾小管病理损伤程度取经HE染色并晾干后的肾组织切片,使用光学显微镜(×400)随机选取5个视野观察肾小管损伤程度,并采用Paller评分法[16]评估。Paller评分法评分标准:肾小管明显扩张,细胞扁平计1分;刷状缘损伤计1 分;刷状缘脱落计 2 分;细胞质空泡计1 分;间质水肿计1 分;肾小管腔内有脱落的坏死细胞,未形成管型或碎片计 1 分,形成管型或碎片计 2 分;Paller评分越高表示肾小管病理损伤程度越严重。
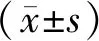
2 结果
2.1 2组巴马小型猪核心体温、结膜炎色和生理反射变化模型组巴马小型猪热暴露时间为(4.17±0.24)h,核心体温达到42 ℃的时间为(3.17±0.41)h,造模成功时核心体温为(43.25±0.29)℃,均出现结膜充血及提睾反射、角膜反射明显减弱或消失。模型组巴马小型猪热暴露时间内,对照组巴马小型猪核心体温为(38.25±0.15)℃,均未出现结膜充血,提睾反射、角膜反射减弱。
2.2 2组巴马小型猪血清肌酐、尿素氮及尿蛋白水平比较结果见表1。模型组巴马小型猪血清肌酐、尿素氮及尿蛋白水平显著高于对照组,差异均有统计学意义(P<0.05)。
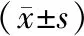
表1 2组巴马小型猪血清肌酐、尿素氮及尿蛋白水平比较
2.3 2组巴马小型猪肾组织中TNF-α、IL-1α表达比较结果见表2和图1。免疫组织化学染色显示,TNF-α、IL-1α阳性表达细胞主要分布于近端肾小管中,模型组巴马小型猪肾组织主要为棕黄色的强阳性染色,对照组巴马小型猪肾组织主要为淡黄色的弱阳性染色。模型组巴马小型猪肾组织中TNF-α、IL-1α阳性细胞比例显著高于对照组,差异有统计学意义(P<0.05)。
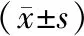
表2 2组巴马小型猪肾组织中TNF-α、IL-1α阳性细胞比例比较

:表示对照组巴马小型猪肾组织中的弱阳性表达以及模型组巴马小型猪肾组织中的阳性或强阳性表达。
2.4 2组巴马小型猪肾脏病理学改变程度比较结果见表3和图2。HE染色显示,对照组巴马小型猪肾组织中仅有少量中性粒细胞浸润,未发现组织间隙水肿、淤血、微血栓形成及肾小管坏死;模型组巴马小型猪肾组织中均出现明显的组织间隙水肿、中性粒细胞浸润、淤血、微血栓形成及肾小管坏死,淤血和微血栓形成、中性粒细胞浸润主要发生于近端肾小管中。模型组巴马小型猪肾组织中中性粒细胞浸润、组织间隙水肿、肾小管坏死、微血栓所占面积百分率均显著高于对照组,差异有统计学意义(P<0.05)。
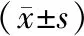
表3 2组巴马小型猪肾脏病理学改变比较

A:对照组正常肾组织;B:模型组组织间隙水肿;C:模型组中性粒细胞浸润;D:模型组微血栓;E:模型组肾小管坏死。
2.5 2组巴马小型猪Paller评分比较对照组和模型组巴马小型猪Paller评分分别为(0.80±0.18)、(5.00±0.33)分。模型组巴马小型猪的Paller评分显著高于对照组,差异有统计学意义(t=27.111,P<0.05)。
3 讨论
人体持续暴露于高温高湿环境中,体温调节功能会受损,易出现中暑症状甚至发展成热射病,其中运动员、户外劳工和军人患病的风险最大[17]。重度中暑具有临床症状重、进展快、病死率高的特点。研究表明,重度中暑的发生受环境因素及高代谢因素影响[18]。通过检索国内外文献发现,近年来在国内几乎没有对重度中暑大型动物建模的研究,多采用小鼠进行建模,但小型动物具有局限性,对于一些特殊的干预条件无法满足(如血液净化等);国外有关重度中暑的研究多采用狒狒,但成本高且不易获取。有研究表明,大型动物的免疫系统与人类类似,其中猪与人类的免疫系统有80%以上的共同点,且猪对内毒素休克比较敏感,是肾脏研究中最受欢迎的大型动物之一[19-21]。本研究选择雄性巴马小型猪为研究对象,在研究重度中暑动物肾损伤方面具有一定的先进性。
本研究借鉴了国内外重度中暑动物模型构建的实验方法及诊断标准,通过模拟高温高湿环境构建猪重度中暑模型。本研究中模型组巴马小型猪热暴露时间为(4.17±0.24)h,核心体温达到42 ℃的时间为(3.17±0.41)h,造模成功时核心体温为(43.25±0.29)℃,且均出现结膜充血及提肛反射、角膜反射明显减弱或消失,说明本研究成功构建早期重度中暑模型[11]。
本研究结果显示,模型组巴马小型猪的血清肌酐、尿素氮及尿蛋白水平均显著高于对照组,说明高温高湿环境对巴马小型猪肾功能造成明显的损伤。肾脏是重度中暑所致多器官功能障碍的重要靶器官。重度中暑会导致AKI甚至急性肾衰竭,这与局部炎症反应和全身炎症反应有着密切的关系。有研究表明,重度中暑患者会出现全身性炎症反应综合征、弥散性血管内凝血,甚至是多器官功能障碍综合征[22]。重度中暑的严重程度很大程度上取决于促炎因子水平和炎症反应发展的程度,如果不在早期进行干预,重度中暑患者很快就会死亡[23]。AKI在病理生理学上表现为炎症反应、免疫损伤、氧化应激、肾灌注减少以及细胞死亡和凋亡等[24-25]。AKI发生后,肾脏和其他组织中受损的细胞会释放预警因子和致病因子[26],预警因子和致病因子与肾脏细胞和白细胞表面识别受体结合可诱导有促炎功能的M1型巨噬细胞活化,活化后的M1型巨噬细胞会分泌如IL-1α、IL-6和TNF-α等一系列促炎细胞因子及活性氧,进而促进AKI的发展[27]。本研究结果发现,TNF-α、IL-1α阳性表达细胞主要分布于近端肾小管中,且模型组巴马小型猪肾组织中TNF-α、IL-1α阳性细胞比例显著高于对照组,这表明早期重度中暑即可使肾组织中IL-1α和TNF-α水平明显升高,进而可能促进AKI的发展。
本研究结果显示,模型组巴马小型猪肾组织中均出现明显的组织间隙水肿、中性粒细胞浸润、淤血、微血栓形成和肾小管坏死,其中,淤血、微血栓形成和中性粒细胞浸润主要发生于近端肾小管中,且模型组巴马小型猪的Paller评分显著高于对照组,说明重度中暑巴马小型猪早期肾组织即出现不同程度的病理损伤。其原因可能是由于除了炎症因子对重度中暑肾组织产生损伤外,肾组织中形成的广泛淤血及微血栓也参与了早期肾损伤的发生发展。
综上所述,重度中暑巴马小型猪早期肾组织即出现明显的病理学改变及肾功能损伤,且肾组织中IL-1α和TNF-α表达水平明显升高。
