水通道蛋白-9在缺氧缺血性脑病新生小鼠认知功能障碍中的作用
2022-07-27巴庆华
巴庆华
(河南中医药大学附属人民医院/郑州人民医院神经内科,河南 郑州 450000)
新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是指围生期各种原因导致的新生儿缺氧缺血性脑部病变[1]。HIE是新生儿死亡和继发性脑性瘫痪及智力障碍等的重要原因,发病机制复杂[2]。随着医疗技术的发展,HIE患儿病死率逐年下降,但存活新生儿常遗留认知功能障碍,严重影响患儿的生存质量[3-4]。水通道蛋白-9(aquaporin-9,AQP-9)广泛存在于脑组织,在皮层和海马组织中均有表达[5-6]。有研究显示,AQP-9对甘油、乳酸、尿素的强通透性不仅参与水的运输和平衡,而且参与脑组织能量代谢[7]。田培超等[8]研究发现,HIE小鼠脑组织中AQP-9表达水平显著升高,提示AQP-9可能在HIE的发生和发展中发挥作用。有研究发现,小鼠海马组织损伤后AQP-9表达水平升高[9],而海马是中枢神经系统中对空间记忆和学习至关重要的区域[10],因此,APQ-9可能与认知功能损害有关。陆蔚天等[11]建立了阿尔茨海默病小鼠模型,发现小鼠学习记忆能力明显下降,并且海马和齿状回组织中APQ-9表达明显上调,推测APQ-9与阿尔茨海默病小鼠的学习记忆损伤有关。本研究通过建立HIE小鼠模型,观察HIE小鼠空间学习记忆能力的变化和海马组织中APQ-9及增殖细胞核抗原Ki-67的表达,探讨APQ-9在HIE小鼠认知功能损伤中的作用及可能机制。
1 材料与方法
1.1 实验动物90只健康无特定病原级雄性昆明新生小鼠购自北京维通利华实验动物技术有限公司,许可证号SCXK(京)2021-0006,7日龄,体质量(6.25±1.02)g。
1.2 主要试剂和仪器抗AQP-9和Ki-67多克隆抗体购自美国Sigma公司,免疫荧光试剂盒购自上海卧宏生物科技有限公司,重组鼠AQP-9购自上海钰博生物科技有限公司,AQP-9和甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)引物购自美国Sigma公司,生物素标记的羊抗兔免疫球蛋白G、聚合酶链反应(polymerase chain reaction,PCR)相关试剂盒购自上海碧云天生物技术有限公司。PCR扩增仪购自美国ABI公司,WD-9413C型凝胶成像分析系统购自北京六一生物科技有限公司,Champ ChemiTMTop 610全自动化学发光荧光分析仪购自西安中团生物科技有限公司,CR22GⅢ高速离心机购自日本日立公司,Etho -Vision XT 7.0行为影像采集系统购自荷兰Noldus公司。
1.3 实验方法
1.3.1 实验分组和HIE模型制备将90只昆明小鼠随机分为对照组、模型组和AQP-9组,每组30只。对照组小鼠正常喂养,不建立HIE模型。模型组和AQP-9组小鼠参照NEMETH等[12]报道的方法构建HIE小鼠模型,模型制备方法:异氟烷吸入麻醉下行颈部正中切口,分离右侧颈总动脉,采用电凝法闭合颈总动脉,随后缝合伤口;术后将动物放置于37 ℃密闭舱内,通入含体积分数5% CO2的氮气,将氧体积分数调至8%,1.5 h后取出,送回母鼠笼中继续喂养。建模成功后30 min,AQP-9组小鼠给予腹腔单次注射20 μg AQP-9进行干预,对照组和模型组小鼠腹腔注射等量的生理盐水。
1.3.2 脑组织取材分别于干预后第1、3、7天,每组选取10只小鼠颈椎脱臼处死,剪下小鼠头部后立即在冰上解剖,分离并取出海马组织,标记后于-70 ℃冰箱中保存备用。每次随机选取5只小鼠的海马组织制备石蜡切片,进行免疫荧光检测;另5只小鼠的海马组织分为2份,一份用于提取RNA,另一份用于Western blotting检测。
1.3.3 反转录PCR法检测小鼠海马组织中AQP-9 mRNA表达取对照组和模型组小鼠海马组织,采用TRIzol法提取总RNA,以提取出的总RNA为模板,采用反转录试剂盒合成cDNA,然后进行PCR,反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s,共计40个循环,以GAPDH为内参。AQP-9上游引物序列为5′-GCAGTAGCCATGTACAG-3′,下游引物序列为5′-TGACCATGACCATGAC-3′;GAPDH上游引物序列为5′-ACCATAGCCATGGACATAG-3′,下游引物序列为5′-GTTACCATAGCCATGACA-3′。将扩增产物进行琼脂糖凝胶电泳,应用凝胶图像分析系统扫描条带的灰度值,采用2-ΔΔCt法计算AQP-9 mRNA的相对表达量。实验重复3次,取均值。
1.3.4 免疫荧光法检测小鼠海马组织中AQP-9和Ki-67蛋白表达取小鼠海马组织,40 g·L-1多聚甲醛固定、水冲洗、梯度乙醇脱水、二甲苯中浸泡、石蜡包埋,制作5 μm厚的石蜡切片;将切片进行二甲苯浸泡脱蜡、抗原修复、体积分数5%山羊血清封闭;加AQP-9(对照组和模型组)和Ki-67(对照组、模型组和AQP-9组)兔抗小鼠一抗(滴度11 000),4 ℃孵育过夜;磷酸盐缓冲溶液清洗3次,每次 5 min;加辣根过氧化物酶标记的山羊抗兔二抗(滴度1500),室温孵育1 h;4′,6-二脒基-2-苯基吲哚染色15 min,用Tris缓冲盐溶液洗涤5 min;封片,荧光显微镜下观察并拍照。AQP-9、Ki-67蛋白阳性表达为细胞质着红色,细胞核着蓝色,Merged指2种染色同时出现。应用Image-Pro Plus图像分析软件分析图像的吸光度值,以吸光度值表示AQP-9和Ki-67蛋白的相对表达量。
1.3.5 Morris水迷宫实验检测小鼠空间学习记忆能力干预后第3~7天处死小鼠前进行Morris水迷宫测试。将3组小鼠分别从4个象限放入水中,记录小鼠爬上平台所用时间(平台置于第3象限,低于水位2 cm),应用EthoVision XT 7.0行为影像采集系统记录小鼠60 s内爬上平台所需时间(逃避潜伏期)。逃避潜伏期越短,提示小鼠学习记忆力越好[13]。
2 结果
2.1 对照组和模型组小鼠海马组织中AQP-9 mRNA表达比较结果见表1。干预后第1、3、7天对照组小鼠海马组织中AQP-9 mRNA相对表达量比较差异无统计学意义(P>0.05)。模型组小鼠干预后第3天时海马组织中AQP-9 mRNA相对表达量显著高于干预后第1、7天,差异有统计学意义(P<0.05);模型组小鼠干预后第1天与第7天时海马组织中AQP-9 mRNA相对表达量比较差异无统计学意义(P>0.05)。干预后第1、3、7天,模型组小鼠海马组织中AQP-9 mRNA相对表达量显著高于对照组,差异有统计学意义(P<0.05)。
表1 对照组和模型组小鼠海马组织中AQP-9 mRNA相对表达量比较
2.2 对照组和模型组小鼠海马组织中AQP-9蛋白相对表达量比较结果见图1和表2。干预后第1、3、7天对照组小鼠海马组织中AQP-9蛋白相对表达量比较差异无统计学意义(P>0.05)。模型组小鼠干预后第3天时海马组织中AQP-9蛋白相对表达量显著高于干预后第1、7天,差异有统计学意义(P<0.05);模型组小鼠干预后第1天与第7天时海马组织中AQP-9蛋白相对表达量比较差异无统计学意义(P>0.05)。干预后第1、3、7天,模型组小鼠海马组织中AQP-9蛋白相对表达量显著高于对照组,差异有统计学意义(P<0.05)。
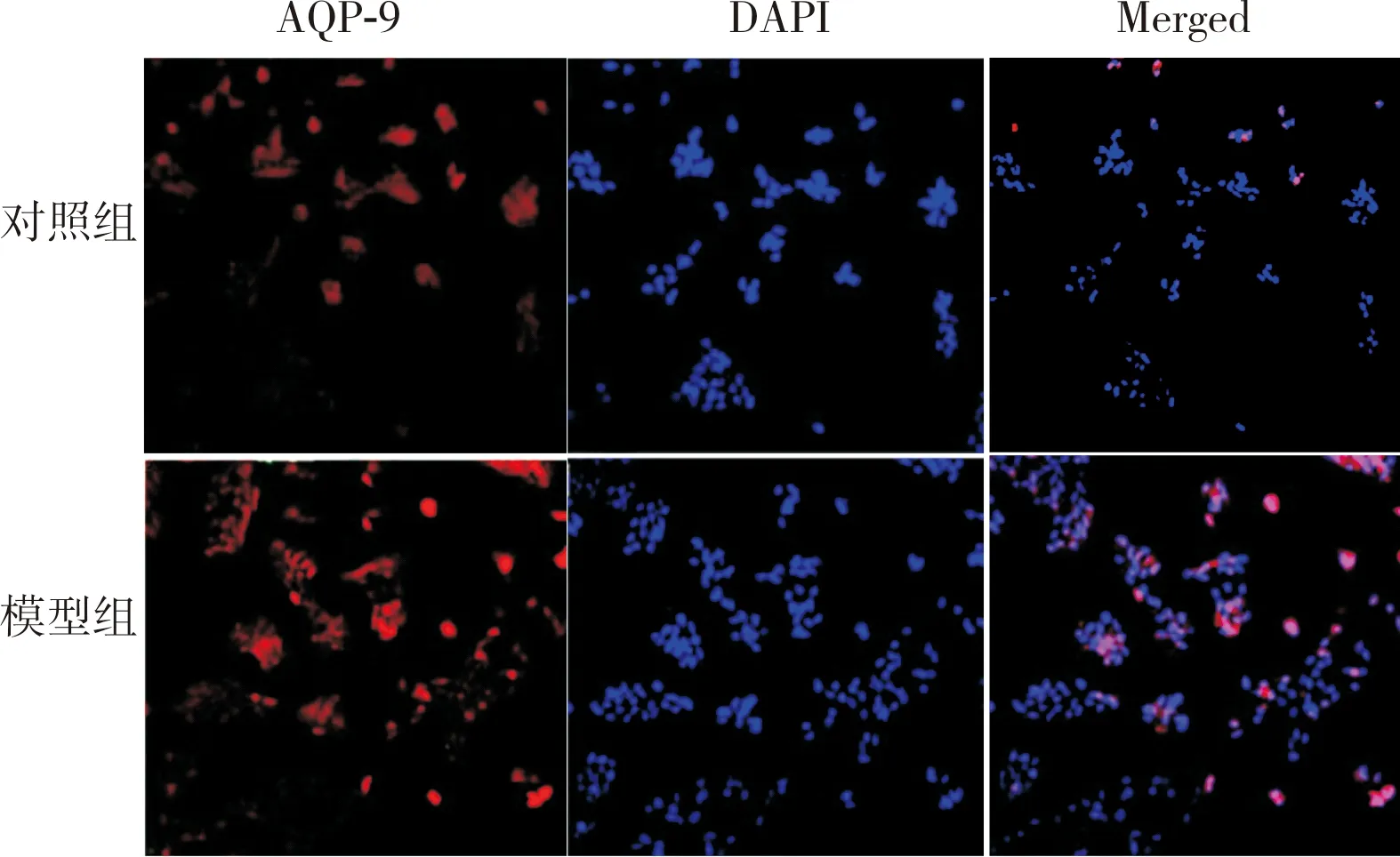
图1 干预后第3天对照组和模型组小鼠海马组织中AQP-9蛋白表达(免疫荧光染色,×200)
表2 对照组和模型组小鼠海马组织中AQP-9蛋白相对表达量比较
2.3 对照组、模型组和AQP-9组小鼠海马组织中Ki-67蛋白相对表达量比较结果见图2和表3。对照组小鼠干预后第1、3、7天海马组织中Ki-67蛋白相对表达量比较差异无统计学意义(P>0.05);模型组和AQP-9组小鼠干预后第7天时海马组织中Ki-67蛋白相对表达量显著高于干预后第1、3天,差异有统计学意义(P<0.05);干预后第1、3、7天,模型组小鼠海马组织中Ki-67蛋白相对表达量显著高于对照组,AQP-9组小鼠海马组织中Ki-67蛋白相对表达量显著高于对照组和模型组,差异均有统计学意义(P<0.05)。

图2 干预后第7天对照组、模型组和AQP-9组小鼠海马组织中Ki-67蛋白表达(免疫荧光染色,×200)
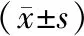
表3 对照组、模型组和AQP-9组小鼠海马组织中Ki-67蛋白相对表达量比较
2.4 对照组、模型组和AQP-9组小鼠Morris水迷宫实验逃避潜伏期比较结果见表4。干预后第3~7天,对照组和AQP-9组小鼠Morris水迷宫实验逃避潜伏期均逐渐缩短(P<0.05),而模型组小鼠Morris水迷宫实验逃避潜伏期无显著变化(P>0.05)。干预后第3、4、5天,3组小鼠Morris水迷宫实验逃避潜伏期比较差异无统计学意义(P>0.05);干预后第6、7天时,模型组小鼠Morris水迷宫实验逃避潜伏期显著长于对照组,差异有统计学意义(P<0.05)。干预后第6天,AQP-9组与对照组小鼠Morris水迷宫实验逃避潜伏期比较差异无统计学意义(P>0.05);干预后第7天,AQP-9组小鼠Morris水迷宫实验逃避潜伏期显著短于模型组,差异有统计学意义(P<0.05)。
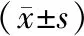
表4 对照组、模型组和AQP-9组小鼠Morris水迷宫实验逃避潜伏期比较
3 讨论
HIE是新生儿死亡和发生神经系统后遗症的主要原因,近年来,随着医疗技术的发展,HIE患儿存活率显著提高,但HIE患儿往往存在不同程度的神经系统后遗症,给患儿及其家庭、社会造成沉重的负担[14]。HIE发病机制复杂,是一个多环节、多因素的病理生理过程。因此,阐明导致新生儿HIE的发病机制对降低HIE的伤残率具有重要意义。
学习和记忆是人类赖以生存、不可缺少的高级神经生理活动,缺血缺氧会导致局部脑组织损伤,损害大脑的学习记忆功能,海马主要负责长时记忆的存储转换和定向等功能,与学习和记忆功能密切相关[15]。AQP-9广泛存在于细胞膜上,是具有促进水分子快速跨细胞膜转运作用的水通道蛋白[16]。AQP-9在神经系统中的主要作用是参与水平衡和能量代谢,对脑内水转运和脑脊液循环有重要作用[17]。田培超等[8]研究发现,HIE小鼠建模后30、60、90、120 min,顶叶组织中AQP-9 mRNA和蛋白的相对表达量显著高于正常小鼠,提示AQP-9可能在HIE的发生、发展中发挥重要作用。本研究结果显示,干预后第1、3、7天,模型组小鼠海马组织中AQP-9 mRNA和蛋白的相对表达量显著高于对照组,模型组小鼠干预后第3天时海马组织中AQP-9 mRNA和蛋白的相对表达量显著高于干预后第1、7天,提示AQP-9在HIE小鼠海马组织中表达上调,且AQP-9的表达可能有时间窗,AQP-9可能与小鼠HIE的发生、发展有关。小鼠脑部缺血缺氧可导致细胞膜上Na+-K+-ATP酶功能障碍,上调蛋白激酶A的表达,激活AQP-9 mRNA表达,从而使AQP-9蛋白表达升高。本研究采用Morris水迷宫实验观察3组小鼠的空间学习记忆能力,结果显示,随着测试时间延长,对照组和AQP-9组小鼠逃避潜伏期均明显缩短,而模型组小鼠逃避潜伏期未见明显变化;干预后第6、7天,模型组小鼠Morris水迷宫实验逃避潜伏期显著长于对照组,提示HIE小鼠的空间学习记忆能力受损。干预后第7天,AQP-9组小鼠Morris水迷宫实验逃避潜伏期显著短于模型组,提示外源性AQP-9可以显著改善HIE小鼠的空间学习记忆能力。HWANG等[18]研究发现,沙鼠脑缺血缺氧 5 min 后海马CA1区胶质细胞中AQP-9 mRNA表达明显上调。JI等[9]研究发现,缺血缺氧后小鼠海马神经元明显丢失,血管生成明显减少,且海马中AQP-9蛋白表达水平明显上升。
Ki-67是细胞增殖的内源性标志物。王骅等[19]研究发现,HIE新生小鼠脑组织中Ki-67表达水平明显下降,提示缺血缺氧损伤会降低神经细胞增殖。本研究结果显示,干预后第1、3、7天,模型组小鼠海马组织中Ki-67蛋白表达显著高于对照组,AQP-9组小鼠海马组织中Ki-67蛋白表达显著高于对照组和模型组,提示外源性AQP-9蛋白可能通过上调Ki-67蛋白表达而诱导神经细胞增殖,从而改善HIE小鼠的空间学习记忆能力。
综上所述,AQP-9在HIE小鼠海马组织中表达上调,且表达有时间窗;外源性AQP-9可能通过促进Ki-67蛋白的表达而诱导神经细胞增殖,从而改善小鼠的空间学习记忆能力。本研究尚存在不足之处,虽然发现外源性AQP-9可能通过促进Ki-67蛋白表达而诱导神经细胞增殖,但未明确其具体的机制;另外,本研究检测了海马组织中AQP-9的表达,未检测大脑皮层及基底节区AQP-9的表达,而这些脑区与认知功能密切相关;这些方面有待于后期实验进一步研究。
