增强MRI影像组学预测脑胶质瘤IDH-1基因突变的价值分析
2022-07-27唐薇段俊艳余子意翟昭华
唐薇,段俊艳,余子意,翟昭华
胶质瘤是原发颅内肿瘤最常见的类型,可发生在中枢神经系统的任何部位,具有侵袭性强、预后差、复发率高的特点[1]。世界卫生组织(Word Health Organization,WHO)中枢神经系统肿瘤分类将胶质瘤分为1~4 级[2],以往临床常依靠病理组织学来预测其预后。但该方法有创,且越来越多的研究表明,胶质瘤的预后与病理分级无关,其侵袭性主要受分子遗传组成的影响,若存在相同的基因改变,不同组织病理级别的脑胶质瘤患者可存在相似的生物学行为和预后[3]。2016 年版《WHO 中枢神经系统肿瘤分类》首次将基因型纳入脑胶质瘤的诊断及预后判断中,其中将异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)基因作为胶质瘤分子分型的核心依据之一[4]。基因可能是与治疗和预后相关的更为关键的预测因子[5],基于表型和基因型的联合分类方法能够让诊断更加明确,且更好地指导治疗、预测预后。大量研究表明IDH-1 突变型胶质瘤的预后明显好于野生型胶质瘤[6-7]。
临床工作中,常规影像学检查不能在术前预测基因型,故而不能准确地在术前确定治疗方法。而影像组学作为一种通过提取数千种基于覆盖整个肿瘤体积的强度直方图、几何和纹理分析的图像特征新兴研究方法,可以潜在表征肉眼看不见的肿瘤表型[8-9],进行客观、定量的分析,挖掘肿瘤的内在信息,分析肿瘤的异质性。目前,关于胶质瘤IDH 基因型预测方面的研究大多集中在对纹理特征的分析或者仅集中在某一种病理分级,限制了模型的应用。近年来,越来越多的学者采用更先进的MRI技术研究脑胶质瘤IDH基因型与患者预后、治疗的关系,但是这些技术对图像质量要求更高、后处理更复杂,从而难以获得。本研究利用术前2~4级胶质瘤增强MRI图像构建影像组学模型,操作更为简便,并与临床特征相结合,探讨影像组学对术前胶质瘤IDH-1 突变状态的预测价值,获得的影像组学特征更多样,是对现有研究的补充与扩展。
1 资料与方法
1.1 一般资料
回顾性分析2017年1月至2021年9月于川北医学院附属医院行术前MRI 扫描的110 例胶质瘤患者的临床及影像学资料。纳入标准如下:(1)经手术或穿刺活检证实为脑胶质瘤,并进行免疫组织化学分析,包括确定IDH-1基因型;(2)术前行头颅增强MRI检查;(3)临床资料完整;(4)无其他脑肿瘤病史或外伤史。排除标准:(1)术前接受过放化疗;(2)影像或临床资料不完善或图像质量不佳,伪影重。本研究最终纳入102 例胶质瘤患者。其中男57 例,女45 例,年龄21~78 岁(56±11.31)岁。102 例患者中,IDH-1 基因野生型73 例(WHO 2 级12 例,3 级15 例,4 级46 例),年龄(60.11±11.97)岁,IDH-1 基因突变型29 例(WHO 2 级15 例,3 级10 例,4 级4 例),年龄(47.12±9.75)岁。经过12 次简单随机分组,最终将102 例患者按照7∶3 随机分为训练组71 例和验证组31 例。收集患者临床信息,包括年龄、性别、胶质瘤病理级别、瘤周是否水肿、肿瘤内是否坏死、肿瘤是否强化、病灶侧别。本文为回顾性研究,经川北医学院附属医院伦理委员会批准,免除受试者知情同意,批准文号:2021ER198-1。
1.2 MRI检查
采用美国GE 公司Signa excite 1.5 T 和Discovery MR 750 3.0 T MRI扫描仪检查,分别使用头部8通道和32通道相控阵列线圈。所有患者术前均行头颅横断面MRI平扫与增强扫描,扫描基线平行于前后联合连线,扫描范围覆盖枕骨大孔至颅顶。扫描序列包括:轴位T1加权成像(T1-weighted imaging,T1WI)、轴位T2加权成像(T2-weighted imaging,T2WI)、轴位T2液体衰减反转恢复序列(T2 fluid attenuated inversion recovery,T2 FLAIR)、弥散加权成像(diffusion weighted imaging,DWI)及增强T1WI。DWI:b=0、1000 s/mm2。两种扫描机型及扫描序列具体参数见表1、2。增强检查对比剂为钆贝葡胺注射液(上海博莱科信谊药业有限责任公司),剂量为0.1 mmol/kg,速率2 mL/s。
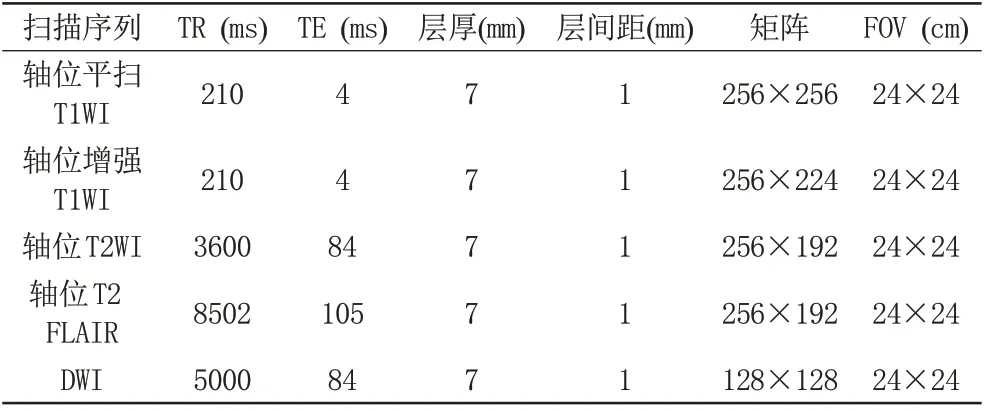
表1 1.5 T MRI扫描参数
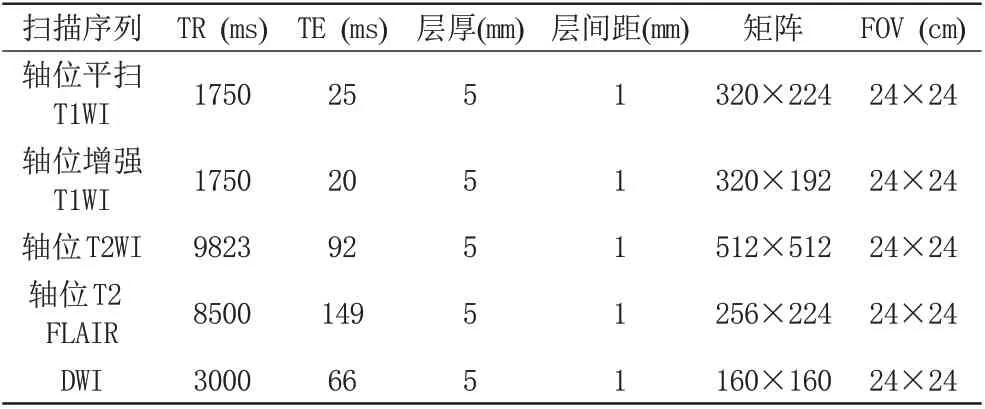
表2 3.0 T MRI扫描参数
1.3 影像组学过程
1.3.1 图像预处理及组学特征提取
将增强T1WI 二维图像以DICOM 格式加载到3D-Slicer 4.11 软件(https://www.slicer.org)进行影像组学分析,为了尽量消除不同MRI 机型和参数对于特征提取的影响,将体素大小统一设为1 mm×1 mm×1 mm。由两名具有3 年头颅MRI 诊断经验的放射科医师采用双盲法分别独立对图像进行分析,并手动逐层勾画每个肿瘤,即感兴趣区,包括肿瘤增强及坏死、囊变区,但不包括瘤周水肿。最终从增强T1WI 图像中共提取了851 个特征,包括107 个原始图像特征和744 个小波特征,其中162 个一阶特征(first-order)、675 个纹理特征[灰度共生矩阵(Gray Level Co-occurence Matrix,LCM)、灰度游程矩阵(Gray Level Run-Length Matrix,GLRLM)、灰度大小区域矩阵(Gray Level Size Zone Matrix,GLSZM)、邻域灰度差矩阵(Neighbourhood Gray-Tone Difference Matrix,NGTDM)、灰度依赖矩阵(Gray Level Dependence Matrix,GLDM)]及14个基于形状因子特征。
1.3.2 组间及组内特征一致性检验
从所有病例中随机抽取52例增强T1WI图像,由两名具有3年头颅MRI诊断经验的医师同时勾画感兴趣区并提取特征,进行组间影像组学特征的一致性检验(interclass correlation coefficients,ICC)。放射医师1于2周后再次勾画并提取特征,与第一次特征进行比较评价组内影像组学特征的一致性。ICC>0.75的特征被认为具有较好的一致性。
1.3.3 组学特征选择
为了避免在建模时的维数灾难,减少影像组学特征带来的偏差,首先通过独立样本t检验或MannWhitneyU检验对所有特征进行降维,然后使用最小绝对收缩和选择算子(least absolute shrinkage and selection operator,LASSO)对数据进行降维和特征选择,采用10 倍交叉验证法对模型进行检验,即将数据集分成10 份(folds 值设为10),轮流将其中9 份做训练集,1 份做验证集,通过变量选择和正则化来提高统计模型的预测精度和可解释性。
1.3.4 模型建立及验证
利用Logistic回归模型建立IDH-1的预测模型。为了进行比较,我们创建了3 组影像组学模型,即临床特征模型、T1WI 增强模型、临床联合影像组学模型。采用受试者工作特征(receiver operating characteristic,ROC)曲线下面积(area under the curve,AUC)评价模型诊断效能(0.5<AUC<0.7 为低诊断效率,0.7<AUC<0.9 为中等诊断效率,0.9<AUC为高诊断效率),并计算其敏感度、特异度及准确率。采用Delong检验比较3组模型的预测性能,P<0.05被认为差异有统计学意义。绘制校准曲线分析模型校准效能。
1.4 统计学分析
使用IBM SPSS 25.0 (https://www.ibm.com)和R 4.0.2(https://www.r-project.org)软件,符合正态分布且方差齐的计量资料比较采用独立样本t检验,否则采用Mann-WhineyU检验。计数资料采用卡方检验进行分析,P<0.05为差异有统计学意义。构建3组Logistic回归模型,绘制ROC曲线,采用Delong检验比较3组影像组学模型的评价性能。
2 结果
2.1 临床基本资料
训练组和验证组患者临床资料见表3。在所有7个临床特征中,年龄为计数资料,经检验不符合正态分布,故采用Mann-WhineyU检验。其余特征为计量资料,采用卡方检验。结果显示:训练组和验证组的病理分级和年龄差异具有统计学意义(P<0.05);突变型平均年龄低于野生型;两组性别、瘤周水肿、病变部位、肿瘤坏死及肿瘤强化差异无统计学意义(P>0.05)。
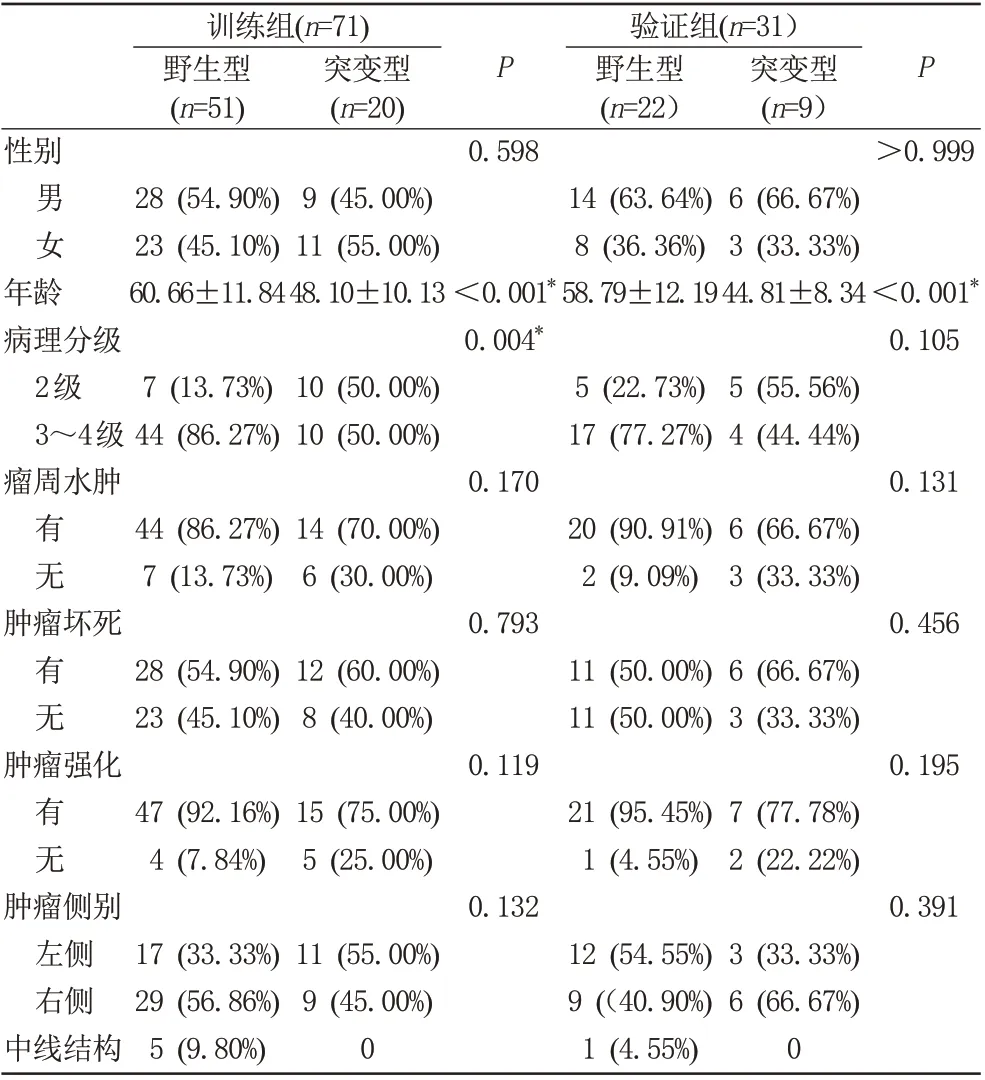
表3 训练组和验证组的临床资料
2.2 特征选择和模型构建
本研究进行组内ICC 后发现所有特征均具有较好的一致性。行组间ICC 后,从增强T1WI 组学特征中提取出508 个一致性较好的特征(ICC>0.75)。使用t检验、Mann-WhineyU检验以及LASSO Logistic 回归模型对这些影像学特征进行筛选及归一化处理,最终得到4个非零影像组学系数特征(图1)。其中包括原始图像中的纹理特征1 个(GLCM)、小波特征3 个(first-order、GLSZM、GLCM)。
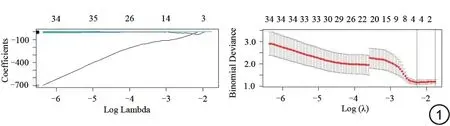
图1 LASSO回归降维收敛图和筛选特征变量二项式偏差图。
2.3 诊断效能
3 组模型训练组和验证组AUC 值、敏感度、特异度及准确率见表4,结果显示加入年龄的联合模型预测效能最好,训练组和验证组的AUC 值分别为0.886 (95%CI:0.81~0.96)、0.889 (95%CI:0.77~1.00),敏感度分别为0.90、0.86,特异度均为0.55,准确率分别为80%、77%,与临床特征模型对比差异具有统计学意义(P<0.05)。校准曲线显示在训练组和验证组中联合预测模型IDH-1 突变的概率和实际概率的一致性较好(图2)。
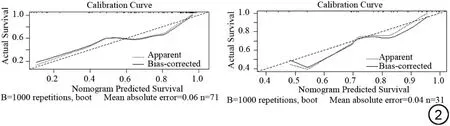
图2 联合模型预测IDH-1突变状态在训练组和验证组中的校准曲线。黑色实线与对角虚线越接近表示模型一致性越好。
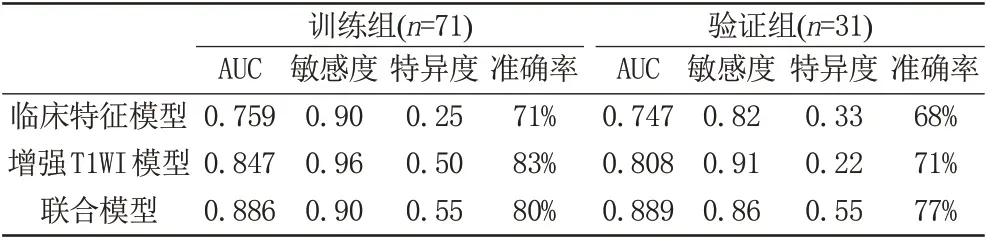
表4 三组影像组学模型训练组和验证组AUC值、敏感度、特异度、准确率
3 讨论
本研究验证了基于增强T1WI 的定量影像组学模型预测胶质瘤IDH-1 基因型的价值,结果显示结合年龄的联合影像组学模型在训练组和验证组均表现出较好的预测效能,AUC值分别为0.886、0.889,且使用Delong 法与临床特征模型对比,差异具有统计学意义,这证明了放射组学特征在预测胶质瘤IDH基因型方面的增量价值。本研究为术前预测性研究,创新型地将2~4 级胶质瘤病例均纳入研究,使其应用不受病理分级的限制。并将年龄与影像特征联合,年龄在术前容易获得,这使得纳入这一变量成为发展联合模型的常见策略,为术前预测胶质瘤IDH-1 基因型提供了一种个体化和非侵入性的预测工具。
IDH 基因是胶质瘤一个重要的遗传标志,在胶质瘤代谢、发病机制和进展中发挥着重要作用[2,4],IDH-1 是其最常见的一种突变型形式。根据IDH基因突变情况,胶质瘤可分为IDH突变型和野生型[10]。IDH 突变导致肿瘤代谢物D-2-羟基戊二酸产生[11],该物质潜在地促进IDH 突变肿瘤的免疫逃逸[12]。IDH-1 突变型胶质瘤比野生型生长缓慢,更易接受大体全切除,对放化疗更敏感,总体生存期和无进展生存期更长,预后和存活生存率更高[13]。
3.1 增强T1WI影像组学在预测脑胶质瘤IDH-1突变状态的临床价值
本研究对比分析IDH-1 突变型和野生型患者的临床及MRI 相关资料,结果表明年龄、病理分级是预测IDH-1 突变状态的独立危险因素。研究结果证实突变型患者的平均年龄较野生型患者年龄更小,差异有统计学意义,且结合年龄的影像组学模型在三组中的预测性能最好,与Tan等[14]的研究结果一致。虽然越来越多的学者使用MRI 先进技术分析IDH 突变状态与胶质瘤之间的关系[15-16],但是一项Meta分析显示常规MRI序列的机器学习在预测IDH突变方面显示出更好的特异性[17]。本研究在增强T1WI 序列上提取大量高通量影像组学特征,操作简单,易于获得。有学者[1,18]发现基于术前增强MR的放射组学模型可以有效地预测高级别胶质瘤的IDH-1基因。Park等[19]发现在常规序列影像组学中加入弥散张量成像(diffusion tensor imaging,DTI)影像组学能显著提高低级别胶质瘤IDH状态的预测准确性。Li 等[20]分别从多参数MRI 的增强区、非增强区、坏死、水肿、肿瘤核心以及整个肿瘤六个区中提取特征,结果表明多区域影像组学模型能够在术前预测胶质母细胞瘤的突变状态,且将年龄与全区域相结合可获得最佳预测性能。但是上述研究仅集中在低级别或高级别胶质瘤,需要肿瘤病理分级作为前提,分级信息需要侵入性检查获得,极大地限制了影像组学的临床应用。而本研究未将病理分级纳入临床特征,使得研究不受病理分级的限制,扩展了影像组学模型的临床应用,为术前预测脑胶质瘤IDH-1基因状态提供了可能。
3.2 影像组学特征与胶质瘤IDH突变状态的关系
影像组学作为非侵入性的影像医学检查方法,使用自动数据特征化算法将MRI 图像中肉眼不可见的信息转换为定量的高通量特征,获取与临床疾病潜在关联。本研究从102 例胶质瘤患者的增强T1WI图像中提取了851个特征,应用LASSO法进行特征提取,结果显示原始图像中的纹理特征(GLCM)、小波图像特征(first-order、GLSZM、GLCM)与IDH-1 突变状态相关度最高。小波图像特征在本模型中具有重要意义的原因可能是其较原始特征占有更高的权重,相比原始特征的信息量更大。一阶特征和纹理特征反映肿瘤的异质性[21]。Hsieh等[22]从肿瘤组织中提取了定量的一阶特征、形态和纹理特征来确定胶质母细胞瘤的IDH 状态,使用Logistic 回归分类器对特征集进行评估,以建立预测模型,结果表明纹理特征预测准确率为85%,显著高于形态特征和一阶特征。Han 等[23]利用常规磁共振成像直方图和GLCM特征得出的联合变量可以精确检测IDH-1突变的胶质瘤。Sohn等[24]研究发现在预测IDH突变状态中,与之相关度最高的为纹理特征和形状特征。以上研究均表明IDH 突变型和野生型之间存在某些纹理上的差别,与本研究结果一致。
3.3 局限性
首先,本研究样本量小,特别是IDH-1 突变型,使得训练组和验证组的分类模型会出现采样不均衡的问题。其次,本研究只使用了MRI 增强单一序列,还应纳入其他常规序列或先进的MRI 技术,以构建更全面、更先进的影像组学模型。最后,本研究只关注了胶质瘤的IDH 基因型,MRI 影像组学与胶质瘤其他基因表达的关系还有待进一步研究。
综上所述,基于增强MRI 影像组学模型可以在术前有效的预测胶质瘤IDH-1 基因型,特别是对于那些不能手术切除患者治疗前的常规评估方法,从而指导临床治疗、预测预后。
作者利用冲突:全部作者均声明无利益冲突。
