多模态MRI在复发缓解型多发性硬化深部灰质的应用
2022-07-27王小花丁爽陈晓娅曾春殷菲悦李咏梅
王小花,丁爽,陈晓娅,曾春,殷菲悦,李咏梅
多发性硬化(multiple sclerosis,MS)是中枢神经系统常见的慢性炎性脱髓鞘疾病,以复发缓解型MS(relapsing-remitting MS,RRMS)最多见,是青年人非创伤性残疾的首要原因[1-2]。传统观点认为MS是典型的白质局灶性脱髓鞘,即在常规T2 加权成像(T2 weighted image,T2WI)上的白质高信号病变,近年来随着病理及影像技术的发展表明MS也存在广泛的灰质受累,但其是否独立于白质病变尚不明确[3-4]。此外,既往研究表明MS 患者深部灰质萎缩[5],并存在不同程度的微结构损伤及铁代谢紊乱[6-8],但既往研究关注患者多为10 年以上病程的中晚期MS,较早期MS的微结构及铁代谢改变情况尚不清楚。而MS早期以炎性反应为主,尽早干预可有效避免进行性神经损伤累积和不可逆残疾[9]。因此,对早期MS进行能够反映组织内不同生物学特征的多模态MRI 检测,有望更加全面地揭示MS 深部灰质的病理生理改变,挖掘可用于疾病早期监测的有效影像学指标。在现有的多模态MRI技术中,基于高分辨率3D-T1 加权成像(T1 weighted image,T1WI)可有效测量脑体积,扩散张量成像(diffusion tensor imaging,DTI)可敏感地反映组织早期微结构异常,定量磁敏感图(quantitative susceptibility mapping,QSM)可无创定量评估组织铁含量,相较既往磁敏感MRI 技术定量更直接、准确[10]。因此,本研究拟在评估RRMS患者疾病相对早期灰质体积变化基础上联合DTI和QSM量化微结构损伤和铁含量异常,并探究其与白质病变及临床残疾的相关性,白质病变通过白质病灶体积(white matter lesion volume,WM-LV)评估。
1 资料与方法
1.1 研究对象
前瞻性纳入2020年7月至2021年6月40例于重庆医科大学附属第一医院诊断为RRMS 的患者,男12 例,女28 例,年龄18~50 (29.7±7.4)岁,中位病程2.5 (0.8,6.8)年。入组标准:(1)年龄18~50 岁;(2)病程<10年;(3) RRMS诊断标准参照文献[11]。排除标准:(1)罹患其他神经精神疾病;(2)颅脑手术及外伤史;(3)存在MRI 扫描禁忌。同期招募32 名年龄及性别相匹配的健康人作为对照组(healthy controls,HC),男9 例,女23 例,年龄20~50 (33.1±8.6)岁。本研究经本院伦理委员会审查通过(批准文号:2022-027),检查前所有受试者均签署知情同意书。
1.2 仪器与方法
采用Siemens Magnetom Skyra 3.0 T MR 扫描仪,32通道标准头部线圈,采集头部MRI数据。各序列参数如下:3D-T1WI 序列:TR 2300 ms,TE 2.26 ms,FOV 256 mm×256 mm,采集矩阵256×256,层厚1 mm;3D-液体衰减反转恢复(fluid attenuated inversion recovery,FLAIR)序列:TR 5000 ms,TE 388 ms,FOV 256 mm×256 mm,采集矩阵256×256,层厚1 mm;QSM序列:TR 36.0 ms,TE1 7.50 ms,△TE 7.5 ms,TE4 30.0 ms,FOV 220 mm×220 mm,采集矩阵256×256,层厚2 mm,翻转角20°;DTI 序列:TR 5100 ms,TE 97 ms,FOV 220 mm×220 mm,层厚4 mm,b 值取0 和1000 s/mm2,取30 个不同扩散方向。扫描范围从颅顶至枕骨大孔,所有轴位扫描均在中间矢状面定位,中心线平行于前后连合线。在MRI扫描当天,由一名具有5 年以上年资的神经内科医师协助相关病史采集,用扩展残疾状态量表(Expanded Disability Status Scale,EDSS)评估受试者残疾程度。
1.3 图像重建及数据处理
1.3.1 WM-LV及核团体积
WM-LV 在3D-FLAIR 序列中测量,由2 名5 年以上MR 研究经验的医师基于ITK-SNAP (Version 3.8;http://www.itksnap.org/pmwiki/pmwiki.php)软件在RRMS 患者的3D-FLAIR 序列上逐层勾画白质病灶测得体积,重复勾画两次,其体积通过组内相关系数检验(ICC=0.963,P<0.001),取平均值为该患者WM-LV;基于MATLAB R2013b (Version 8.2.0.701)平台的SPM 8 (Version 6313;https://www.fil.ion.ucl.ac.uk/spm/software/spm8/)的VBM 对3D-T1WI数据进行预处理,随后基于REST软件,以双侧尾状核、壳核、苍白球、丘脑为感兴趣区(region of interest,ROI) (图1A),提取各核团体积。
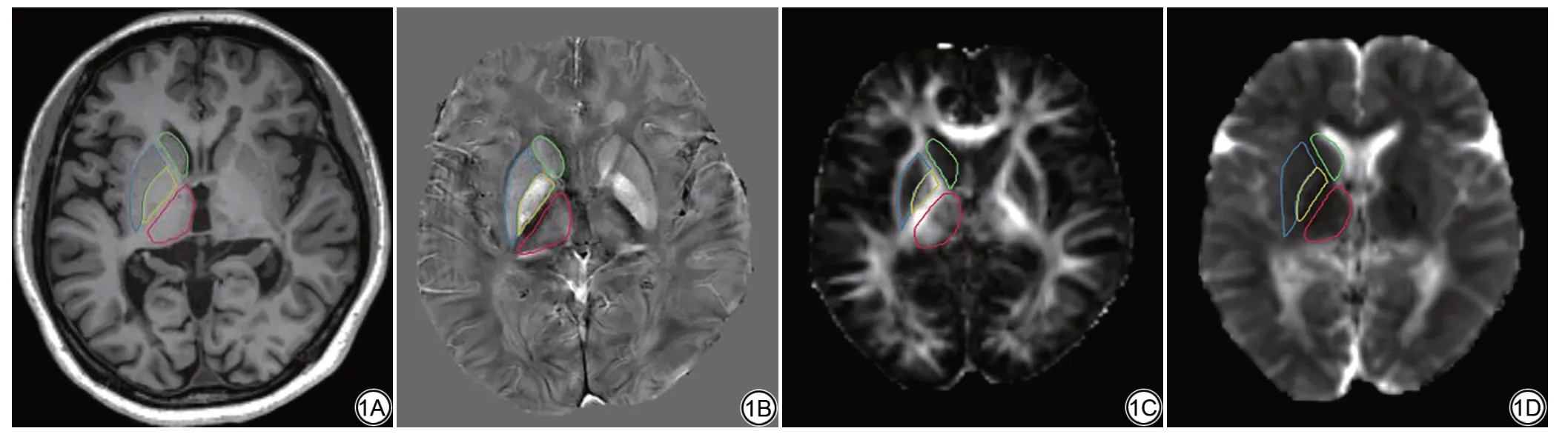
图1 RRMS 患者,女,30 岁,头晕伴步态不稳1 周,图1A~1D 分别为3D-T1WI、QSM、FA 及MD 图,ROI 显示在大脑一侧,绿色-尾状核(头);蓝色-壳核;黄色-苍白球;红色-丘脑。注:RRMS:复发缓解型多发性硬化;T1WI:T1加权成像;QSM:定量磁敏感图;FA:各向异性分数;MD:平均扩散率;ROI:感兴趣区。Fig.1 RRMS patient,female,30 years old,dizziness with walking instability for one week,1A-1D show 3D-T1WI,QSM,FA and MD images respectively,ROI is shown on one side of the brain, green-caudate nucleus (head); blue-putamen; yellow-globus pallidus; red-thalamus. Note: RRMS: relapsing-remitting multiple sclerosis;T1WI:T1 weighted imaging;QSM:quantitative magnetic sensitivity mapping;FA:fractional anisotropy;MD:mean diffusivity;ROI:region of interest.
1.3.2 QSM及DTI图像重建及数据处理
QSM 图像重建是基于MATLAB 平台的STISuite(Version 3.03;http://people. eecs. berkeley.edu/~chunlei.liu/software.html)软件,步骤包括场图拟合、相位解缠绕、背景场去除、磁化率反演;DTI 图像重建是基于FSL (Version 5.0.10;https://fsl.fmrib.ox.ac.uk/fsl/fslwiki/)软件,经过b0 像配准、头动及涡流校正、张量计算得到各向异性分数(fractional anisotropy,FA)和平均扩散率(mean diffusivity,MD)图。随后基于FSL 软件将个体空间QSM 及FA、MD 图配准至蒙特利尔神经病学研究所(Montreal Neurological Institute,MNI)标准空间坐标,以相同ROI 提取各核团定量磁化率值(quantitative susceptibility value,QSV)及FA和MD值(图1B~1D)。
1.4 统计学方法
采用SPSS 22.0统计分析软件。以±s表示符合正态分布的计量资料,采用独立样本t检验;以M (Qr)表示呈偏态分布的计量资料,采用秩和检验;以χ2检验比较组间性别差异。RRMS患者深部灰质体积、QSV及FA、MD值与WM-LV相关性评估用Pearson相关检验,深部灰质各参数与病程及EDSS评分相关性评估用Spearman相关检验。P<0.05认为差异具有统计学意义。
2 结果
2.1 基本资料及EDSS评分、WM-LV
RRMS 组与HC 组性别(χ2=0.03,P=0.86)、年龄(t=1.82,P=0.07)差异均无统计学意义。RRMS组中位病程2.5 (0.8,6.8)年,中位EDSS 评分为2.0 (1.0,2.8),WM-LV为(18.87±18.14) mm3。
2.2 各灰质核团体积、QSV及FA、MD值比较
与HC组相比,RRMS组各灰质核团体积减小,丘脑QSV 减低,尾状核及丘脑FA 值降低伴MD 值升高,差异均有统计学意义(P均<0.05);余核团QSV 及FA 和MD值差异均无统计学意义(P>0.05),见表1。
表1 两组各灰质核团体积、QSV、FA及MD值比较(±s)Tab.1 Comparison of the volume,QSV,FA and MD values of each gray matter nucleus in the two groups

表1 两组各灰质核团体积、QSV、FA及MD值比较(±s)Tab.1 Comparison of the volume,QSV,FA and MD values of each gray matter nucleus in the two groups
注:RRMS:复发缓解型多发性硬化;HC:健康对照组;QSV:定量磁化率;FA:各向异性分数;MD:平均扩散率。
组别体积尾状核苍白球壳核丘脑QSV (ppb)尾状核苍白球壳核丘脑FA值尾状核苍白球壳核丘脑MD值(×10-3 mm2/s)尾状核苍白球壳核丘脑RRMS组(n=40)HC组(n=32)t值P值0.051±0.010 0.026±0.007 0.046±0.012 0.062±0.008 0.055±0.005 0.030±0.004 0.056±0.007 0.074±0.004 2.165 3.179 4.261 8.510 0.034 0.002<0.001<0.001 28.988±4.910 74.738±12.706 30.123±4.701 5.515±2.298 29.919±4.264 76.366±9.058 31.744±6.140 6.884±1.847 0.847 0.611 1.269 2.741 0.400 0.543 0.209 0.008 0.253±0.058 0.287±0.033 0.314±0.021 0.401±0.019 0.303±0.034 0.296±0.044 0.307±0.018 0.383±0.025 4.568 1.017 1.560 3.368<0.001 0.313 0.123 0.001<0.001 0.437 0.049<0.001 0.841±0.166 0.576±0.027 0.603±0.028 0.656±0.074 0.667±0.049 0.581±0.023 0.593±0.011 0.595±0.018 6.260 0.783 2.011 5.017
2.3 相关性分析
RRMS 组壳核和丘脑FA、MD 值与对应核团体积改变显著相关(P均<0.01),但各核团QSV 与对应核团体积相关性差异无统计学意义(P均>0.05),见表2。
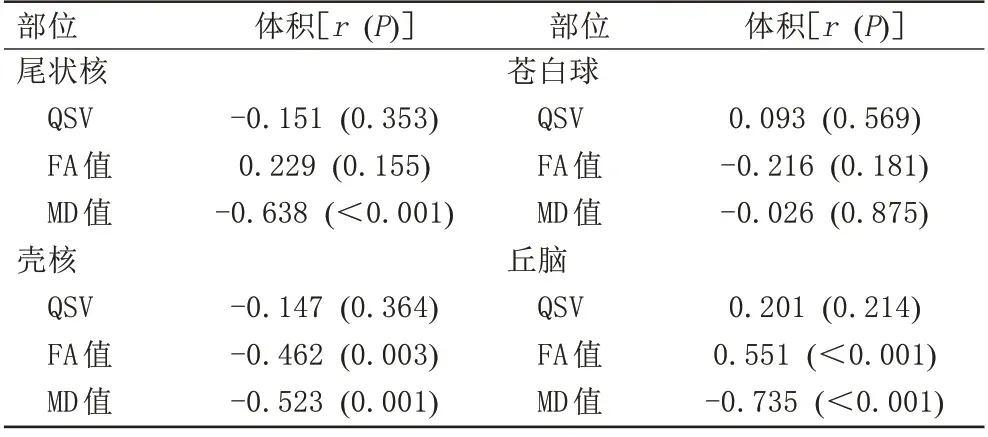
表2 RRMS灰质核团QSV和FA、MD值与相应体积相关性Tab.2 Correlation between QSV,FA and MD values of RRMS gray matter nuclei and the corresponding volume
RRMS 组各灰质核团参数与白质病灶相关分析显示:各核团体积均与WM-LV 呈显著负相关(P均<0.05),尾状核FA 值与其呈显著负相关,伴尾状核、壳核、丘脑MD 值与其呈显著正相关(P均<0.01),余FA及MD 值与其无显著相关性(P均>0.05);同时,核团QSV与WM-LV均无显著相关性(P均>0.05),见表3。

表3 RRMS组灰质核团各指标与WM-LV及病程、EDSS评分相关性Tab.3 Correlation of various indicators of gray matter nucleus in RRMS group with WM-LV,course of disease,and EDSS score
RRMS组各核团体积均与病程呈显著负相关(P均<0.05);DTI参数中仅丘脑及壳核FA值与病程呈显著负相关(P<0.05),各核团QSV与病程间均无显著相关性(P均>0.05)。仅丘脑QSV 与EDSS 评分显著负相关(P<0.05),其余相关均无统计学意义(P均>0.05),见表3。
3 讨论
深部灰质核团是大脑功能的重要组成部分,其涉及运动、感觉、认知、情感等多项复杂功能,丘脑尤其重要,是中枢神经系统的主要中继中心,与皮质及皮质下区域高度连接[12]。深部灰质损伤与MS 患者疲劳、残疾及认知障碍等多方面相关[6,13]。常规MRI 对MS 深部灰质异常显示不佳,尤其是疾病早期;既往病理强调脑萎缩是MS 最终阶段的反映,但研究表明MS患者早期即有脑萎缩并进行性发展,尤其是深部灰质[5]。高分辨率3D-T1WI结构像可较为精确地测量灰质体积改变,DTI 可通过反映局部水分子各向扩散情况,无创地显示组织早期微观结构变化;此外,深部灰质异常铁沉积被认为是MS患者神经退变的生物标志物[14],QSM 可无创定量评价组织铁含量,克服了磁敏感加权成像的相位卷褶伪影,定量更准确[10];因此,本研究通过多模态MRI 联合分析MS 疾病相对早期阶段深部灰质异常改变的不同病理生理特征。
3.1 3D-T1WI 量化RRMS深部灰质核团体积
脑萎缩被认为是MS进展的重要标志,皮质及深部灰质萎缩是导致MS全脑萎缩的主要原因[15],但灰质萎缩是否独立于白质局灶性脱髓鞘病变尚不清楚。本研究结果显示RRMS患者疾病早期深部灰质即有明显萎缩,以丘脑为著,且体积减小与病程呈显著正相关,该结果与其他针对MS的MRI及组织病理相关性研究结果一致[16-17],这些研究表明MS 患者深部灰质如丘脑、海马、尾状核、壳核、苍白球等均存在不同程度萎缩,并随病程持续进展。EDSS是常用于评估MS患者残疾程度的指标,但本研究尚未观察到结构改变与EDSS 相关性,与以往文献报道存在差异[18],推测可能与疾病早期EDSS评分容易受疾病状态波动影响有关[19]。此外,MS灰质萎缩的具体病理机制尚不明确,有研究认为是白质病灶继发的远处损伤致使灰质萎缩[20],但也有研究表明局部小胶质细胞激活导致直接的灰质损伤及神经退变[21]。本研究中灰质萎缩与WM-LV 显著负相关,提示RRMS 灰质萎缩与白质病变相关而非独立发展,与Al-Radaideh 等[7]研究结果一致。体积量化了灰质的宏观结构变化,还需进一步探究其内的微观病理生理改变以助阐明MS灰质异常的潜在病理特点。
3.2 DTI量化RRMS深部灰质核团微结构异常
DTI 可通过局部水分子扩散情况量化微结构损伤,深部灰质的DTI 参数主要与神经元密度、树突和轴突数量以及髓鞘完整性相关[22],FA 值降低可能反映了局部轴突横断性损伤、神经元变性等,MD 值增加可能反映了局部细胞膜结构破坏、组织间隙扩散增加等。本研究结果显示相较HC,RRMS 患者尾状核及丘脑的FA 值降低,MD 值升高,并与WM-LV 显著相关,提示疾病早期发生明显微结构损伤,且与白质病变关系密切,这与既往研究相符[17]。熊华等[23]纵向研究发现RRMS患者苍白球和丘脑FA值降低,尾状核和丘脑MD 值升高,并随时间进行性发展;Cappellani 等[17]研究显示MS丘脑和海马FA值减低,尾状核、丘脑及海马MD 值升高,且与白质病灶负荷和正常白质体积关系密切;这可能是因为白质纤维与深部灰质紧密连接相关,但由于灰质结构中有少量白质纤维,对灰质核团FA、MD值存在一定影响,未来需要将两者分离以便更好阐明深部灰质异常与白质病变的关系。此外,相关分析显示各核团参数与EDSS评分均未见显著相关性,这可能与DTI 参数反映的是局部微扩散改变,对临床神经功能改变不明显及EDSS 波动性有关,尤其是疾病早期阶段[19]。因此深部灰质微结构损伤与疾病严重程度之间的关系有待进一步探究。
3.3 QSM量化RRMS深部灰质核团铁浓度
QSM可通过QSV直接量化深部灰质局部铁浓度异常。相较既往文献报道[6,24]纳入的长期病程,本研究结果显示RRMS患者在疾病较早期阶段即有丘脑铁浓度的明显降低,但尾状核、苍白球及壳核差异无统计学意义。Burgetova 等[25]进一步比较MS 亚型结果表明RRMS 较原发进展型MS 丘脑QSV 降低,Zivadinov等[6]发现继发进展型MS较RRMS丘脑QSV更低,且与长病程相关;其余核团磁化率差异均无统计学意义,强调了丘脑铁浓度在MS 亚型中的突出差异。目前MS患者丘脑铁浓度降低机制不明确,可能是继发于白质病变所致的铁转运通路异常[26]或原发于灰质局部代谢异常[27]。本研究中各核团QSV与WM-LV和对应核团体积无显著相关性,提示深部灰质铁浓度异常可能独立于远处白质病变及局部组织丢失(萎缩)的继发影响。此外,丘脑QSV 与EDSS 评分显著负相关提示丘脑QSV 可能是MS 残疾程度的标志,与Zivadinov等[6]研究一致,但由于EDSS的波动性和残疾程度的有限代表性,仍需大样本研究进一步验证丘脑QSV作为MS疾病严重程度的标志监测疾病进展的可行性。
3.4 多模态MRI对RRMS深部灰质核团的对比分析
多模态MRI结果表明,RRMS患者较深部灰质核团FA、MD值及QSV部分异常,核团萎缩更为明显;组织病理表明影像量化的灰质萎缩反映了神经元变性[28]。本研究提示深部灰质在RRMS 中起着重要作用,其在疾病相对早期阶段就有明显神经退行性变,量化结构体积相较DTI 和QSM 更敏感地反映了RRMS 患者深部灰质的异常,DTI 和QSM 参数量化的是微观上的不同生物学特性。此外,对比RRMS患者各核团参数,发现丘脑相较其他核团,不仅体积萎缩明显,同时存在微结构损伤和铁代谢紊乱,且仅有丘脑铁浓度的差异有统计学意义,并与EDSS评分呈显著负相关,突显了丘脑受累在RRMS 的显著性和独特性,可能与丘脑作为中枢神经重要中继中心,与皮质及皮质下区域高度连接,参与广泛神经功能密切相关[12]。本研究提示丘脑异常是RRMS 的重要特点,可作为疾病监测的重要结构。由于丘脑是多个核复合体组成,精细且复杂,未来需要进一步对其亚区分割以便深入研究RRMS患者丘脑潜在病理生理特点及临床意义。
本研究存在一些局限性,仅纳入RRMS患者,未对不同类型MS间灰质异常进行分析;且为横向研究,无法得到各灰质核团体积及其内微结构损伤、铁浓度变化的动态演变规律。因此,在以后的研究工作中,拟纳入更大样本进行亚分类、结合时间随访以便进一步阐明MS深部灰质的潜在病理特点。
总之,RRMS 患者在疾病相对早期阶段,深部灰质即有明显萎缩,伴有尾状核和丘脑的微结构损伤及丘脑明显铁紊乱,且灰质异常部分独立于白质局灶性脱髓鞘;相较微结构和铁浓度异常,萎缩更敏感地反映了患者深部灰质的异常;同时丘脑广泛受累是RRMS 的重要特征,丘脑铁浓度可能成为MS 疾病严重程度的标志并监测疾病进展。
作者利益冲突声明:全部作者均声明无利益冲突。
